金属钝化
- 格式:pptx
- 大小:6.67 MB
- 文档页数:41


金属的钝化在现代工业生产中,我们常常会遇到金属钝化现象。
一些较活泼的金属,在某些特定的环境介质中,会呈现惰性状态。
如金属的电极电位因外加阳极电流或局部阳极电流而向正方向移动,当超过一定数值后,金属的溶解速度反而剧烈地减小了,铁和不锈钢在硫酸中进行阳极极化时便观察到此现象。
金属阳极溶解过程中的这种“反常”现象称为金属的钝化过程。
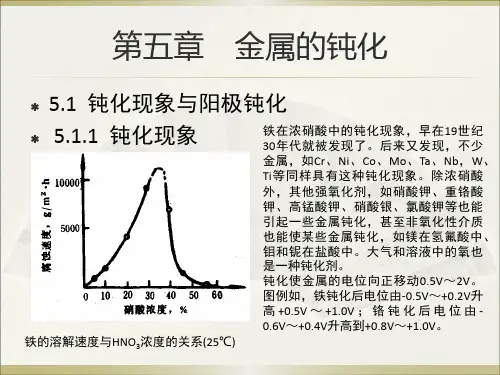
§1-1钝化现象及其分类一、钝化现象及定义如果在室温时试验铁片在硝酸中的反应速率以及和硝酸浓度的关系,我们将会发现铁的反应速率,最初是随硝酸浓度增大而增大的。
当硝酸浓度增加到30%~40%时,溶解度达到最大值,若继续增大硝酸的浓度(>40%),铁的溶解度却突然成万倍下降,并使表面处于一种特殊的状态。
这时即使把它转移到硫酸中去,也不会再受到酸的浸蚀。
也就是说当硝酸增大到一定程度时,它的反应速率迅速减小,继续增大浓度时,它的反应速率更小,最后不再起反应,即铁变得“稳定”了,或者像一般说的,铁发生“钝化”了。
除了铁之外,其他一些金属也可以发生钝化。
例如,Cr、Ni、Co、Mo,Al、Ta、Nb和W等,其中最容易钝化的金属是Cr、Al、Mo,Ni、Fe,称作自钝化金属,能在空气中发生自钝化。
不仅硝酸,其他强氧化剂如浓硫酸、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起金属钝化。
但是钝化现象的发生虽然通常和氧化性介质作用有关,但是有些金属却可在非氧化性介质中钝化。
例如镁可以在氢氟酸中钝化,钼和铌可以在盐酸中钝化,汞和银可以在氯离子的作用下发生钝化,不锈钢在硝酸中钝化等等。
金属钝化的定义:在一定条件下,当金属的电位由于外加阳极电流或局部阳极电流而移向正方向时,原来活泼地溶解着的金属表面状态会发生某种突变,同时金属的溶解速度急速下降,这种表面状态的突变过程叫做钝化。
二、金属钝化的几种类型金属钝化可以分为三种类型:化学钝化、阳极钝化、机械钝化1.化学钝化又称自动钝化(autopassivation)。

金属钝化的名词解释金属钝化是指一种物理和化学过程,通过这种过程可以使金属表面形成一层具有良好稳定性和抵御腐蚀能力的氧化物或其他化合物层。
金属钝化可以防止金属表面与环境中的氧、湿度、酸碱等物质接触,从而减缓或消除金属的腐蚀现象。
在工业生产和实际应用中,金属钝化被广泛应用于金属制品和构件的防腐蚀处理中。
一、金属钝化的原理金属钝化的原理主要包括化学反应和物理屏障机制。
在化学反应层面上,金属与环境中的氧、湿度、酸碱等物质发生反应,形成一层稳定的金属氧化物或其他化合物。
这层氧化物的存在使得金属表面与外部环境的腐蚀物质无法直接接触,从而降低了金属腐蚀的速度。
在物理层面上,金属钝化层的形成可形成一层物理屏障,阻挡外界物质对金属表面的直接接触,从而实现金属表面的保护作用。
二、金属钝化的方法1. 金属表面涂层:通过在金属表面涂覆一层抗腐蚀性较强的涂层,形成一种物理屏障和化学反应层,实现金属钝化的目的。
常见的涂层材料包括油漆、瓷釉、镀层等。
这些涂层能够阻隔金属表面与外界环境的直接接触,减少氧、湿度以及酸碱等腐蚀物质的侵蚀。
2. 化学处理:利用化学方法,在金属表面形成一层稳定的氧化物或者化合物层。
常见的化学处理方法有酸洗、氧化、镀膜等。
这些处理方法通过改变金属表面的化学性质,形成一层具有保护性质的钝化层,防止金属的腐蚀。
3. 电化学方法:利用电化学原理,在金属表面施加电流,通过阳极氧化或者阳离子沉积的方式,形成一层致密、均匀且具有较高保护性能的钝化膜。
这种方法适用于对金属表面进行钝化膜增厚的处理,如电镀、阳极氧化等。
三、金属钝化的应用金属钝化在工业生产和实际应用中具有广泛的应用价值。
1. 防腐蚀:金属钝化主要用于金属制品和构件的防腐蚀处理。
通过在金属表面形成保护性的钝化层,减缓或消除金属腐蚀现象,延长金属制品的使用寿命。
2. 美观装饰:金属钝化可以改变金属表面的外观,增加金属制品的装饰性和美观性。
常见的金属钝化方法包括电镀和阳离子沉积等,可以在金属表面形成不同颜色的膜层,使金属制品呈现出丰富多样的外观效果。






金属钝化钝化是将金属置于亚硝酸盐、硝酸盐、铬酸盐或重铬酸盐溶液中处理,使金属表面生成一层铬酸盐钝化膜的过程。
常作为锌、镉镀层的后处理,提高镀层的耐蚀性;有色金属的防护;提高漆膜的附着力等。
铁、铝在稀HNO3或稀H2SO4中能很快溶解,但在浓HNO3或浓H2SO4中溶解现象几乎完全停止了,碳钢通常很容易生锈,若在钢中加入适量的Ni、Cr,就成为不锈钢了。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为钝化。
由某些钝化剂(化学药品)所引起的金属钝化现象,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。
金属钝化后,其电极电势向正方向移动,使其失去了原有的特性,如钝化了的铁在铜盐中不能将铜置换出。
此外,用电化学方法也可使金属钝化,如将Fe置于H2SO4溶液中作为阳极,用外加电流使阳极极化,采用一定仪器使铁电位升高一定程度,Fe就钝化了。
由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化。
金属处于钝化状态能保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如电镀和化学电源等。
金属是如何钝化的呢?其钝化机理是怎样的?首先要清楚,钝化现象是金属相和溶液相所引起的,还是由界面现象所引起的。
有人曾研究过机械性刮磨对处在钝化状态的金属的影响。
实验表明,测量时不断刮磨金属表面,则金属的电势剧烈向负方向移动,也就是修整金属表面可引起处在钝态金属的活化。
即证明钝化现象是一种界面现象。
它是在一定条件下,金属与介质相互接触的界面上发生变化的。
电化学钝化是阳极极化时,金属的电位发生变化而在电极表面上形成金属氧化物或盐类。
这些物质紧密地覆盖在金属表面上成为钝化膜而导致金属钝化,化学钝化则是像浓HNO3等氧化剂直接对金属的作用而在表面形成氧化膜,或加入易钝化的金属如Cr、Ni等而引起的。
化学钝化时,加入的氧化剂浓度还不应小于某一临界值,不然不但不会导致钝态,反将引起金属更快的溶解。
金属的钝化有的金属(或合金)由于受某些氧化剂作用后其表面状况发生了改变,使金属(或合金)的化学活动性大大降低,耐腐蚀性大大增强,这种现象称为金属的钝化。
例如:Fe可与稀HNO3反应而溶解,但是,如果把Fe浸在密度大于1.25 g/cm3的浓HNO3中,铁却钝化而不溶。
Fe在浓HNO3中钝化后,不仅在稀HNO3中也不能再溶解,而且不能从铜盐(如CuSO4)溶液中置换出铜。
不仅铁,其它多种金属也可以发生钝化。
例如:Cr、Ni、Co、Mo、Al、Ta、Nb和W 等,其中最易钝化的金属是Cr、Mo、Al、Ni。
不仅硝酸,其它强氧化剂如浓H2SO4、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以使某些金属钝化,甚至空气中的氧气也能使有的金属(如Al、Cr等)钝化。
有许多因素能破坏钝化状态,或者阻止金属钝态生成。
将溶液加热或加入活性离子如Cl—、Br—、I—等和还原性气体如H2(特别在加热时)都能使钝态金属活化。
为什么金属会发生钝化现象?现在大多认为金属的钝化是由于金属跟介质作用而生成了一层极薄的肉眼看不见的保护膜的结果。
这层薄膜最经常的是金属的氧化物。
如铁与浓HNO3作用,铁表面被氧化成结构较复杂,组成为Fe8O11的氧化物。
这层氧化膜厚度是30×10-10~40×10-10m ,化学性质很不活泼,将Fe表面和介质完全隔绝,从而使铁处于钝态。
某些金属的钝化也可由阳极氧化来实现。
阳极氧化是将金属制件作阳极利用电解法使其表面上形成氧化物薄膜的过程。
像Al、Mg、Cu、钢等制件都可用此法钝化。
为了提高某些金属的抗蚀性能(有时同时增加美观),可采用化学方法或阳极氧化方法,使金属钝化。
金属的钝化在机械制造,仪器制造、武器、飞机及某些金属日常用品的制造中,以在某些金属制件表面生成防锈层或同时还有装饰性的覆盖层而广泛地被采用。
选自《中学生化学报》作者:阿元林、梁冬梅。