第二章水与废水监测(第七节)
- 格式:ppt
- 大小:7.07 MB
- 文档页数:148







环境监测重点第一章绪论第一节环境监测的目的和分类环境监测按监测目的的分类:1.监视性监测2.特定目的监测〔污染事故监测、仲裁监测、考核验证监测、咨询服务监测〕3.研究性监测第二节环境监测的特点和监测技术概述优先污染物:对众多有毒污染物进行分级排序,从中筛选出潜在危害性大、在环境中出现频率高的污染物作为监测和控制的对象。
经过优先选择的污染物称为环境优先污染物。
优先监测:对优先污染物进行的监测称为优先监测。
第三节环境标准环境标准是标准中的一类,目的是为了防止环境污染,维护生态平衡,保护人群健康,对环境保护工作中需要统一的各项技术标准和技术要求所作的规定。
中国环境标准体系分为:国家环境保护标准、地方环境保护标准和国家环境行业保护标准。
《污水综合排放标准》规定:第一类污染物,不分行业和污水排放方式,也不分受纳水体的功能类别,一般在车间或车间处理设备排放口采样。
第二类污染物,指长远影响小于第一类污染物的污染物质,在排放单位的排放口取样。
第二章水和废水监测第一节水体污染和监测一、水体和水体污染水体是地表水、地下水及其中包含的底质、水中生物等的总称。
水体污染一般分为化学型污染、物理型污染和生物型污染三种类型。
化学型污染系指随废水及其它废物排入水体的无机和有机污染物质造成的水体污染。
物理型污染系指排入水体的有色物质、悬浮物、放射性物质及高于常温的物质造成的污染。
生物型污染系指随生活污水、医院污水等排入水体的病原微生物造成的污染。
二、水污染监测的对象和目的水污染监测分为环境水体监测和水污染源监测。
监测目的:〔1〕对江、河、湖、库、渠、海水等地表水和地下水中的污染物质进行经常性的监测,以掌握水质现状及其变化趋势。
〔2〕对生产、生活等废水排放源排放的废水进行监视性监测,掌握废水排放量及其污染物浓度和排放总量,评价是否符合排放标准,为污染源管理提供依据。
〔3〕对水资源污染事故进行应急监测,为分析判断事故原因、危害及制定对策提供依据。



第二章水和废水的监测一、本章内容提要:主要介绍水和废水监测方面的基本概念和知识,介绍水质监测方案的内容和制订的基本要求,介绍代表性项目的测定原理和方法,介绍所涉及的重要的仪器分析方法原理。
要求同学们熟悉水体中的主要污染物质来源及其分布和迁移转化规律,掌握水体的布点和取样方法,掌握必测项目的分析理论。
通过实验达到对重点项目的实验操作水平。
二、教学目的与要求:1.了解我国水资源的状况、水体污染的概况,水质监测的对象及需要测定的项目;2.掌握地表水、地下水、污水监测方案的制订方法,掌握重点项目的具体测定操作。
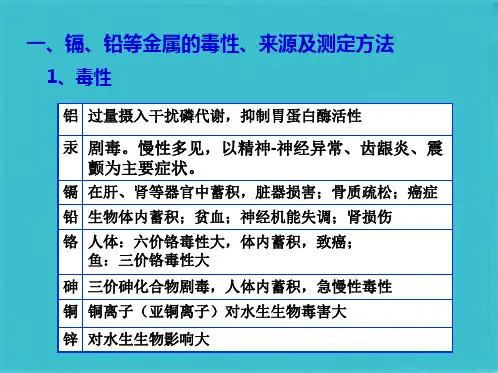
三、重点与难点:1.各种污水监测方案的制订方法,操作过程;2.掌握悬浮物、pH、电导率、酸碱度、硬度、Hg2+、Cd2+、Cr(Ⅵ)、Pb2+、As(Ⅲ)、CN-、F-、三氮(NH3-N、NO-2-N、NO3—N)及三氧(DO、BOD、COD)、挥发酚、硫化物的具体测定原理和方法、通过实验掌握实际的操作技能。
四、本章学时数 16五、教学内容:第一节水质污染与监测一、水资源及其水质污染水表现的对人类特别有用的属性就叫水资源。
水的用途:1.水是构成细胞的要素,没有水就不可能有生命;2.水是环境要素,正是水的循环使地球充满了勃勃生机;3.水是生产和生活必不可少的物质。
广义的水资源:地球上各种形态的水;估计在地球存在的总水量约为1.37×1018m3,其中淡水仅占2.7%,并且主要分布于地球的南、北两极和深层地下,可被人们直接利用的水不到淡水总量的1%。
狭义的水资源:可被人们直接利用的水;可利用水=动态水量+储存水量(地下水)在一个特定的地区,可利用水是非常有限的,多年取水量大于循环水量时,就产生水荒,给生产、生活带来危害。
人们在利用时必须要求水达到一定的质量标准。
水质就是指水和其中所含的杂质共同表现出来的综合特性。
描述水质量的参数就是水质指标,用水中杂质的种类和数量表示。
水是天然的溶剂,地质环境中不存在纯水。