物理化学经典习题电子教案
- 格式:docx
- 大小:28.99 KB
- 文档页数:16


《物理化学》电子教案上册第一章:引言1.1 课程介绍1.2 物理化学的基本概念1.3 物理化学的研究方法1.4 学习目标与要求第二章:气体2.1 气体的性质2.2 气体的压力与体积2.3 气体的温度与热量2.4 气体的化学反应第三章:溶液3.1 溶液的定义与组成3.2 溶液的浓度与稀释3.3 溶液的蒸馏与沸腾3.4 溶液的离子平衡第四章:固体4.1 固体的结构与性质4.2 固体的相变与相图4.3 固体的溶解与熔点4.4 固体的电导与磁性第五章:液体5.1 液体的性质与表面现象5.2 液体的蒸发与凝结5.3 液体的扩散与对流5.4 液体的相变与相图第六章:热力学第一定律6.1 能量守恒定律6.2 内能与热量6.3 功与热传递6.4 热力学第一定律的应用第七章:热力学第二定律7.1 熵与无序度7.2 可逆与不可逆过程7.3 热力学第二定律的表述7.4 热力学第二定律的应用第八章:化学平衡8.1 平衡常数与反应方向8.2 酸碱平衡与pH值8.3 沉淀平衡与溶解度积8.4 化学平衡的计算与应用第九章:动力学9.1 反应速率与速率常数9.2 零级、一级和二级反应9.3 反应机理与速率定律9.4 化学动力学的应用第十章:电化学10.1 电解质与离子传导10.2 电极与电极反应10.3 电池与电势10.4 电化学的应用重点和难点解析一、气体的化学反应补充和说明:气体之间的化学反应是物理化学中的重要内容,例如气体的合成、分解、置换等反应。
这些反应在工业生产、环境保护等领域具有重要的应用价值。
教案中应详细介绍气体化学反应的基本原理、反应类型及其应用实例,并通过实际案例分析,使学生能够深入理解和掌握这一部分内容。
二、溶液的离子平衡补充和说明:溶液中的离子平衡是物理化学中的关键概念,对于理解电解质溶液的性质和行为具有重要意义。
教案中应详细讲解离子平衡的基本原理、离子平衡常数的计算及其在实际应用中的作用,如酸碱平衡、溶解度积等。
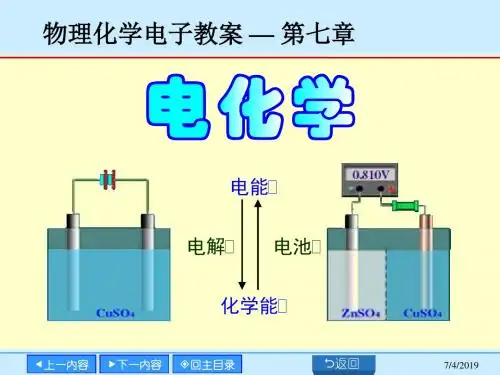


物理化学经典习题一、填空题1.硫酸与水可形成三种水合盐:H2SO4?H2O、H2SO4?2H2O 、H2SO4 ?4H2O。
常压下将一定量的H2SO4溶于水中,当达三相平衡时,能与冰、H2SO4水溶液平衡共存的硫酸水合盐的分子中含水分子的数目是。
2.Na+、H+的还原电极电势分别为–2.71V和–0.83V,但用Hg作阴极电解NaCl溶液时,阴极产物是Na–Hg 齐,而不是H2,这个现象的解释是。
3.在稀亚砷酸溶液中通入过量的硫化氢制备硫化砷溶液。
其胶团结构式为。
注明紧密层、扩散层、胶核、胶粒、胶团。
4.在两个具有0.001mAgNO3溶液的容器之间是一个AgCl多孔塞,在多孔塞两端放两个电极,接通直流电源后,溶液将向极方向流动。
5.反应A B (Ⅰ) ; A D (Ⅱ)。
已知反应(Ⅰ)的活化能大于反应(Ⅱ)的活化能,加入适当催化剂改变获得B和D的比例。
6.等温等压(298K及p?)条件下,某一化学反应在不做非体积功条件下进行,放热40.0kJ?mol-1,若该反应通过可逆电池来完成,吸热4.00 kJ?mol-1,则该化学反应的熵变为。
7.若稀溶液表面张力γ与溶质浓度c的关系为γ0–γ= A + B ln c(γ0为纯溶剂表面张力,A、B 为常数),则溶质在溶液表面的吸附量Γ与浓度c的关系为。
8.298.2K、101.325kPa下,反应H2(g)+ O2(g)═H2O(l)的(?rGm–?rFm)/J?mol-1为。
二、问答题1.为什么热和功的转化是不可逆的?2.在绝热钢筒中进行一化学反应:H2(g) + O2(g)═H2O(g),在反应自发进行。
问此变化中下述各量哪些为零,哪些大于零,哪些小于零?Q,W,?U,?H,?S和?F。
3.对单组分体系相变,将克拉贝龙方程演化为克-克方程的条件是什么?4.为什么有的化学反应速率具有负温度系数,即温度升高反应速率反而下降?5.为什么说,热化学实验数据是计算化学平衡常数的主要基础?三、计算题1.苯在正常沸点353K下的?vapHm? = 30.77 kJ?mol-1,今将353K及p?下的1molC6H6(l)向真空等温蒸发为同温同压下的苯蒸气(设为理想气体)。

《物理化学》电子教案上册第一章:引言1.1 课程介绍物理化学的定义和研究对象物理化学在科学和工程中的应用1.2 物理化学的发展简史物理化学的起源和发展过程重要的物理化学家和他们的贡献1.3 学习方法物理化学的学习要求和难点学习物理化学的方法和技巧第二章:物质的量及其计量2.1 物质的量的概念物质的量的定义和单位物质的量的性质和特点2.2 摩尔的概念摩尔的定义和符号摩尔质量的概念和计算方法2.3 物质的量的计算物质的量的基本计算公式物质的量的有关计算示例第三章:热力学第一定律3.1 热力学基本概念系统的定义和分类状态参量的概念和意义3.2 内能的概念和计算内能的定义和性质理想气体的内能计算公式3.3 热量和功的传递热量和功的定义和区别热量和功的传递方式及其计算第四章:热力学第二定律4.1 熵的概念熵的定义和性质熵增加的意义和实例4.2 热力学第二定律的表述克劳修斯表述和开尔文-普朗克表述熵增原理的应用和意义4.3 熵变和自由能的计算熵变的定义和计算公式自由能的定义和计算公式第五章:化学平衡5.1 平衡态的概念平衡态的定义和平衡态的特征平衡态的判断方法5.2 平衡常数的概念和计算平衡常数的定义和表示方法平衡常数的计算方法和应用5.3 化学平衡的移动勒夏特列原理的定义和内容化学平衡移动的实例和解释第六章:动力学基础6.1 反应速率的概念反应速率的定义和表示方法反应速率的影响因素6.2 反应速率定律零级、一级、二级反应速率定律的表达式反应速率定律的实验测定和应用6.3 化学动力学的计算反应速率常数的概念和计算方法反应速率与反应机理的关系第七章:电化学7.1 电化学基本概念电化学的定义和基本原理电解质和电极的定义及分类7.2 原电池和电解池原电池的构成和工作原理电解池的构成和工作原理7.3 电化学系列的计算电化学系列的概念和应用电极电势的计算和测定方法第八章:光学原理8.1 光的传播和折射光的传播方式和速度折射定律的表述和应用8.2 光的干涉和衍射干涉现象的产生和条件衍射现象的产生和条件8.3 光谱学的基本概念光谱的定义和分类光谱分析的方法和应用第九章:现代物理化学方法9.1 核磁共振(NMR)NMR的原理和应用NMR谱的解析和意义9.2 质谱法(MS)质谱法的原理和应用质谱图的解析和意义9.3 X射线衍射法X射线衍射法的原理和应用X射线晶体学的概念和基本原理第十章:物理化学实验10.1 实验基本操作实验安全常识和实验操作规范实验数据的记录和处理方法10.2 经典实验分析滴定法、比重法、熔点法等实验方法实验结果的分析和讨论实验报告的结构和内容要求重点解析1. 物质的量的概念及其性质和特点,摩尔的概念及其定义和符号,物质的量的计算方法和示例。


《物理化学》电子教案上册第一章:引言1.1 课程介绍1. 理解物理化学课程的重要性2. 了解课程的学习目标和内容1.2 物理化学的基本概念1. 物质的量与质量2. 状态与状态函数3. 热力学第一定律1.3 实验技能1. 掌握基本实验操作方法2. 熟悉实验仪器的使用和维护第二章:温度与热量2.1 温度的概念与计量1. 温度的定义与度量单位2. 温度计的使用与校准2.2 热量与热传递1. 热量的定义与计量单位2. 热传递的方式与速率2.3 热力学第二定律1. 熵的概念与计算2. 热力学第二定律的表述与意义第三章:压力与体积3.1 压力的概念与计量1. 压力的定义与度量单位2. 压强计的使用与校准3.2 体积的概念与测量1. 体积的定义与度量单位2. 量筒与容量瓶的使用与校准3.3 理想气体状态方程1. 理想气体状态方程的推导与理解2. 理想气体的状态变化计算第四章:物质的量与质量4.1 物质的量的概念与计量1. 物质的量的定义与度量单位2. 摩尔质量与摩尔数4.2 质量的概念与测量1. 质量的定义与度量单位2. 天平的使用与校准4.3 物质的量的计算1. 物质的量的计算公式与方法2. 物质的量的转换与计算实例第五章:实验方法与技术5.1 实验设计与方案制定1. 实验目标与步骤2. 实验材料的准备与选择5.2 实验操作与数据采集1. 实验操作方法与技巧2. 数据采集与记录1. 实验结果的整理与分析第六章:溶液的浓度与渗透压6.1 溶液的定义与组成1. 理解溶液的概念2. 熟悉溶剂和溶质的分类6.2 溶液的浓度表示方法1. 摩尔浓度2. 质量分数3. 体积分数6.3 渗透压与溶液的活度1. 渗透压的概念与计算2. 溶液的活度与活度系数第七章:化学平衡7.1 化学平衡的基本概念1. 平衡态的定义2. 平衡常数与平衡常数表达式7.2 酸碱平衡1. 酸碱理论基础2. 酸碱平衡的计算与调节7.3 氧化还原平衡1. 氧化还原反应的基本概念2. 标准电极电势与氧化还原平衡的计算第八章:动力学反应8.1 化学反应速率1. 反应速率的定义与表示方法2. 反应速率的影响因素8.2 化学反应机理1. 机理的定义与表示方法2. 速率方程与机理的关系8.3 反应动力学的应用1. 催化反应动力学2. 生物化学反应动力学第九章:相平衡与相图9.1 相与相变1. 相的概念与分类2. 相变的类型与特点9.2 相平衡条件与相平衡常数1. 相平衡的必要条件2. 相平衡常数的计算与表达9.3 典型体系的相图1. 水-冰相图2. 铁-碳相图第十章:实验数据分析与处理10.1 实验数据的误差分析1. 误差的概念与分类2. 误差的计算与减小方法10.2 实验数据的处理方法1. 平均值的计算与误差分析2. 数据的图表表示方法10.3 实验数据的回归分析1. 线性回归与曲线拟合2. 回归分析的应用与实践重点和难点解析重点一:第二章中的热量与热传递详细补充和说明:热量与热传递是物理化学中的重要概念。

《物理化学》电子教案上册一、教案概述本教案以《物理化学》为主题,分为上、下两册,本上册共十个章节。
本教案主要针对物理化学的基本概念、原理和实验进行讲解,内容涵盖广泛,包括原子结构、分子结构、热力学、动力学、电化学等方面。
本教案适用于大学物理化学课程的教学,也可供相关爱好者自学使用。
二、教学目标1. 了解物理化学的基本概念和原理;2. 掌握物理化学的基本实验方法和技能;3. 能够运用物理化学知识分析和解决实际问题。
三、教学内容1. 原子结构与元素周期律;2. 分子结构与化学键;3. 热力学基本概念与定律;4. 动力学基本概念与定律;5. 电化学基本概念与定律。
四、教学方法1. 讲授:通过PPT等电子教案,进行生动、直观的讲解,使学生掌握物理化学的基本概念和原理;2. 实验:安排相应的实验课程,让学生亲自操作,巩固理论知识,提高实验技能;3. 讨论:组织学生进行小组讨论,培养学生的思考能力和团队协作精神;4. 习题:布置课后习题,巩固所学知识,提高解决问题的能力。
五、教学评价1. 平时成绩:包括课堂表现、作业完成情况等,占总评的40%;3. 期末考试:包括选择题、填空题、计算题等,占总评的30%。
六、章节内容6. 溶液的性质与溶液理论7. 表面现象与界面化学8. 胶体与浊液9. 化学平衡与反应速率10. 化学动力学与反应机理七、教学目标1. 理解溶液的性质与溶液理论,掌握溶液的分类及特点;2. 了解表面现象与界面化学的基本概念,理解表面张力、吸附等现象;3. 掌握胶体与浊液的性质、分类及区别;4. 理解化学平衡的概念,掌握平衡常数的计算与应用;5. 掌握化学动力学的基本概念,了解反应速率与反应机理。
八、教学内容6. 溶液的性质与溶液理论:溶液的定义、溶液的类型及特点、溶液的浓度与稀释、溶液的沸点与凝固点下降等;7. 表面现象与界面化学:表面张力、吸附、润湿与不润湿、表面活性剂等;8. 胶体与浊液:胶体的定义、胶体的性质、胶体的分类、浊液的形成与稳定等;9. 化学平衡与反应速率:化学平衡的概念、平衡常数的计算、影响平衡的因素、化学反应速率的影响因素等;10. 化学动力学与反应机理:化学动力学的定义、反应速率与反应级数、反应机理的探究等。
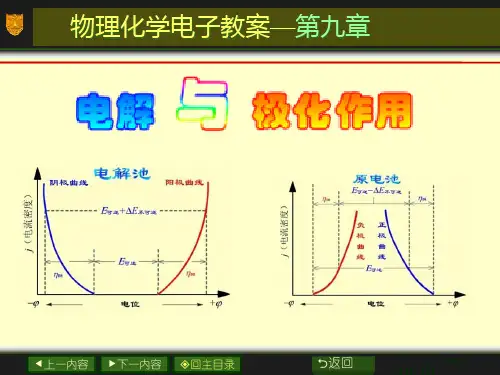
《物理化学》电子教案上册一、教案内容:1. 课程简介:介绍物理化学课程的基本概念、研究对象和主要内容。
2. 教学目标:明确本节课的学习目标,包括知识与技能、过程与方法、情感态度与价值观等方面。
3. 教学重点:指出本节课需要重点讲解的概念、理论和方法。
4. 教学难点:指出本节课学生可能难以理解的概念、理论和方法,并提出解决方案。
5. 教学方法:介绍本节课所采用的教学方法,如讲授、讨论、实验等。
6. 教学过程:详细描述本节课的教学步骤,包括导入、讲解、互动、总结等环节。
7. 教学评价:对本节课的教学效果进行评价,包括学生参与度、知识掌握程度等。
二、第一章:基本概念与定律1. 教学目标:使学生了解物理化学的基本概念,掌握经典力学、热学、电学等基本定律。
2. 教学内容:介绍物质、状态、能量、动量等基本概念,讲解牛顿运动定律、能量守恒定律、热力学第一定律、热力学第二定律、欧姆定律等。
3. 教学难点:热力学第二定律、熵增原理等概念的理解。
4. 教学方法:结合实例讲解基本概念和定律,引导学生进行思考和讨论。
5. 教学过程:(1)导入:通过生活中的实例引发学生对物理化学兴趣。
(2)讲解:详细讲解基本概念和定律,引导学生理解并掌握。
(3)互动:提问、回答、讨论,巩固所学知识。
(4)总结:对本章内容进行总结,强调重点和难点。
三、第二章:溶液与浓度1. 教学目标:使学生了解溶液的定义、分类及浓度表示方法,掌握溶液的配制和稀释规律。
2. 教学内容:介绍溶液的概念、溶液的分类、浓度表示方法(质量分数、摩尔浓度等),讲解溶液的配制和稀释规律。
3. 教学难点:溶液的配制和稀释规律的运用。
4. 教学方法:结合实际案例讲解溶液的概念和分类,引导学生掌握浓度表示方法,通过实验演示溶液的配制和稀释过程。
5. 教学过程:(1)导入:通过实例引入溶液的概念,引发学生兴趣。
(2)讲解:详细讲解溶液的定义、分类及浓度表示方法。
(3)实验:演示溶液的配制和稀释过程,让学生直观理解。
物理化学实验电子教案第一章:实验基本原理与安全1.1 实验基本原理1.1.1 介绍物理化学实验的基本原理,如热力学、动力学、电化学等。
1.1.2 解释实验原理在实际应用中的重要性。
1.2 实验安全1.2.1 强调实验安全的重要性,包括防火、防爆、防毒等。
1.2.2 介绍实验中可能存在的危险物质和危险操作,以及相应的预防措施。
第二章:实验器材与操作2.1 实验器材2.1.1 介绍实验中所需的器材,如烧杯、试管、移液器等。
2.1.2 说明器材的选择和使用方法。
2.2 实验操作2.2.1 讲解实验的基本操作,如称量、溶解、搅拌等。
2.2.2 演示实验操作的步骤和技巧。
第三章:实验数据处理与分析3.1 数据处理3.1.1 介绍实验数据的处理方法,如平均值、标准差等。
3.1.2 讲解数据的可靠性和有效性的评估方法。
3.2 数据分析3.2.1 解释实验数据与理论之间的关系。
3.2.2 分析实验结果,探讨可能的原因和影响因素。
4.1 实验报告结构4.1.1 介绍实验报告的基本结构,包括封面、摘要、引言等。
4.1.2 讲解实验报告的格式和规范。
4.2.2 分析优秀实验报告的特点和优点。
第五章:实验案例分析5.1 实验案例选择5.1.1 选择具有代表性的实验案例,如经典的物理化学实验。
5.1.2 介绍实验案例的背景和实验目的。
5.2 实验案例分析5.2.1 分析实验案例的实验原理和操作步骤。
5.2.2 讨论实验结果的意义和应用。
第六章:热力学实验6.1 实验目的与原理6.1.1 解释热力学实验的目的,如测定物质的比热容、反应热等。
6.1.2 介绍热力学实验的基本原理,如能量守恒、热力学第一定律等。
6.2 实验设备与操作6.2.1 介绍热力学实验所需的设备,如量热器、温度计等。
6.2.2 讲解实验设备的操作步骤和注意事项。
6.3 实验数据分析6.3.1 解释热力学实验数据的处理方法,如温度校正、热量计算等。
6.3.2 分析实验数据与热力学理论之间的关系。
物理化学》电子教案(上册)主讲教师:工作单位:化学学院《物理化学》电子教案(上册)学期教学内容目录学期教学内容目录I课程基本信息III绪论1第一章气体的PVT关系4§1-1 理想气体状态方程4§1-2 理想气体混合物5§1-3 气体的液化及临界参数6§1-4 真实气体状态方程7第二章热力学第一定律8§2-1 热力学基本概念8§2-2 热力学第一定律11§2-3 恒容及定恒压下的热焓13§2-4 热容恒容变温过程恒压变温过程14§2-5 理想气体的内能和焓热容162-6 理想气体的绝热过程方程式18§2-7化学反应的热效应20章末总结与习题22第三章热力学第二定律27§3-1 热力学第二定律27§3-2 卡诺循环和卡诺定理29§3-3 熵和熵判据31§3-4 熵变的计算及热力学第三定律33§3-5 亥姆霍兹函数与吉布斯函数35§3-6 ΔG的计算38§3-7 热力学基本方程及重要关系式39§3-8 克拉贝龙方程41章末总结与习题41第四章多组分系统热力学46§4-1 偏摩尔量47§4-2 化学势48§4-3 理想液态混合物50章末总结与习题53第五章化学平衡56§5-1 反应的等温方程56§5-2 平衡常数的表示方法59§5-3 各种因素对标准平衡常数的影响62章末总结与习题63第六章相平衡66§6-1 相律66§6-2 杠杆规则68§6-3 单组分体系的相图69§6-4 二组分理想液态混合物的气-液平衡相图72 §6-5 二组分真实液态混合物的气-液平衡相图73 章末总结与习题76课程基本信息绪论【教学重点】1. 介绍物理化学的定义、目的和内容2. 掌握物理化学的学习方法【教学难点】物理化学定义及内容的理解【引言】化学是研究物质性质与变化的科学。
物理化学实验电子教案第一章:实验基本原理与操作1.1 实验安全与防护介绍实验安全常识,如穿戴实验服、佩戴防护眼镜等。
讲解实验室中的危险品识别与处理方法。
1.2 实验数据处理与误差分析教授实验数据的采集、记录和处理方法。
介绍误差来源及减小误差的方法。
1.3 实验基本操作演示实验室常用的玻璃仪器的使用方法。
讲解实验中常用的测量和计算方法。
第二章:溶液的配制与浓度测定2.1 溶液的配制教授溶液配制的基本原则和方法。
演示如何准确称量和溶解固体物质。
2.2 浓度测定介绍常见的浓度测定方法,如滴定法、光谱法等。
演示浓度测定的实验操作和数据处理。
第三章:热力学实验3.1 热量的测定讲解热量测定原理,如热量守恒定律。
演示热量测定的实验操作和数据处理。
3.2 相图的绘制介绍相图的基本概念和绘制方法。
演示如何通过实验数据绘制相图。
第四章:动力学实验4.1 反应速率测定讲解反应速率的概念和测定方法。
演示反应速率测定的实验操作和数据处理。
4.2 活化能的测定介绍活化能的概念和测定方法。
演示活化能测定的实验操作和数据处理。
第五章:电化学实验5.1 电化学基本概念讲解电化学基本原理,如电极反应、电势等。
介绍电化学实验中常用的电化学电池和仪器。
5.2 电位测定与腐蚀防护演示电位测定实验操作和数据处理。
介绍腐蚀防护方法,如阴极保护、涂层等。
第六章:光学与光谱学实验6.1 光学基本原理介绍光学实验中涉及的基本原理,如光的传播、反射、折射等。
讲解光学仪器的基本构造和使用方法。
6.2 光谱学实验介绍光谱学的基本概念,如光谱、吸收光谱、发射光谱等。
演示光谱学实验的操作步骤和数据处理。
第七章:磁化学实验7.1 磁性材料的基本概念讲解磁性材料的基本性质,如磁性、磁化强度、磁化曲线等。
介绍磁化学实验中常用的仪器和设备。
7.2 磁化曲线与磁化率测定演示如何测定磁化曲线和磁化率。
讲解磁化曲线和磁化率在实际应用中的意义。
第八章:原子吸收与发射光谱实验8.1 原子吸收光谱原理介绍原子吸收光谱的基本原理和应用。
《物理化学》电子教案上册第一章:引言1.1 课程介绍了解物理化学的课程背景、意义和目的。
理解物理化学的基本概念和研究方法。
1.2 物理化学的发展历程回顾物理化学的发展历程,了解其重要里程碑和成就。
介绍著名物理化学家和他们对物理化学的贡献。
1.3 学习目标和要求明确学习目标,包括知识、技能和态度。
提出学习要求,包括课堂参与、作业和考核。
第二章:物质的量与状态2.1 物质的量引入物质的量的概念,解释摩尔和阿伏伽德罗常数。
学习物质的量的计算和转换,包括摩尔质量、物质的量浓度等。
2.2 状态介绍理想气体状态方程,理解压力、体积和温度之间的关系。
学习物质的相变,包括固态、液态和气态的性质和变化。
2.3 物质的量与状态的计算练习计算物质的量与状态之间的关系,包括理想气体状态方程的运用。
分析实际问题,应用物质的量与状态的计算方法。
第三章:热力学第一定律3.1 能量守恒定律复习能量守恒定律的基本原理,理解能量的转化和守恒。
学习能量的单位和国际制,了解能量的量纲和换算关系。
3.2 内能和热量引入内能的概念,理解内能的定义和计算方法。
学习热量的传递方式,包括传导、对流和辐射。
3.3 热力学第一定律阐述热力学第一定律的内容,理解能量守恒与热力学第一定律的关系。
应用热力学第一定律解决实际问题,进行能量的计算和分析。
第四章:热力学第二定律4.1 熵的概念引入熵的概念,解释熵的定义和物理意义。
学习熵的计算方法和熵变的表达式。
4.2 热力学第二定律的表述阐述热力学第二定律的不同表述,包括熵增原理和克劳修斯定律。
理解热力学第二定律的本质和意义。
4.3 热力学第二定律的应用学习热力学第二定律在实际问题中的应用,包括热机和制冷机的效率计算。
分析热力学第二定律对自然界和工程实践的影响。
第五章:溶液的性质5.1 溶液的定义和组成引入溶液的概念,理解溶液的组成和特点。
学习溶质和溶剂的分类及它们之间的相互作用。
5.2 溶液的浓度和渗透压介绍溶液的浓度表示方法,包括摩尔浓度和质量浓度。
物理化学经典习题一、填空题1.硫酸与水可形成三种水合盐:H2SO4?H2O、H2SO4?2H2O 、H2SO4 ?4H2O。
常压下将一定量的H2SO4溶于水中,当达三相平衡时,能与冰、H2SO4水溶液平衡共存的硫酸水合盐的分子中含水分子的数目是。
2.Na+、H+的还原电极电势分别为–2.71V和–0.83V,但用Hg作阴极电解NaCl溶液时,阴极产物是Na–Hg 齐,而不是H2,这个现象的解释是。
3.在稀亚砷酸溶液中通入过量的硫化氢制备硫化砷溶液。
其胶团结构式为。
注明紧密层、扩散层、胶核、胶粒、胶团。
4.在两个具有0.001mAgNO3溶液的容器之间是一个AgCl多孔塞,在多孔塞两端放两个电极,接通直流电源后,溶液将向极方向流动。
5.反应A B (Ⅰ) ; A D (Ⅱ)。
已知反应(Ⅰ)的活化能大于反应(Ⅱ)的活化能,加入适当催化剂改变获得B和D的比例。
6.等温等压(298K及p?)条件下,某一化学反应在不做非体积功条件下进行,放热40.0kJ?mol-1,若该反应通过可逆电池来完成,吸热4.00 kJ?mol-1,则该化学反应的熵变为。
7.若稀溶液表面张力γ与溶质浓度c的关系为γ0–γ= A + B ln c(γ0为纯溶剂表面张力,A、B 为常数),则溶质在溶液表面的吸附量Γ与浓度c的关系为。
8.298.2K、101.325kPa下,反应H2(g)+ O2(g)═H2O(l)的(?rGm–?rFm)/J?mol-1为。
二、问答题1.为什么热和功的转化是不可逆的?2.在绝热钢筒中进行一化学反应:H2(g) + O2(g)═H2O(g),在反应自发进行。
问此变化中下述各量哪些为零,哪些大于零,哪些小于零?Q,W,?U,?H,?S和?F。
3.对单组分体系相变,将克拉贝龙方程演化为克-克方程的条件是什么?4.为什么有的化学反应速率具有负温度系数,即温度升高反应速率反而下降?5.为什么说,热化学实验数据是计算化学平衡常数的主要基础?三、计算题1.苯在正常沸点353K下的?vapHm? = 30.77 kJ?mol-1,今将353K及p?下的1molC6H6(l)向真空等温蒸发为同温同压下的苯蒸气(设为理想气体)。
(1)求算在此过程中苯吸收的热量Q与所做的功W;(2)求苯的摩尔气化熵?vapSm?及摩尔气化自由能?vapGm?;(3)求环境的熵变?S环,并判断上述过程是否为不可逆过程。
2.把一定量的气体反应物A迅速引入一个温度800K的抽空容器内,待反应达到指定温度后计时(已有一部分A分解)。
已知反应的计量方程为2A(g)2B(g)+C(g),反应的半衰期与起始浓度无关;t=0时,p总=1.316×104Pa;t=10min 时,p总=1.432×104Pa;经很长时间后,p总=1.500×104Pa。
试求:(1)反应速率常数k和反应半衰期;(2)反应进行到1小时时,A物质的分压和总压各为多少?3.A和B能形成两种化合物A2B和AB2,A的熔点比B低,A2B的相合熔点介于A和B之间,AB2的不相合熔点介于A和A2B之间。
请画出该体系T ~ x 相图的示意图。
4.将正丁醇(Mr = 74)蒸气聚冷至273 K,发现其过饱和度(即p/ p°)约达到4方能自行凝结为液滴。
若在273K时,正丁醇的表面张力为0.0261N?m-1,密度为1000kg?m-3,试计算:(1)此过饱和度下开始凝结的液滴的半径;(2)每一液滴中所含正丁醇的分子数。
5.电池Pt∣H2(p?)∣HCl(0.1mol?kg-1∣AgCl(s)∣Ag 在298 K时的电池电动势为0.3524V,求0.1mol?kg-1HCl溶液中HCl的平均离子活度a±、平均活度系数γ±及溶液的pH值。
已知?(AgCl /Ag)=0.2223V。
计算中可做合理的近似处理,但必须说明。
一、填空题(每小题1分,共15分)1、理想气体等温可逆压缩W()0;Q()0;ΔU()0;ΔH()02、在273K及P?下,冰融化成水,以水和冰为系统W()0;Q()0;ΔU ()0;ΔH()0;ΔG()0。
3、一级反应以()对时间作图为一直线,速率常数是直线的()。
4、在密闭的容器中硝酸钾饱和溶液与水蒸汽呈平衡,并且存在着从溶液中析出细小硝酸钾晶体,该系统中K为(),Φ为(),f为()。
5、在稀的KI溶液中加入少量的硝酸银稀溶液,当KI过量时此时胶团的结构应表示为()。
二、单项选择(每小题2分,共10分)1、下列各量是化学势的是()。
A);B);C);D)。
2、在同一温度下,液体之中有半径为r的小气泡,其饱和蒸汽压为Pr,该平面液体的饱和蒸汽压为P则()。
A)Pr=P ;B)Pr>P;C)Pr<P;D)无法确定。
3、真实气体节流过程是()。
A)恒温过程;B)恒熵过程;C)恒焓过程;D)恒内能过程4、零级反应的起始反应物浓度越大,则半衰期()。
A)不变;B)越短;C)越长;D)无法确定。
5、在下列电解质溶液中,不能用外推法求得无限稀释摩尔电导率的是( )。
A) NaCl; B) HAC; C) NaOH; D) HCl;三、判断题(每小题2分,共20分)1、在标准压力和100℃,1mol水定温蒸发为蒸气。
假设蒸气为理想气体。
因为这一过程中系统的温度不变,所以⊿U=0。
( )2、熵增加的过程都是自发过程。
()3、不可逆过程一定是自发的,自发过程一定是不可逆的。
()4、某一化学反应的热效应⊿rHm被反应温度T除,即得此反应的⊿rSm 。
()5、有简单级数的反应是基元反应。
()6、电极电势更低的金属与被保护金属相连接,构成原电池的保护方法称为阳极保护法。
()7、根据热力学第一定律,因为能量不能无中生有,所以一个体系若要对外作功,必须从外界吸收热量。
()8、二元合金的步冷曲线上,转折点对应的温度即为该合金的最低共熔点。
()9、自然界存在温度降低,但熵值增加的过程。
()10、平衡常数改变,则平衡发生移动;平衡发生移动,则平衡常数改变。
()四、(共15分)2mol理想气体氦(CV,m=1.5R)在127℃时压力为5×105Pa,今在定温下外压恒定为1×106Pa进行压缩。
计算此过程的Q、W、ΔU、ΔH、ΔS、ΔA和ΔG。
五、(共10分)反应NH2COONH4(s)=2NH3(g)+CO2(g)在30℃时K?=6.55×10-4。
试求NH2COONH4的分解压。
六、(共20分)反应C2H4(g)+H2O(g)=C2H5OH(g)的Δr H?m为-4.602×104J?mol-1,ΔCp=0,ΔrG?m(298)=-8.196×103J?mol-11、导出此反应的ΔrG?m=f(T)及lnK?=f(T)关系式。
2、计算此反应在500K时的K?及ΔrG?m七、(共20分)HAc及C6H6的相图如下。
1、指出各区域所存在的相和自由度数;2、从图中可以看出最低共熔温度为-8℃,最低共熔混合物的质量分数为含C6H60.64,试问将含苯0.75和0.25的溶液各100g由20℃冷却时,首先析出的固体为何物,计算最多能析出固体的质量。
3、叙述将上述两溶液冷却到-10℃时,过程的相变化。
并画出其步冷曲线。
20A℃10 1 B0 2E 3-10 40 20 40 60 80 100HAc C6H6ω(C6H6)/%八、试将下列化学反应设计成电池(每小题5分,共10分)1、H++OH-→H2O(l)2、Ag++I-→AgI(s)九、(共15分)试设计一个电池,使其中进行下述反应:Fe2+(a1) + Ag+(a3) = Ag(s) + Fe3+(a2)设活度系数均为1,己知E?(Fe3+|Fe2+)=0.771V,E?(Ag|Ag+)=0.7991V1、写出电池表示式;2、计算25℃时,上述电池反应的K?;3、若将过量的银粉加到浓度为0.05mol kg-1的Fe(NO3)3溶液中,求反应达平衡后Ag+的浓度为多少?十、(共15分)某气相1—2级对峙反应:298K时,k+=0.20s-1,k-=5.0×10-9Pa-1?s-1,当温度升高到310K时,k+和k-均增大一倍。
试求算:1、该反应在298K时的K?;2、正、逆向反应的活化能;3、总反应的ΔrH?m一、填空题1.硫酸与水可形成三种水合盐:H2SO4?H2O、H2SO4?2H2O 、H2SO4 ?4H2O。
常压下将一定量的H2SO4溶于水中,当达三相平衡时,能与冰、H2SO4水溶液平衡共存的硫酸水合盐的分子中含水分子的数目是。
2.Na+、H+的还原电极电势分别为–2.71V和–0.83V,但用Hg作阴极电解NaCl溶液时,阴极产物是Na–Hg 齐,而不是H2,这个现象的解释是。
3.在稀亚砷酸溶液中通入过量的硫化氢制备硫化砷溶液。
其胶团结构式为。
注明紧密层、扩散层、胶核、胶粒、胶团。
4.在两个具有0.001mAgNO3溶液的容器之间是一个AgCl多孔塞,在多孔塞两端放两个电极,接通直流电源后,溶液将向极方向流动。
5.反应A B (Ⅰ) ; A D (Ⅱ)。
已知反应(Ⅰ)的活化能大于反应(Ⅱ)的活化能,加入适当催化剂改变获得B和D的比例。
6.等温等压(298K及p?)条件下,某一化学反应在不做非体积功条件下进行,放热40.0kJ?mol-1,若该反应通过可逆电池来完成,吸热4.00 kJ?mol-1,则该化学反应的熵变为。
7.若稀溶液表面张力γ与溶质浓度c的关系为γ0–γ= A + B ln c(γ0为纯溶剂表面张力,A、B 为常数),则溶质在溶液表面的吸附量Γ与浓度c的关系为。
8.298.2K、101.325kPa下,反应H2(g)+ O2(g)═H2O(l)的(?rGm–?rFm)/J?mol-1为。
二、问答题1.为什么热和功的转化是不可逆的?2.在绝热钢筒中进行一化学反应:H2(g) + O2(g)═H2O(g),在反应自发进行。
问此变化中下述各量哪些为零,哪些大于零,哪些小于零?Q,W,?U,?H,?S和?F。
3.对单组分体系相变,将克拉贝龙方程演化为克-克方程的条件是什么?4.为什么有的化学反应速率具有负温度系数,即温度升高反应速率反而下降?5.为什么说,热化学实验数据是计算化学平衡常数的主要基础?三、计算题1.苯在正常沸点353K下的?vapHm? = 30.77 kJ?mol-1,今将353K及p?下的1molC6H6(l)向真空等温蒸发为同温同压下的苯蒸气(设为理想气体)。
(1)求算在此过程中苯吸收的热量Q与所做的功W;(2)求苯的摩尔气化熵?vapSm?及摩尔气化自由能?vapGm?;(3)求环境的熵变?S环,并判断上述过程是否为不可逆过程。