物理化学电子教案--电化学1
- 格式:ppt
- 大小:1.42 MB
- 文档页数:55


《物理化学》教学大纲《物理化学》教学大纲开课单位:化学与生物工程学院化学教研室学分:3 总学时:48H(理论教学48学时)课程类别:必修考核方式:考试基本面向:生物工程专业一、本课程的性质、目的和任务物理化学是从物质的物理现象和化学现象的联系人手,来探求化学变化的基本规律的一门科学。
物理化学研究化学变化、相变化及其它有关的物理变化的基本原理,是材料学院和生物工程学院一门必修的基础课。
通过本课程的学习,学生应比较牢固地掌握物理化学基础知识和计算方法,同时还应得到一般科学方法的进一步训练,增长提出问题、分析问题和解决问题的能力。
科学方法的训练应贯彻在课程教学的整个过程中,特别是要通过热力学和动力学的学习,使学生能学会结合具体条件应用理论解决实际问题的一般科学方法。
二、本课程的基本要求1、启发学生对本课程的认识和学习热情,介绍本课程的主要内容和学习方法。
2、理解热力学状态函数的性质和应用,理解热力学三大定律的叙述及数学表达式。
3、理解溶液和相平衡原理及应用。
4、应用热力学定律,理解化学平衡的原理及应用。
5、理解电化学的基本原理及应用。
6、理解表面现象的性质及特点。
三、本课程与其它课程的关系本课程属理论课、基础课性质,它的目的是为后继课程打好基础,化工原理》、《现代分析检测技术》、《生物化学》、《生化工程》、《生化分离工程》等将应用本课程的基础理论及知识。
四、本课程的理论教学内容绪论介绍物理化学的研究对象及主要内容,研究方法。
结合实例说明物理化学理论学习的重要性,并激发学生学习物理化学的积极性。
第一章气体熟练掌握理想气体的状态方程,了解理想气体的微观模型。
掌握道尔顿分压定律和阿马格分体积定律条件及其应用。
了解真实气体pVT行为对理想气体行为的偏差。
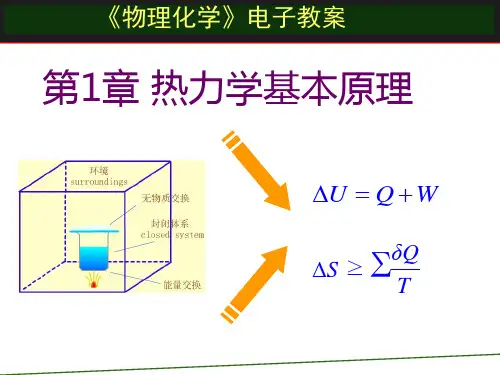
第二章热力学第一定律理解下列热力学基本概念:环境和系统,状态函数,途径和过程,热和功,平衡状态。
理解并掌握热力学第一的叙述及数学表达式。
明确热力学能、焓、标准生成焓、标准燃烧焓、标准反应焓、热容的定义并会应用。



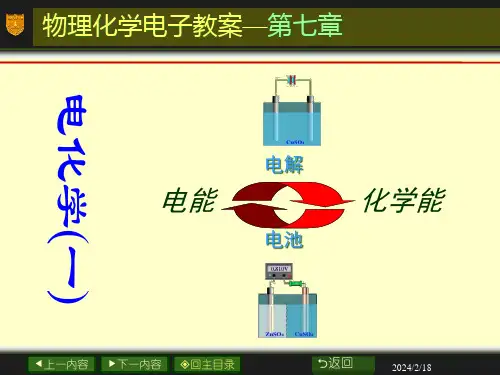
e 上一内容f 下一内容 回主目录2返回物理化学电子教案—第七章化学化工学院物化教研室电化学e 上一内容f 下一内容回主目录2返回电化学是研究电能与化学能相互转换规律的科学1.电解-把电能转换为化学能的过程2.原电池-把化学能转换为电能的过程*化学能是指恒温恒压下化学反应的Δr G m (在数值上等于W r ’)。
*只有自发化学反应(ΔG<0)才有可能构成原电池,产生电功。
*对非自发化学反应(ΔG>0),需加入电功W r ′进行电解,才能使反应进行。
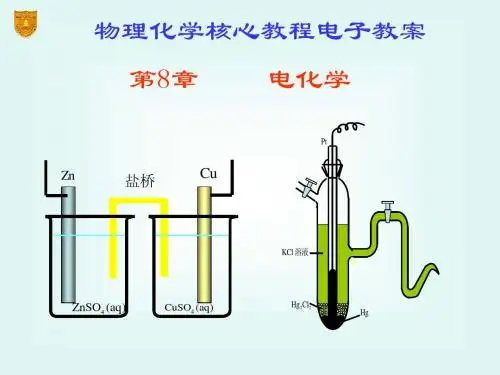
无论是电解池还是原电池,其工作介质都离不开电解质溶液,所以在讨论电解池和原电池之前,须先讨论电解质溶液。
第七章电化学能导电的物质称为导体,其可分为二类:(1)电子导体:依靠自由电子的运动而导电,导体本身不发生化学变化,温度升高,导电能力降低。
(2)离子导体:依靠离子定向运动而导电,须将电子导体作为电极,当电流通过溶液时,在电极与溶液的界面上发生化学变化,同时在溶液中正、负离子分别向两极移动,温度升高,导电能力增大。
电解质溶液的导电机理及法拉第定律法拉第定律是表示通过电极的电量与电极反应的物资的量之间的关系。
电极反应可表示为:氧化态+ Ze ─=还原态还原态=氧化态+ Ze─式中Z 为电极反应的电荷数(即转移电子数),取正值。
当电极反应的反应进度为ξ时:通过电极的元电荷的物质的量为Z ξ;通过的电荷数为L Z ξ(L 为阿伏加德罗常数)2、法拉第定律e 上一内容f 下一内容 回主目录2返回每个元电荷的电量为e ,故通过的电量为Q =e L Z ξ法拉第常数F=Le所以,法拉第定律:通过电极的电量正比于电极反应的反应进度与电极反应电荷数的乘积。
Q=ZF ξ其中:F=Le =96485.309 C ⋅mol -1≈96500 C ⋅mol -1此即为1 mol 电子所带的电量。
2、法拉第定律e 上一内容f 下一内容 回主目录2返回例1 Ag ++ e ─= AgZ=1, 当Q=96500C 时==1mol由,可得Δn(Ag)=ξ×ν(Ag)=1mol Δn(Ag +)=ξ×ν(Ag +)=-1mol即每有1mol Ag +被还原或1mol Ag 沉积下来,通过的电量一定为96500C 。

01绪论Chapter物理化学概述物理化学的定义01物理化学的研究范围02物理化学在化学科学中的地位03物理化学的研究对象与任务研究对象研究任务实验方法通过实验手段观测和记录物质的物理现象和化学变化,获取实验数据。
理论方法运用数学、物理学等理论工具对实验数据进行处理和分析,揭示物质的基本规律。
计算方法利用计算机模拟和计算等方法,对物质的性质、结构和变化规律进行预测和研究。
物理化学的研究方法030201物理化学的学习方法与要求学习方法学习要求02热力学基础Chapter热力学基本概念与术语热力学系统状态与状态函数过程与途径热力学平衡态热力学第一定律能量守恒定律能量不能创造也不能消灭,只能从一种形式转化为另一种形式。
热力学能系统内能的变化等于传入系统的热量与外界对系统做功之和。
焓定义为系统的热力学能与体积的乘积,用于描述等压过程中的能量变化。
热力学第二定律热力学第二定律表述热力学温标熵增原理热力学函数与基本方程热力学函数热力学基本方程麦克斯韦关系式热力学在化学中的应用化学反应的热效应化学平衡相平衡03化学动力学基础Chapter化学反应速率的概念与表示方法化学反应速率表示方法摩尔浓度变化率、质量浓度变化率、气体分压变化率等化学反应速率理论简介碰撞理论过渡态理论01020304浓度越高,反应速率越快。
反应物浓度温度越高,反应速率越快。
温度催化剂可以降低反应的活化能,从而加快反应速率。
催化剂对于有气体参与的反应,压力的变化会影响反应速率。
压力影响化学反应速率的因素复杂反应动力学简介平行反应竞争反应连续反应根据反应条件(如温度、压力、浓度等)预测反应的速率。
预测反应速率通过调整反应条件(如温度、压力、催化剂等)来优化反应速率和选择性。
优化反应条件通过分析反应速率与各种因素的关系,可以推断出反应的机理和过渡态的性质。
研究反应机理化学反应速率理论的应用04电化学基础Chapter电化学基本概念与术语电化学电极电解质电离电导率将化学能转变为电能的装置。


物理化学实验电子教案第一章:实验基本原理与安全1.1 实验基本原理1.1.1 介绍物理化学实验的基本原理,如热力学、动力学、电化学等。
1.1.2 解释实验原理在实际应用中的重要性。
1.2 实验安全1.2.1 强调实验安全的重要性,包括防火、防爆、防毒等。
1.2.2 介绍实验中可能存在的危险物质和危险操作,以及相应的预防措施。
第二章:实验器材与操作2.1 实验器材2.1.1 介绍实验中所需的器材,如烧杯、试管、移液器等。
2.1.2 说明器材的选择和使用方法。
2.2 实验操作2.2.1 讲解实验的基本操作,如称量、溶解、搅拌等。
2.2.2 演示实验操作的步骤和技巧。
第三章:实验数据处理与分析3.1 数据处理3.1.1 介绍实验数据的处理方法,如平均值、标准差等。
3.1.2 讲解数据的可靠性和有效性的评估方法。
3.2 数据分析3.2.1 解释实验数据与理论之间的关系。
3.2.2 分析实验结果,探讨可能的原因和影响因素。
4.1 实验报告结构4.1.1 介绍实验报告的基本结构,包括封面、摘要、引言等。
4.1.2 讲解实验报告的格式和规范。
4.2.2 分析优秀实验报告的特点和优点。
第五章:实验案例分析5.1 实验案例选择5.1.1 选择具有代表性的实验案例,如经典的物理化学实验。
5.1.2 介绍实验案例的背景和实验目的。
5.2 实验案例分析5.2.1 分析实验案例的实验原理和操作步骤。
5.2.2 讨论实验结果的意义和应用。
第六章:热力学实验6.1 实验目的与原理6.1.1 解释热力学实验的目的,如测定物质的比热容、反应热等。
6.1.2 介绍热力学实验的基本原理,如能量守恒、热力学第一定律等。
6.2 实验设备与操作6.2.1 介绍热力学实验所需的设备,如量热器、温度计等。
6.2.2 讲解实验设备的操作步骤和注意事项。
6.3 实验数据分析6.3.1 解释热力学实验数据的处理方法,如温度校正、热量计算等。
6.3.2 分析实验数据与热力学理论之间的关系。
《物理化学》电子教案上册第一章:引言1.1 课程介绍了解物理化学的课程背景、意义和目的。
理解物理化学的基本概念和研究方法。
1.2 物理化学的发展历程回顾物理化学的发展历程,了解其重要里程碑和成就。
介绍著名物理化学家和他们对物理化学的贡献。
1.3 学习目标和要求明确学习目标,包括知识、技能和态度。
提出学习要求,包括课堂参与、作业和考核。
第二章:物质的量与状态2.1 物质的量引入物质的量的概念,解释摩尔和阿伏伽德罗常数。
学习物质的量的计算和转换,包括摩尔质量、物质的量浓度等。
2.2 状态介绍理想气体状态方程,理解压力、体积和温度之间的关系。
学习物质的相变,包括固态、液态和气态的性质和变化。
2.3 物质的量与状态的计算练习计算物质的量与状态之间的关系,包括理想气体状态方程的运用。
分析实际问题,应用物质的量与状态的计算方法。
第三章:热力学第一定律3.1 能量守恒定律复习能量守恒定律的基本原理,理解能量的转化和守恒。
学习能量的单位和国际制,了解能量的量纲和换算关系。
3.2 内能和热量引入内能的概念,理解内能的定义和计算方法。
学习热量的传递方式,包括传导、对流和辐射。
3.3 热力学第一定律阐述热力学第一定律的内容,理解能量守恒与热力学第一定律的关系。
应用热力学第一定律解决实际问题,进行能量的计算和分析。
第四章:热力学第二定律4.1 熵的概念引入熵的概念,解释熵的定义和物理意义。
学习熵的计算方法和熵变的表达式。
4.2 热力学第二定律的表述阐述热力学第二定律的不同表述,包括熵增原理和克劳修斯定律。
理解热力学第二定律的本质和意义。
4.3 热力学第二定律的应用学习热力学第二定律在实际问题中的应用,包括热机和制冷机的效率计算。
分析热力学第二定律对自然界和工程实践的影响。
第五章:溶液的性质5.1 溶液的定义和组成引入溶液的概念,理解溶液的组成和特点。
学习溶质和溶剂的分类及它们之间的相互作用。
5.2 溶液的浓度和渗透压介绍溶液的浓度表示方法,包括摩尔浓度和质量浓度。