食品中钙的测定 编制说明
- 格式:doc
- 大小:39.00 KB
- 文档页数:3

食品安全国家标准食品中钙的测定1范围本标准规定了食品中钙含量测定的火焰原子吸收光谱法㊁滴定法㊁电感耦合等离子体发射光谱法和电感耦合等离子体质谱法㊂本标准适用于食品中钙含量的测定㊂第一法火焰原子吸收光谱法2原理试样经消解处理后,加入镧溶液作为释放剂,经原子吸收火焰原子化,在422.7n m处测定的吸光度值在一定浓度范围内与钙含量成正比,与标准系列比较定量㊂3试剂和材料除非另有规定,本方法所用试剂均为优级纯,水为G B/T6682规定的二级水㊂3.1试剂3.1.1硝酸(H N O3)㊂3.1.2高氯酸(H C l O4)㊂3.1.3盐酸(H C l)㊂3.1.4氧化镧(L a2O3)㊂3.2试剂配制3.2.1硝酸溶液(5+95):量取50m L硝酸,加入950m L水,混匀㊂3.2.2硝酸溶液(1+1):量取500m L硝酸,与500m L水混合均匀㊂3.2.3盐酸溶液(1+1):量取500m L盐酸,与500m L水混合均匀㊂3.2.4镧溶液(20g/L):称取23.45g氧化镧,先用少量水湿润后再加入75m L盐酸溶液(1+1)溶解,转入1000m L容量瓶中,加水定容至刻度,混匀㊂3.3标准品碳酸钙(C a C O3,C A S号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液㊂3.4标准溶液的配制3.4.1钙标准储备液(1000m g/L):准确称取2.4963g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)溶解,移入1000m L容量瓶中,加水定容至刻度,混匀㊂3.4.2钙标准中间液(100m g/L):准确吸取钙标准储备液(1000m g/L)10m L于100m L容量瓶中,加硝酸溶液(5+95)至刻度,混匀㊂3.4.3钙标准系列溶液:分别吸取钙标准中间液(100m g/L)0m L,0.500m L,1.00m L,2.00m L,4.00m L,6.00m L于100m L容量瓶中,另在各容量瓶中加入5m L镧溶液(20g/L),最后加硝酸溶液(5+95)定容至刻度,混匀㊂此钙标准系列溶液中钙的质量浓度分别为0m g/L㊁0.500m g/L㊁1.00m g/L㊁2.00m g/L㊁4.00m g/L和6.00m g/L㊂注:可根据仪器的灵敏度及样品中钙的实际含量确定标准溶液系列中元素的具体浓度㊂4仪器设备注:所有玻璃器皿及聚四氟乙烯消解内罐均需硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净㊂4.1原子吸收光谱仪:配火焰原子化器,钙空心阴极灯㊂4.2分析天平:感量为1m g和0.1m g㊂4.3微波消解系统:配聚四氟乙烯消解内罐㊂4.4可调式电热炉㊂4.5可调式电热板㊂4.6压力消解罐:配聚四氟乙烯消解内罐㊂4.7恒温干燥箱㊂4.8马弗炉㊂5分析步骤5.1试样制备注:在采样和试样制备过程中,应避免试样污染㊂5.1.1粮食㊁豆类样品样品去除杂物后,粉碎,储于塑料瓶中㊂5.1.2蔬菜㊁水果㊁鱼类㊁肉类等样品样品用水洗净,晾干,取可食部分,制成匀浆,储于塑料瓶中㊂5.1.3饮料㊁酒㊁醋㊁酱油㊁食用植物油㊁液态乳等液体样品将样品摇匀㊂5.2试样消解5.2.1湿法消解准确称取固体试样0.2g~3g(精确至0.001g)或准确移取液体试样0.500m L~5.00m L于带刻度消化管中,加入10m L硝酸㊁0.5m L高氯酸,在可调式电热炉上消解(参考条件:120ħ/0.5h~120ħ/1h㊁升至180ħ/2h~180ħ/4h㊁升至200ħ~220ħ)㊂若消化液呈棕褐色,再加硝酸,消解至冒白烟,消化液呈无色透明或略带黄色㊂取出消化管,冷却后用水定容至25m L,再根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂亦可采用锥形瓶,于可调式电热板上,按上述操作方法进行湿法消解㊂5.2.2微波消解准确称取固体试样0.2g~0.8g(精确至0.001g)或准确移取液体试样0.500m L~3.00m L于微波消解罐中,加入5m L硝酸,按照微波消解的操作步骤消解试样,消解条件参考附录A㊂冷却后取出消解罐,在电热板上于140ħ~160ħ赶酸至1m L左右㊂消解罐放冷后,将消化液转移至25m L容量瓶中,用少量水洗涤消解罐2次~3次,合并洗涤液于容量瓶中并用水定容至刻度㊂根据实际测定需要稀释,并在稀释液中加入一定体积镧溶液(20g/L)使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.2.3压力罐消解准确称取固体试样0.2g~1g(精确至0.001g)或准确移取液体试样0.500m L~5.00m L于消解内罐中,加入5m L硝酸㊂盖好内盖,旋紧不锈钢外套,放入恒温干燥箱,于140ħ~160ħ下保持4h~ 5h㊂冷却后缓慢旋松外罐,取出消解内罐,放在可调式电热板上于140ħ~160ħ赶酸至1m L左右㊂冷却后将消化液转移至25m L容量瓶中,用少量水洗涤内罐和内盖2次~3次,合并洗涤液于容量瓶中并用水定容至刻度,混匀备用㊂根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.2.4干法灰化准确称取固体试样0.5g~5g(精确至0.001g)或准确移取液体试样0.500m L~10.0m L于坩埚中,小火加热,炭化至无烟,转移至马弗炉中,于550ħ灰化3h~4h㊂冷却,取出㊂对于灰化不彻底的试样,加数滴硝酸,小火加热,小心蒸干,再转入550ħ马弗炉中,继续灰化1h~2h,至试样呈白灰状,冷却,取出,用适量硝酸溶液(1+1)溶解转移至刻度管中,用水定容至25m L㊂根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液,使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.3仪器参考条件参考条件见附录B㊂5.4标准曲线的制作将钙标准系列溶液按浓度由低到高的顺序分别导入火焰原子化器,测定吸光度值,以标准系列溶液中钙的质量浓度为横坐标,相应的吸光度值为纵坐标,制作标准曲线㊂5.5试样溶液的测定在与测定标准溶液相同的实验条件下,将空白溶液和试样待测液分别导入原子化器,测定相应的吸光度值,与标准系列比较定量㊂6分析结果的表述试样中钙的含量按式(1)计算:X=(ρ-ρ0)ˑfˑVm(1)式中:X 试样中钙的含量,单位为毫克每千克或毫克每升(m g/k g或m g/L);ρ 试样待测液中钙的质量浓度,单位为毫克每升(m g/L);ρ0 空白溶液中钙的质量浓度,单位为毫克每升(m g/L);f 试样消化液的稀释倍数;V 试样消化液的定容体积,单位为毫升(m L);m 试样质量或移取体积,单位为克或毫升(g或m L)㊂当钙含量ȡ10.0m g/k g或10.0m g/L时,计算结果保留三位有效数字,当钙含量<10.0m g/k g或10.0m g/L时,计算结果保留两位有效数字㊂7精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%㊂8其他以称样量0.5g(或0.5m L),定容至25m L计算,方法检出限为0.5m g/k g(或0.5m g/L),定量限为1.5m g/k g(或1.5m g/L)㊂第二法E D T A滴定法9原理在适当的p H范围内,钙与E D T A(乙二胺四乙酸二钠)形成金属络合物㊂以E D T A滴定,在达到当量点时,溶液呈现游离指示剂的颜色㊂根据E D T A用量,计算钙的含量㊂10试剂和材料除非另有规定,本方法所用试剂均为分析纯,水为G B/T6682规定的三级水㊂10.1试剂10.1.1氢氧化钾(K O H)㊂10.1.2硫化钠(N a2S)㊂10.1.3柠檬酸钠(N a3C6H5O7㊃2H2O)㊂10.1.4乙二胺四乙酸二钠(E D T A,C10H14N2O8N a2㊃2H2O)㊂10.1.5盐酸(H C l):优级纯㊂10.1.6钙红指示剂(C21O7N2S H14)㊂10.1.7硝酸(H N O3):优级纯㊂10.1.8高氯酸(H C l O4):优级纯㊂10.2试剂配制10.2.1氢氧化钾溶液(1.25m o l/L):称取70.13g氢氧化钾,用水稀释至1000m L,混匀㊂10.2.2硫化钠溶液(10g/L):称取1g硫化钠,用水稀释至100m L,混匀㊂10.2.3柠檬酸钠溶液(0.05m o l/L):称取14.7g柠檬酸钠,用水稀释至1000m L,混匀㊂10.2.4 E D T A溶液:称取4.5g E D T A,用水稀释至1000m L,混匀,贮存于聚乙烯瓶中,4ħ保存㊂使用时稀释10倍即可㊂10.2.5钙红指示剂:称取0.1g钙红指示剂,用水稀释至100m L,混匀㊂10.2.6盐酸溶液(1+1):量取500m L盐酸,与500m L水混合均匀㊂10.3标准品碳酸钙(C a C O3,C A S号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液㊂10.4标准溶液配制钙标准储备液(100.0m g/L):准确称取0.2496g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)溶解,移入1000m L容量瓶中,加水定容至刻度,混匀㊂11仪器设备注:所有玻璃器皿均需硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净㊂11.1分析天平:感量为1m g和0.1m g㊂11.2可调式电热炉㊂11.3可调式电热板㊂11.4马弗炉㊂12分析步骤12.1试样制备同5.1㊂12.2试样消解12.2.1湿法消解同5.2.1㊂12.2.2干法灰化同5.2.4㊂12.3滴定度(T)的测定吸取0.500m L钙标准储备液(100.0m g/L)于试管中,加1滴硫化钠溶液(10g/L)和0.1m L柠檬酸钠溶液(0.05m o l/L),加1.5m L氢氧化钾溶液(1.25m o l/L),加3滴钙红指示剂,立即以稀释10倍的E D T A溶液滴定,至指示剂由紫红色变蓝色为止,记录所消耗的稀释10倍的E D T A溶液的体积㊂根据滴定结果计算出每毫升稀释10倍的E D T A溶液相当于钙的毫克数,即滴定度(T)㊂12.4试样及空白滴定分别吸取0.100m L~1.00m L(根据钙的含量而定)试样消化液及空白液于试管中,加1滴硫化钠。

火焰原子吸收光谱法测定食物中钙的实验报告引言钙是人体非常重要的营养元素,具有多种功能,包括维持骨骼、牙齿的健康,参与血液凝固,神经传输和肌肉收缩等。
测定食物中钙的含量对于了解食物的营养价值具有重要意义。
本实验采用火焰原子吸收光谱法测定食物中钙含量。
火焰原子吸收光谱法是利用基态原子在电磁波作用下吸收特定频率的光线,进而形成高的激发态,再由于准直光束的束缚,导致一部分原子被提取,使得样品中原子数目减小,从而实现对元素的分析测量。
实验过程1. 实验仪器和试剂准备首先在实验室中检查所需要的仪器和试剂是否齐全。
本实验主要使用的仪器有原子吸收分光光度计和火焰炉;主要试剂有Ca(NO₃)₂、CH₃COOH、NaCl、C₂H₅OH等。
2. 样品的制备过程将不同食物中的钙含量进行测定,但是由于不同食物所混合的物质不同,所以在制备样品时,也需要区分操作。
以牛奶为例,将牛奶倒入锅中,煮沸至40ml。
然后加入10ml 1%的CH₃COOH,用干燥剂去除蒸发液中的水分,再用NaCl使液体浓缩。
最后用10ml C₂H₅OH稀释样品,得到待测样品。
3. 实际操作测量①测量初始火焰原子吸收光谱。
将真空透镜插入光路,按下电源开关预热5min,选择待测元素Ca的吸收谱线波长423nm,用无水醋酸和氧化钙溶液将样品调节至pH为8-9,以减小干扰。
进行碘灯检波,记录标准吸收度,即为初始火焰原子吸收光谱。
②制备标准曲线取不同浓度的钙标准品,准确称量,添加到标准烧杯中,加入相应的量的无水醋酸和氧化钙溶液将样品调节至pH为8-9,以减小干扰。
对于每个浓度的样品,依次进行样品的测量,得到吸光度值。
③样品的测定4. 数据处理用标准曲线计算样品中钙的浓度,然后将样品的钙含量进行统计和比较。
结果与分析实验结果表明,在本实验中,对于不同食物中的钙含量有所差异。
如牛奶中钙含量较高,约为2.2g/100g,而豆类和蔬菜中的钙含量则较低。
实验中所使用的火焰原子吸收光谱法是一种非常稳定和精确的测量方法,但也存在一些限制。
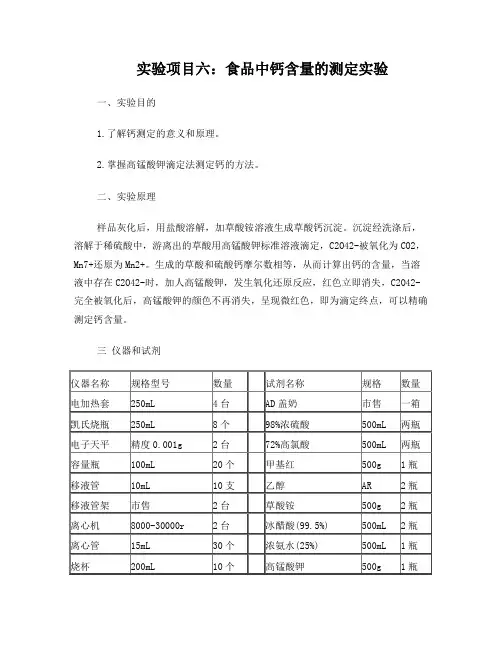
实验项目六:食品中钙含量的测定实验一、实验目的1.了解钙测定的意义和原理。
2.掌握高锰酸钾滴定法测定钙的方法。
二、实验原理样品灰化后,用盐酸溶解,加草酸铵溶液生成草酸钙沉淀。
沉淀经洗涤后,溶解于稀硫酸中,游离出的草酸用高锰酸钾标准溶液滴定,C2O42-被氧化为CO2,Mn7+还原为Mn2+。
生成的草酸和硫酸钙摩尔数相等,从而计算出钙的含量,当溶液中存在C2O42-时,加人高锰酸钾,发生氧化还原反应,红色立即消失,C2O42-完全被氧化后,高锰酸钾的颜色不再消失,呈现微红色,即为滴定终点,可以精确测定钙含量。
三仪器和试剂注:凯氏烧瓶型号需要与电加热套型号一致(比如,均为250mL)四试剂配制 (学生分四组,每组配制两份溶液)(1).0.2%甲基红指示剂 (2).4%(NH4)2C2O4溶液(3).2% NH4OH溶液 (4).2 mol/L H2SO4溶液(5).0.02 mol/L高锰酸钾标准溶液 (6).1:4醋酸溶液(7).1:4 NH4OH溶液 (8).1:4盐酸溶液(待需要时再配制)配制方法参考:(1) 0.2%甲基红指示剂的配制:取 0.2g甲基红指示剂粉末于烧杯中,滴加少量乙醇至完全溶解,移入100mL 容量瓶,再稀释至刻度。
(2) 4%草酸铵试液配制:取草酸铵4g于100mL容量瓶中,加水至刻度。
(3) 2%氨水配制:市售浓氨水为25%,取8克市售25%氨水稀释到100mL容量瓶中即可。
(4) 2 mol/L的硫酸配制:取市售98%浓硫酸20克(含H2SO4恰为0.2mol),稀释到100mL容量瓶中。
(5) 0.02 mol/L高锰酸钾配制:称0.316g高锰酸钾,稀释到100mL容量瓶中(6) 1:4醋酸配制:吸取20mL冰醋酸(市售冰醋酸含量为99.5%左右)至100mL容量瓶中,稀释至刻度。
(7) 1:4氢氧化铵配制:吸取20mL浓氨水(市售浓氨水含量为25%左右)至100mL容量瓶中,稀释至刻度。

食品中钙的测定国标
《食品中钙的测定》是2016年国家卫生和计划生育委员会,国家食品药品监督管理总局发布的标准,于2017年实施。
基本信息
标准名称:GB 5009.92-2016 食品安全国家标准食品中钙的测定标准类别:国家标准
发布日期:2016-12-23
标准状态:关于标准有效性标注的说明
实施日期:2017-06-23
颁发部门:国家卫生和计划生育委员会,国家食品药品监督管理总局废止日期:暂无
标准简介
GB5009.92-2016食品安全国家标准食品中钙的测定本标准于2017-6-23代替GB/T5009.92-2003食品中钙的测定、
GB5413.21-2010食品安全国家标准婴幼儿食品和乳品中钙、铁、锌、钠、钾、镁、铜和锰的测定中钙的测定方法、GB/T23375-2009蔬菜及其制品中铜、铁、锌、钙、镁、磷的测定中钙的测定方法、GB/T14609-2008粮油检验谷物及其制品中铜、铁、锰、锌、钙、镁的测定火焰原子吸收光谱法中钙的测定方法、GB/T14610-2008粮油检验谷物及谷物制品中钙的测定、GB/T9695.13-2009肉与肉制品钙含量测定和NY82.19-1988果汁测定方法钙和镁的中钙的测定方法。
本标准规定了食品中钙含量测定的火焰原子吸收光谱法、滴定
法、电感耦合等离子体发射光谱法和电感耦合等离子体质谱法。
本标准适用于食品中钙含量的测定。
相关公告:关于发布《食品安全国家标准鲜(冻)畜、禽产品》(GB2707-2016)等127项食品安全国家标准的公告(2016年第17号)。


实验九食品中钙含量的测定钙是人体内非常重要的元素之一,钙参与整个生长.发育过程并与各种有机物结合在一起,体内钙总重的99%存在于骨组织及牙齿内,婴儿,学龄前儿童、孕妇和哺育期母亲都需要足够的钙,因此,测定食品中的钙具有非常重要的营养学意义。
一、实验目的:掌握络合滴定法测钙含量的原理,熟练其操作过程。
二、实验原理:钙与氨羧络合剂能定量地形成金属络合物,其稳定性较钙与指示剂所形成的络合物为强。
在适当的pH值范围内,以氨羧络合剂EDTA滴定,在达到等当点时,EDTA 就自指示剂络合物中夺取钙离子,使溶液呈现游离指示剂的颜色(终点)。
根据EDTA络合剂用量可计算钙的含量。
三、仪器与试剂与材料:仪器:碱式滴定管25mL,10mL;万分之一天平;电炉;凯式烧瓶等试剂:1)三乙醇胺(75%)和水(1:1)2)2mol/L氢氧化钠:称取80g氢氧化钠用水溶于1000mL。
3)10%盐酸羟氨。
4)混合消化液:硝酸+高氯酸=(4+1)5)钙指示剂: 称取0.2g钙指示剂,20g氯化钠于研钵中,充分研细,混合均匀.6)镁溶液: 1gMgSO4.7H2O溶于200mL水中7)1%甲基红指示剂。
8)20%氢氧化钠溶液。
9)EDTA溶液:准确称取4.50gEDTA二钠盐用水稀释至1000mL,储存于聚乙烯瓶中4℃保存。
标定:准确称取0.2~0.25gCaCO3放入250mL烧杯中,用少量水润湿,盖上表面皿,从烧杯嘴处慢慢加入1:1HCl溶液5mL溶解冷却后,将溶液转入250mL容量瓶中,用水定容至刻度摇匀。
移取上述溶液25.00mL于250mL三角瓶中,加水25mL和2mL镁溶液,再加5mL20%NaOH,和20mg钙指示剂,摇匀后用0.01mol/LEDTA溶液滴定至溶液由红色变蓝色即为终点。
记录消耗的0.01mol/LEDTA溶液体积,同时做三份平行样。
计算:CEDTA (mol/L) =EDTACOCCaCOVMW⨯⨯25250100033a材料:奶粉等四、实验步骤:1)样品处理:含钙量较低的样品用灰化法为宜,含钙量较高的样品,用湿法消化为宜。

食品中钙的测定引言钙是人体所需的重要营养物质之一,它在维持骨骼健康、促进神经传导、肌肉收缩等方面发挥着重要作用。
因此,对于食品中钙的测定显得尤为重要。
本文将介绍几种常见的测定食品中钙含量的方法,并对其优缺点进行分析。
一、滴定法滴定法是一种常见且准确的测定食品中钙含量的方法。
其主要原理是通过与标准化的EDTA溶液进行化学反应来确定食品中钙的含量。
1.实验步骤:–准备样品:将食品样品磨碎,并称取适量样品。
–提取钙离子:用盐酸或硫酸将样品提取。
–酸化反应:加入稀盐酸或硫酸,使钙离子溶解。
–与指示剂反应:加入指示剂(如甲基橙)。
–滴定:滴加EDTA溶液,直至颜色转变。
–计算结果:根据滴定所使用的EDTA溶液的浓度,计算食品中钙的含量。
2.优缺点:–优点:滴定法准确度高,适用于各类食品样品的测定。
–缺点:操作过程相对繁琐,并且需要较长的实验时间。
二、原子吸收光谱法原子吸收光谱法是一种基于原子吸收特性来测定食品中钙含量的方法。
其原理是利用钙原子对特定波长的光进行吸收,通过测定光谱吸光度来计算钙的含量。
1.实验步骤:–样品处理:将食品样品进行消解,得到含钙的溶液。
–原子化:使用气体火焰或电热石墨炉等方法将溶液中的钙原子化。
–吸收测量:使用原子吸收光谱仪测量吸收光谱。
–计算结果:根据测得的吸光度和标准曲线,确定食品中钙的含量。
2.优缺点:–优点:原子吸收光谱法准确度高,对样品的要求相对较低。
–缺点:设备和试剂成本较高,需要专业的分析仪器。
三、化学分析法化学分析法是一种流行的测定食品中钙含量的方法。
其主要通过将样品中的钙与其他物质进行化学反应,通过反应后的产物来确定钙含量。
1.实验步骤:–样品处理:将食品样品进行消解,得到含钙的溶液。
–化学反应:加入特定试剂,与钙离子发生反应。
–沉淀分离:将生成的沉淀通过离心、过滤等方法分离出来。
–重量测定:测定分离后的沉淀质量。
–计算结果:根据反应的化学方程式和质量数据,计算钙的含量。

钙的测定实验报告钙的测定实验报告引言:钙是人体必需的重要元素之一,它在骨骼和牙齿的形成中起着关键作用。
因此,准确测定钙的含量对于评估人体健康状况和饮食摄入的钙量非常重要。
本实验旨在通过一种简单而有效的方法测定钙的含量。
实验材料和方法:材料:- 钙标准溶液- EDTA(乙二胺四乙酸)溶液- Eriochrome Black T(EBT)指示剂- NH4Cl和NH4OH缓冲溶液- 硫酸- 玻璃仪器:容量瓶、滴定管、量筒等方法:1. 准备样品:将待测样品溶解在适量的硫酸中,并用蒸馏水稀释至适当浓度。
2. 钙标准曲线:分别取一系列不同浓度的钙标准溶液,每个样品取10 mL,加入50 mL容量瓶中,并用蒸馏水稀释至刻度线。
3. 滴定:取10 mL标准或待测样品,加入50 mL容量瓶中,加入2-3滴EBT指示剂和10 mL NH4Cl和NH4OH缓冲溶液。
用EDTA溶液滴定至颜色由酒红色转变为蓝色的终点。
4. 记录滴定体积:记录滴定开始时和终点时的EDTA溶液体积,计算出钙的含量。
结果和讨论:在本次实验中,我们成功地测定了不同样品中钙的含量,并得到了如下结果。
样品A:含钙量为0.1 g/L样品B:含钙量为0.2 g/L样品C:含钙量为0.3 g/L通过钙标准曲线的测定,我们可以准确地计算出待测样品中钙的含量。
这个方法的优点是简单、快速,并且具有较高的准确性和重复性。
然而,需要注意的是,本实验使用的方法是比色法,它基于EDTA与钙离子之间的络合反应。
这种方法在理论上是可行的,但在实际应用中仍然存在一些限制。
例如,该方法对于含有其他金属离子干扰的样品可能会产生误差。
因此,在实际应用中,我们需要对样品进行预处理,以去除干扰物质。
此外,本实验仅测定了钙的总含量,没有区分可溶性钙和不可溶性钙。
在某些情况下,这可能会导致对钙的准确测定产生一定的偏差。
结论:通过本实验,我们成功地测定了不同样品中钙的含量,并得出了相应的结果。

edta食测定品中钙含量实验报告实验目的:本实验旨在通过edta滴定法测定食品中钙的含量,并了解各种反应条件对edta与钙离子络合的影响。
实验原理:edta滴定法是化学定量分析中一种重要的滴定方法,其原理是将过量的edta滴加到含有需要测定离子的溶液中,通过edta与目标离子形成稳定络合离子的反应达到滴定目的。
在本实验中,通过edta复合钙离子的反应,测定食品样品中钙含量。
edta的配位态数是6,能够与多种金属离子形成稳定的络合物,其中,edta和钙离子的络合反应是特别稳定的。
反应方程式如下:[Mg2+ + Ca2+] + 溶质化后的edta(aq) → [Mg-edta]2- + [Ca-edta]2-由上述反应式可知,edta与钙离子可以形成[Ca-edta]2-络合离子,在溶液中稳定存在。
因此,通过将edta溶液滴加到食品样品中,当样品中的钙离子与edta形成络合离子时,edta的消耗量可以用于计算样品中的钙含量。
实验步骤:1.准备食品样品:将食品样品研磨成粉末,并过筛筛去粗颗粒,取约0.2g的样品称入烧杯中,加入10ml去离子水;2.过筛滤液:将混合物在漏斗中过滤并接收过滤液,倒掉烧杯,漏斗加入10ml去离子水将漏斗内颗粒洗净;3.edta溶液调配:取50ml容量瓶,加入0.05mol/L的edta溶液20ml,加入NH4Cl-NH3H2O缓冲溶液(PH为10)9ml,加入几滴 EBT指示剂,在其中加入稀盐酸至颜色变了再加入少量,使得溶液变成淡粉色,并加入去离子水至刻度线;4.滴定:将待测液量取管装入量管并吸取edta溶液,初滴量为2-3滴,以后每次滴0.2mL左右,并剧烈振荡,直到液面变成淡红色,记录消耗的edta底数;5.结果计算:依照滴定公式,计算食品样品中钙的含量。
实验结果:通过实验得出,样品消耗了33.2ml的edta溶液,若以0.05mol/L的edta溶液计算,则样品中的钙含量可计算为:钙含量(mg/kg)=V1×C1×Ca/ m其中,V1为滴定样品消耗edta溶液的体积,单位为 mL;C1为edta溶液的浓度,单位为 mol/L;Ca为钙的摩尔质量,单位为 g/mol;m为样品的量,单位为 g。


实验五食品中钙的测定二、基本原理食物消化液或灰分中的钙与草酸作用,形成难溶性的草酸钙,在溶液中沉淀下来。
当在酸性条件下草酸钙与高锰酸钾作用,Mn7+被还原为Mn2+,而使溶液无色。
当高锰酸钾有微量过剩时,溶液中呈现Mn7+的微红色。
CaCl2+ (NH4)2C2O4→2NH4Cl +CaC2O4↓CaC2O4+ H2SO4→CaSO4+ H2C2O42KMnO4+ 5H2C2O4+3H2SO4→2MnSO4+ 10CO2+ 8H2O+ K2SO4三、实验器材1. 仪器:5mL微量滴定管;具塞量筒(25 mL);50 mL锥形瓶;小漏斗;5 mL刻度吸管;5 mL容量吸管;2. 试剂:(1)20%醋酸溶液;(2)20% NH4OH溶液;(3)2% NH4OH溶液;(4)4%草酸铵溶液;(5)2N H2SO4;(6)0.1%甲基红指示剂;(7)0.05N高锰酸钾溶液0.05N高锰酸钾溶液配法:溶解约1.6g KMnO4结晶于1L蒸馏水中,煮沸10分钟,冷却,放置过夜,以滤纸过滤即得。
滴定时稀释至0.01N,每次测定前必须标定,标定方法如下:取0.01N草酸钠溶液2 mL(精确称取NaC2O40.6701g,用少量水溶解,再加水稀释至1L),加入2 mL 2N H2SO4,于70-80℃水浴中滴定至刚出现红色为止。
根据NV=N1V1,即可计算KMnO4溶液的精确浓度。
四、操作步骤1. 精确吸收样品消化液或灰分稀释液5 mL(可视Ca含量而定),加甲基红指示剂1滴,4%草酸铵1 mL,20%醋酸0.5 mL,用20% NH4OH调节至微黄色,再以20%醋酸调节至微红色;2. 静置过夜,使该溶液沉淀完全析出;3. 洗涤沉淀,将沉淀离心15分钟,小心去除上清夜,用滤纸擦去管壁上的溶液,每管中加入少许2% NH4OH,用手指弹动离心管,使溶液松动,再加入约10 mL 2% NH4OH溶液,离心20分钟,用胶头吸管吸去上清液;4. 向沉淀中加入2 mL 2N H2SO4,连同离心管放入70-80℃水浴中加热,并用已标定好的0.01N KMnO4溶液滴定,溶液出现红色即为终点;5. 计算结果:1mL 1N KMnO4=20mg CaCa的含量(mg/100g)=式中:X ——滴定样品时所用去的KMnO4溶液量(mL);N ——KMnO4溶液的精确浓度;V1——样品最后稀释的体积(mL);V2——滴定时所用样液量(mL);W——样品重量(g)。
食品安全国家标准食品中钙的测定1范围本标准规定了食品中钙含量测定的火焰原子吸收光谱法㊁滴定法㊁电感耦合等离子体发射光谱法和电感耦合等离子体质谱法㊂本标准适用于食品中钙含量的测定㊂第一法火焰原子吸收光谱法2原理试样经消解处理后,加入镧溶液作为释放剂,经原子吸收火焰原子化,在422.7n m处测定的吸光度值在一定浓度范围内与钙含量成正比,与标准系列比较定量㊂3试剂和材料除非另有规定,本方法所用试剂均为优级纯,水为G B/T6682规定的二级水㊂3.1试剂3.1.1硝酸(H N O3)㊂3.1.2高氯酸(H C l O4)㊂3.1.3盐酸(H C l)㊂3.1.4氧化镧(L a2O3)㊂3.2试剂配制3.2.1硝酸溶液(5+95):量取50m L硝酸,加入950m L水,混匀㊂3.2.2硝酸溶液(1+1):量取500m L硝酸,与500m L水混合均匀㊂3.2.3盐酸溶液(1+1):量取500m L盐酸,与500m L水混合均匀㊂3.2.4镧溶液(20g/L):称取23.45g氧化镧,先用少量水湿润后再加入75m L盐酸溶液(1+1)溶解,转入1000m L容量瓶中,加水定容至刻度,混匀㊂3.3标准品碳酸钙(C a C O3,C A S号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液㊂3.4标准溶液的配制3.4.1钙标准储备液(1000m g/L):准确称取2.4963g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)溶解,移入1000m L容量瓶中,加水定容至刻度,混匀㊂3.4.2钙标准中间液(100m g/L):准确吸取钙标准储备液(1000m g/L)10m L于100m L容量瓶中,加硝酸溶液(5+95)至刻度,混匀㊂3.4.3钙标准系列溶液:分别吸取钙标准中间液(100m g/L)0m L,0.500m L,1.00m L,2.00m L,4.00m L,6.00m L于100m L容量瓶中,另在各容量瓶中加入5m L镧溶液(20g/L),最后加硝酸溶液(5+95)定容至刻度,混匀㊂此钙标准系列溶液中钙的质量浓度分别为0m g/L㊁0.500m g/L㊁1.00m g/L㊁2.00m g/L㊁4.00m g/L和6.00m g/L㊂注:可根据仪器的灵敏度及样品中钙的实际含量确定标准溶液系列中元素的具体浓度㊂4仪器设备注:所有玻璃器皿及聚四氟乙烯消解内罐均需硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净㊂4.1原子吸收光谱仪:配火焰原子化器,钙空心阴极灯㊂4.2分析天平:感量为1m g和0.1m g㊂4.3微波消解系统:配聚四氟乙烯消解内罐㊂4.4可调式电热炉㊂4.5可调式电热板㊂4.6压力消解罐:配聚四氟乙烯消解内罐㊂4.7恒温干燥箱㊂4.8马弗炉㊂5分析步骤5.1试样制备注:在采样和试样制备过程中,应避免试样污染㊂5.1.1粮食㊁豆类样品样品去除杂物后,粉碎,储于塑料瓶中㊂5.1.2蔬菜㊁水果㊁鱼类㊁肉类等样品样品用水洗净,晾干,取可食部分,制成匀浆,储于塑料瓶中㊂5.1.3饮料㊁酒㊁醋㊁酱油㊁食用植物油㊁液态乳等液体样品将样品摇匀㊂5.2试样消解5.2.1湿法消解准确称取固体试样0.2g~3g(精确至0.001g)或准确移取液体试样0.500m L~5.00m L于带刻度消化管中,加入10m L硝酸㊁0.5m L高氯酸,在可调式电热炉上消解(参考条件:120ħ/0.5h~120ħ/1h㊁升至180ħ/2h~180ħ/4h㊁升至200ħ~220ħ)㊂若消化液呈棕褐色,再加硝酸,消解至冒白烟,消化液呈无色透明或略带黄色㊂取出消化管,冷却后用水定容至25m L,再根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂亦可采用锥形瓶,于可调式电热板上,按上述操作方法进行湿法消解㊂5.2.2微波消解准确称取固体试样0.2g~0.8g(精确至0.001g)或准确移取液体试样0.500m L~3.00m L于微波消解罐中,加入5m L硝酸,按照微波消解的操作步骤消解试样,消解条件参考附录A㊂冷却后取出消解罐,在电热板上于140ħ~160ħ赶酸至1m L左右㊂消解罐放冷后,将消化液转移至25m L容量瓶中,用少量水洗涤消解罐2次~3次,合并洗涤液于容量瓶中并用水定容至刻度㊂根据实际测定需要稀释,并在稀释液中加入一定体积镧溶液(20g/L)使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.2.3压力罐消解准确称取固体试样0.2g~1g(精确至0.001g)或准确移取液体试样0.500m L~5.00m L于消解内罐中,加入5m L硝酸㊂盖好内盖,旋紧不锈钢外套,放入恒温干燥箱,于140ħ~160ħ下保持4h~ 5h㊂冷却后缓慢旋松外罐,取出消解内罐,放在可调式电热板上于140ħ~160ħ赶酸至1m L左右㊂冷却后将消化液转移至25m L容量瓶中,用少量水洗涤内罐和内盖2次~3次,合并洗涤液于容量瓶中并用水定容至刻度,混匀备用㊂根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.2.4干法灰化准确称取固体试样0.5g~5g(精确至0.001g)或准确移取液体试样0.500m L~10.0m L于坩埚中,小火加热,炭化至无烟,转移至马弗炉中,于550ħ灰化3h~4h㊂冷却,取出㊂对于灰化不彻底的试样,加数滴硝酸,小火加热,小心蒸干,再转入550ħ马弗炉中,继续灰化1h~2h,至试样呈白灰状,冷却,取出,用适量硝酸溶液(1+1)溶解转移至刻度管中,用水定容至25m L㊂根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液,使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样待测液㊂同时做试剂空白试验㊂5.3仪器参考条件参考条件见附录B㊂5.4标准曲线的制作将钙标准系列溶液按浓度由低到高的顺序分别导入火焰原子化器,测定吸光度值,以标准系列溶液中钙的质量浓度为横坐标,相应的吸光度值为纵坐标,制作标准曲线㊂5.5试样溶液的测定在与测定标准溶液相同的实验条件下,将空白溶液和试样待测液分别导入原子化器,测定相应的吸光度值,与标准系列比较定量㊂6分析结果的表述试样中钙的含量按式(1)计算:X=(ρ-ρ0)ˑfˑVm(1)式中:X 试样中钙的含量,单位为毫克每千克或毫克每升(m g/k g或m g/L);ρ 试样待测液中钙的质量浓度,单位为毫克每升(m g/L);ρ0 空白溶液中钙的质量浓度,单位为毫克每升(m g/L);f 试样消化液的稀释倍数;V 试样消化液的定容体积,单位为毫升(m L);m 试样质量或移取体积,单位为克或毫升(g或m L)㊂当钙含量ȡ10.0m g/k g或10.0m g/L时,计算结果保留三位有效数字,当钙含量<10.0m g/k g或10.0m g/L时,计算结果保留两位有效数字㊂7精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%㊂8其他以称样量0.5g(或0.5m L),定容至25m L计算,方法检出限为0.5m g/k g(或0.5m g/L),定量限为1.5m g/k g(或1.5m g/L)㊂第二法E D T A滴定法9原理在适当的p H范围内,钙与E D T A(乙二胺四乙酸二钠)形成金属络合物㊂以E D T A滴定,在达到当量点时,溶液呈现游离指示剂的颜色㊂根据E D T A用量,计算钙的含量㊂10试剂和材料除非另有规定,本方法所用试剂均为分析纯,水为G B/T6682规定的三级水㊂10.1试剂10.1.1氢氧化钾(K O H)㊂10.1.2硫化钠(N a2S)㊂10.1.3柠檬酸钠(N a3C6H5O7㊃2H2O)㊂10.1.4乙二胺四乙酸二钠(E D T A,C10H14N2O8N a2㊃2H2O)㊂10.1.5盐酸(H C l):优级纯㊂10.1.6钙红指示剂(C21O7N2S H14)㊂10.1.7硝酸(H N O3):优级纯㊂10.1.8高氯酸(H C l O4):优级纯㊂10.2试剂配制10.2.1氢氧化钾溶液(1.25m o l/L):称取70.13g氢氧化钾,用水稀释至1000m L,混匀㊂10.2.2硫化钠溶液(10g/L):称取1g硫化钠,用水稀释至100m L,混匀㊂10.2.3柠檬酸钠溶液(0.05m o l/L):称取14.7g柠檬酸钠,用水稀释至1000m L,混匀㊂10.2.4 E D T A溶液:称取4.5g E D T A,用水稀释至1000m L,混匀,贮存于聚乙烯瓶中,4ħ保存㊂使用时稀释10倍即可㊂10.2.5钙红指示剂:称取0.1g钙红指示剂,用水稀释至100m L,混匀㊂10.2.6盐酸溶液(1+1):量取500m L盐酸,与500m L水混合均匀㊂10.3标准品碳酸钙(C a C O3,C A S号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液㊂10.4标准溶液配制钙标准储备液(100.0m g/L):准确称取0.2496g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)溶解,移入1000m L容量瓶中,加水定容至刻度,混匀㊂11仪器设备注:所有玻璃器皿均需硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净㊂11.1分析天平:感量为1m g和0.1m g㊂11.2可调式电热炉㊂11.3可调式电热板㊂11.4马弗炉㊂12分析步骤12.1试样制备同5.1㊂12.2试样消解12.2.1湿法消解同5.2.1㊂12.2.2干法灰化同5.2.4㊂12.3滴定度(T)的测定吸取0.500m L钙标准储备液(100.0m g/L)于试管中,加1滴硫化钠溶液(10g/L)和0.1m L柠檬酸钠溶液(0.05m o l/L),加1.5m L氢氧化钾溶液(1.25m o l/L),加3滴钙红指示剂,立即以稀释10倍的E D T A溶液滴定,至指示剂由紫红色变蓝色为止,记录所消耗的稀释10倍的E D T A溶液的体积㊂根据滴定结果计算出每毫升稀释10倍的E D T A溶液相当于钙的毫克数,即滴定度(T)㊂12.4试样及空白滴定分别吸取0.100m L~1.00m L(根据钙的含量而定)试样消化液及空白液于试管中,加1滴硫化钠溶液(10g/L)和0.1m L柠檬酸钠溶液(0.05m o l/L),加1.5m L氢氧化钾溶液(1.25m o l/L),加3滴钙红指示剂,立即以稀释10倍的E D T A溶液滴定,至指示剂由紫红色变蓝色为止,记录所消耗的稀释10倍的E D T A溶液的体积㊂13分析结果的表述试样中钙的含量按式(2)计算:X=Tˑ(V1-V0)ˑV2ˑ1000mˑV3(2)式中:X 试样中钙的含量,单位为毫克每千克或毫克每升(m g/k g或m g/L);T E D T A滴定度,单位为毫克每毫升(m g/m L);V1 滴定试样溶液时所消耗的稀释10倍的E D T A溶液的体积,单位为毫升(m L);V0 滴定空白溶液时所消耗的稀释10倍的E D T A溶液的体积,单位为毫升(m L);V2 试样消化液的定容体积,单位为毫升(m L);1000 换算系数;m 试样质量或移取体积,单位为克或毫升(g或m L);V3 滴定用试样待测液的体积,单位为毫升(m L)㊂计算结果保留三位有效数字㊂14精密度在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%㊂15其他以称样量4g(或4m L),定容至25m L,吸取1.00m L试样消化液测定时,方法的定量限为100m g/k g(或100m g/L)㊂第三法电感耦合等离子体发射光谱法见G B5009.268㊂第四法电感耦合等离子体质谱法见G B5009.268㊂附录A微波消解升温程序参考条件微波消解升温程序参考条件见表A.1㊂表A.1微波消解升温程序参考条件步骤设定温度ħ升温时间m i n恒温时间m i n112055 2160510 3180510附录B火焰原子吸收光谱法参考条件火焰原子吸收光谱法参考条件见表B.1㊂表B.1火焰原子吸收光谱法参考条件元素波长n m狭缝n m灯电流m A燃烧头高度mm空气流量L/m i n乙炔流量L/m i n钙422.71.35~15392。
食品中钙的测定(火焰原子吸收法)(-)目的掌握用湿法消化技术制备食品中钙的分析试样及火焰原子吸收法测定食品中的钙含量.(二)原理样品经湿法消化后,导入原子吸收分光光度计中,经火焰原子化后,吸收422.7nm的共振线,其吸收量与含量成正比,可与标准系列比较定量.(三)仪器与试剂1. 原子吸收分光光度计2. 盐酸,硝酸,高氯酸.3. 混合酸消化液硝酸与高氯酸比为4:1.4.0.5mol/L硝酸溶液量取45ml硝酸,加去离子水稀释至1000ml.5.2%氧化镧溶液称取20g氧化镧(纯度大于99.99%),加75ml盐酸于1000ml容量瓶中,加去离子水稀释至刻度.6. 钙标准溶液精确称取1.2480g碳酸钙(纯度大于99.99%),加50ml去离子水,加盐酸溶解,移入1000ml 容量瓶中,加2%氧化镧稀释至刻度,贮存于聚乙烯瓶内4℃保存,此溶液每毫升相当于500ug钙.7. 钙标准使用液取钙标准液5ml于100ml容量瓶中,用2%氧化镧稀释至刻度,贮存于聚乙烯瓶中,4℃保存,此溶液每毫升相当于25ug钙.(四)操作步骤1. 样品制备湿样(如蔬菜,水果,鲜鱼,鲜肉等)用水清洗干净后,要用去离子水充分洗净.干粉类样品(如面粉,奶粉等)取样后立即装容器密封保存,防止空气中的灰尘和水分污染.2. 样品消化精确称取均匀样品干样0.5~1.5g(湿样2.0~4.0g,饮料等液体样品5.0~10.0g)于250ml高型烧杯内,加混合酸消化液20~30ml.上盖表皿.置于电热板或电沙浴上加热消化.如未消化好而酸液过少时,再补加几毫升混合酸消化液,继续加热消化,直至无色透明为止.加几毫升去离子水,加热以除去多余的硝酸.待烧杯中的液体接近2~3ml时,取下冷却.用去离子水洗并转移于10ml刻度试管中,加2%氧化镧溶液定容至刻度.取与消化样品相同量的混合酸消化液;按上述操作做试剂空白试验测定.3. 测定(1)标准曲线制备:分别取钙标准使用液1,2,3,4,6ml,用氧化镧定容至50ml,即相当于0.5,1,1.5,2,3ug/ml.(2)测定条件:仪器狭缝,空气及乙烯的流量,灯头高度,元素灯电流等均按使用的仪器说明调至最佳状态.(3)将消化好的样液,试剂空白液和钙的系列标准浓度液分别导人火焰进行测定.(五)结果计算以各浓度标准溶液与对应的吸光度绘制标准曲线,测定用样品液及试剂空白液由标准曲线查出浓度值(C 及C0),再按下式计算:(六)注意事项1. 所用玻璃仪器均以硫酸—重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷后用水反复冲洗,最后用去离子水冲洗晒干或烘干,方可使用.2. 干燥样品在加浓H2SO4消化前先加少量水湿润,防止浓H2SO4加入后立即炭化结块而延长消化时间.一,原子吸收分光光度法1,原理湿法消化后的样品测定液导入原子吸收分光光度计中,经火焰原子化后,吸收422.7nm的共振线,根据吸收量的大小与钙的含量成正比的关系,与标准系列比较定量分析.2,主要试剂(1)0.5mol/LHNO3溶液(2)高氯酸-硝酸消化液:1+4(3)25g/L氧化镧溶液(4)钙标准储备液:每毫升相当于500 μg钙.(5)钙标准使用液:每毫升含钙25 μg.3,主要仪器原子吸收分光光度计4,操作方法样品处理→系列标准溶液配制→ 仪器参考条件选择→ 标准曲线的绘制→样品测定仪器参考条件的选择:波长:422.7nm;光源:可见;火焰:空气-乙炔;其他如灯电流,狭缝,空气及乙炔流量,灯头高度均按仪器说明调至最佳状态.5,结果计算式中 X----样品中钙元素的含量,mg/100g;ρ-----测定用样品中钙元素的浓度,μg/mL;ρ0-----空白溶液中钙元素的浓度,μg;V-----样品消化液定容总体积,mL;f-----稀释倍数;m----样品质量,g.6,说明(1)所用玻璃仪器需用硫酸-重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷,而后用水反复冲洗,最后用去离子水冲洗,烘干.(2)样品制备时,湿样(如蔬菜,水果,鲜鱼,鲜肉等)用水冲洗干净后,要用去离子水充分洗净.干粉类样品(如面粉,奶粉等)取样后立即装容器密封保存,防止空气中的灰尘和水分污染.(3)本法最低检出限为0.1μg.二,滴定法(EDTA法)1,原理根据钙与氨羧络合剂能定量地形成金属络合物,该络合物的稳定性较钙与指示剂所形成的络合物强.在一定的pH范围内,以氨羧络合剂EDTA滴定,在达到化学计量点时,EDTA就从指示剂络合物中夺取钙离子,使溶液呈现游离指示剂的颜色.由络合剂消耗量计算出钙的含量.2,主要试剂(1)1.25mol/LKOH溶液(2)10g/L氰化钠溶液(3)0.05mol/LNa3C6H5O7(柠檬酸钠)溶液(4)高氯酸-硝酸消化液:1+4(体积比)(5)EDTA溶液(6)钙标准溶液:每毫升相当于100μg钙.(7)钙红指示液3,主要仪器滴定装置4,操作方法样品处理→标定EDTA浓度→样品测定其中样品处理与原子吸收分光光度法相同.5,结果计算式中 X----样品中钙元素的含量,mg/100g;T----EDTA的滴定度,mg/mL;V----滴定样品消化液时所用EDTA量,mL;V0----滴定空白消化溶液时所用EDTA量,mL;f----样品稀释倍数; m----样品质量,g.6,说明(1)所用玻璃仪器需用硫酸-重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷后用水反复冲洗,最后用去离子水冲洗,烘干.(2)钙标准溶液和EDTA溶液配制后应住址于聚乙烯瓶内,4℃保存.三,高锰酸钾滴定法1,原理样品经处理后,在酸性溶液(pH3.5~4.5)中,用草酸铵沉淀草酸钙,然后以稀硫酸溶解,用高锰酸钾标准溶液滴定草酸离子,间接地求出钙的含量.2,试剂1)草酸铵饱和溶液;2)盐酸溶液(1+1)3)盐酸溶液(1+3)4)氨水溶液(1+1)5)氨水溶液(1+50)6)5g/L甲基红指示剂7)硫酸;8)0.05mol/L高锰酸钾标准溶液:1.7g+1000mL水.标定:称取烘干的基准草酸钠0.1000g,溶于50mL水中,加入8mL硫酸,加热至80℃左右,不断搅拌,以用高锰酸钾标准溶液滴定至溶液呈淡粉红色,并在30s内不消失为终点.按下式计算高锰酸钾标准溶液浓度.3,操作步骤1)样品处理:2)测定:在保温条件下,以高锰酸钾标准溶液滴至出现微红色并保持15s不消失为止.式中 c----高锰酸钾标准溶液的物质的量浓度(mol/L);m----草酸钠的质量(g);V1----高锰酸钾标准溶液的用量(mL)V0----空白试液高锰酸钾标准溶液的用量(mL);0.06700----1/2草酸钠分子的摩尔质量(kg/mol).4,结果计算式中 wCa-----样品中钙的质量分数(%);c-----高锰酸钾标准溶液的物质的量浓度(mol/L);V1-----滴定样液所耗高锰酸钾标准溶液的体积(mL);V0-----滴定空白所耗高锰酸钾标准溶液的体积(mL); m-----样品的质量(g );20.04-----1/2钙原子的摩尔质量(g/mol).。
实验36 食品中钙、镁、铁含量的测定一、实验目的1.了解有关食品样品预处理方法。
2.掌握食品样品中钙、镁、铁的测定及样品中干扰的排除方法。
3.掌握分光光度计使用方法。
4.运用所学过的知识设计有关食品样品中钙、镁、铁综合测试方案,提高分析问题和解决问题的能力。
二、实验原理大豆等干样品经粉碎(蔬菜等湿样品需烘干)、灰化、灼烧、酸提取后,可采用配位滴定法,在碱性(pH =12)条件下,以钙指示剂指示终点,以EDTA为滴定剂,滴定至溶液由紫红色变蓝色,计算试样中钙含量。
另取一份试液,用氨-氯化铵缓冲溶液控制溶液pH =10,以铬黑T为指示剂,用EDTA滴定至溶液由紫红色变蓝色为终点,与钙含量差减得镁含量。
试样中铁等干扰可用适量的三乙醇胺掩蔽消除。
可用邻二氮菲分光光度法测定铁的含量。
三、主要仪器与试剂1.仪器分析天平,烘箱,蒸发皿,粉碎机,高温炉,瓷坩埚,容量瓶(250 mL),移液管,锥形瓶(250 mL),烧杯(250 mL和100 mL),滴定管,吸量管,比色管(50 mL),比色皿(1 cm),分光光度计。
2.试剂0.005 mol·L−1 EDTA溶液,20% NaOH,pH =10 氨性缓冲溶液,1﹕3三乙醇胺,1﹕1 HCl,钙指示剂(配成1﹕100氯化钠固体粉末),1 g·L-1铬黑T指示剂(称取0.1 g铬黑T溶于75 mL三乙醇胺和25 mL乙醇中),基准CaCO3,100 μg·mL-1铁标准溶液,0.15 %邻二氮菲,10%盐酸羟胺,1 mol·L-1 NaAc溶液。
四、实验步骤安全预防:盐酸、氢氧化钠具有腐蚀性,避免直接接触;乙醇易燃,避免明火;高温炉在使用中注意避免被灼伤。
1.试样制备将蔬菜、豆类、海产品、菌类等食品(任意选择一种试样)洗净、晾干。
适量称取可食用部分,放入烘箱于110 ℃温度下烘干后置于蒸发皿中(豆类用粉碎机粉碎后适量称取,其他干样品可直接称取),在电炉上灰化、炭化完全,置于高温炉中650 ℃灼烧2 h。
《食品安全国家标准食品中丙酸钠、丙酸钙的测定》编制说明一、标准起草的基本情况(包括简要的起草过程、主要起草单位、起草人等)标准负责起草单位:中国疾病预防控制中心营养与食品安全所;标准参加起草单位:中国疾病预防控制中心营养与食品安全所。
主要起草人:杨大进、蒋定国、鲁杰。
简要起草过程:编制组根据卫生部卫生标准专业委员会《2010年卫生标准制(修)订项目委托协议书》要求,依据GB/T1.1-2009《标准化工作导则第一部分:标准结构与编写规则》和GB/T20001.4-2001《标准编写与规则第四部分:化学分析方法》,参照GB/T5009.1《食品卫生检验方法理化部分总则》;认真贯彻落实《2010年食品安全国家标准清理工作方案》要求。
2010年12月底完成标准、文献资料收集整理工作,公开征求多方对标准修订的意见,将极谱法更换为分光光度法,等效或等同采用相关国内外标准。
开展方法重现性、灵敏度、检出限、分离度、准确度、线形关系等技术内容确定研究。
20Π年6月中旬完成标准方法草案,2011年8月底按照协议要求完成GB5009.120-××××《食品中丙酸钠、丙酸钙的测定》国家标准征求意见稿,按期提交送审稿。
二、标准的重要内容及主要修改情况1前处理条件的选择:①加入硅油的目的是消泡,如不起泡,可少加或不加。
蒸储时气泡多时,可多加几滴硅油。
②加入甲酸溶液是为了防止在分离柱中形成非挥发性盐类物质。
2仪器分析条件的选择:由于色谱系统对极性组分丙酸的吸附作用,当一更强的极性溶剂进入色谱后便使丙酸解吸,从而产生了所谓的鬼峰。
因此使丙酸呈非线性响应,致使不能准确定量。
虽然全玻璃色谱系统可减小对丙酸的吸附,但也不能消除鬼峰。
因此玻璃与非玻璃系统对丙酸的分析都存在“鬼峰”现象,不过后者更为严重。
有研究表明极性溶剂水、甲酸、乙酸均可不同程度地消除鬼峰,且4mo1∕1甲酸水溶液消除非玻璃色谱系统所产生的鬼峰效果最好。
实验九食品中钙含量的测定钙是人体内非常重要的元素之一,钙参与整个生长.发育过程并与各种有机物结合在一起,体内钙总重的99%存在于骨组织及牙齿内,婴儿,学龄前儿童、孕妇和哺育期母亲都需要足够的钙,因此,测定食品中的钙具有非常重要的营养学意义。
一、实验目的:掌握络合滴定法测钙含量的原理,熟练其操作过程。
二、实验原理:钙与氨羧络合剂能定量地形成金属络合物,其稳定性较钙与指示剂所形成的络合物为强。
在适当的pH值范围内,以氨羧络合剂EDTA滴定,在达到等当点时,EDTA 就自指示剂络合物中夺取钙离子,使溶液呈现游离指示剂的颜色(终点)。
根据EDTA络合剂用量可计算钙的含量。
三、仪器与试剂与材料:仪器:碱式滴定管25mL,10mL;万分之一天平;电炉;凯式烧瓶等试剂:1)三乙醇胺(75%)和水(1:1)2)2mol/L氢氧化钠:称取80g氢氧化钠用水溶于1000mL。
3)10%盐酸羟氨。
4)混合消化液:硝酸+高氯酸=(4+1)5)钙指示剂: 称取0.2g钙指示剂,20g氯化钠于研钵中,充分研细,混合均匀.6)镁溶液: 1gMgSO4.7H2O溶于200mL水中7)1%甲基红指示剂。
8)20%氢氧化钠溶液。
9)EDTA溶液:准确称取4.50gEDTA二钠盐用水稀释至1000mL,储存于聚乙烯瓶中4℃保存。
标定:准确称取0.2~0.25gCaCO3放入250mL烧杯中,用少量水润湿,盖上表面皿,从烧杯嘴处慢慢加入1:1HCl溶液5mL溶解冷却后,将溶液转入250mL容量瓶中,用水定容至刻度摇匀。
移取上述溶液25.00mL于250mL三角瓶中,加水25mL和2mL镁溶液,再加5mL20%NaOH,和20mg钙指示剂,摇匀后用0.01mol/LEDTA溶液滴定至溶液由红色变蓝色即为终点。
记录消耗的0.01mol/LEDTA溶液体积,同时做三份平行样。
计算:CEDTA (mol/L) =EDTACOCCaCOVMW⨯⨯25250100033a材料:奶粉等四、实验步骤:1)样品处理:含钙量较低的样品用灰化法为宜,含钙量较高的样品,用湿法消化为宜。
《食品安全国家标准食品中钙的测定》(征求意见稿)
编制说明
一、标准起草的基本情况
为贯彻落实《食品安全法》及其实施条例,依据国家卫生和计划生育委员会(原卫生部)办公厅和农业部办公厅《关于印发2010年食品安全国家标准清理整顿工作方案的通知》(卫办监督发[2010]106号)和《国家卫生计生委办公厅关于印发食品安全国家标准整合工作方案的通知》(国卫办食品函〔2014〕386号)要求,食品安全国家标准审评委员会秘书处委托由广东疾病预防控制中心负责开展《食品中钙的测定》检测方法整合修订工作,主要涉及GB 5413.21-2010、GB/T23375 -2009、GB/T14610-2008、GB/T5009.92-2003、GB/T 9695.13-2009、NY 82.19-1988等。
广东省疾病预防控制中心承担该项国标修改工作后,成立了由广东省疾病预防控制中心由李少霞、蔡文华、胡曙光、苏祖俭、梁旭霞、罗建波、梁春穗、黄伟雄、张学武、深圳市疾控中心刘桂华、林凯、姜杰、清远市疾控中心何健飞、中山出入境检验检疫局李蓉、叶少媚、李云松、李浩洋、广东仙乐制药有限公司黄舒丽、纪锐琳等组成的工作小组,于2014年下半年开展了实验室方法研究实验,并对我省主要食品中钙的本底值进行测定,工作小组研究讨论了相关实验结果和检测数据,对《GB 5009.90-2003 食品中钙的测定》等方法作了一定的补充修改,初步形成修订该国家标准的征求意见稿及编制说明。
供讨论。
二、标准的重要内容及主要修改情况
钙是生物必需的元素。
对人体而言,无论肌肉、神经、体液和骨骼中,都有用Ca2+结合的蛋白质。
钙是人类骨、齿的主要无机成分,也是神经传递、肌肉收缩、血液凝结、激素释放和乳汁分泌等所必需的元素。
钙约占人体质量的1.4%,参与新陈代谢,每天必须补充钙;人体中钙含量不足或过剩都会影响生长发育和健康。
钙在维持人体的正常生理机能、预防疾病方面具有非常重要的作用。
食品是人体补充营养元素的主要途径。
目前我国发布的食品中钙的检测方法为GB5009.92-2003、GB 5413.21-2010、GB/T23375 -2009等,主要为火焰原子吸收光谱法,电感耦合等离子体原子发射光谱法,滴定法。
本标准整合修订还参考了国内外相关法律、法规和标准,收集了国内外相关参考文献,通过综合分析比较,样品前处理方式保留干灰化法和湿消解法,增加高压密闭罐消解法和微波消解法,测定方法则保留了火焰原子吸收分光光度法、电感耦合等离子体原子发射光谱法和滴定法。
其中火焰原子吸收光谱法灵敏度高、抗干扰强、仪器国产化、测试成本低,为实际工作最常采用,本文对其进行了方法学参数确认,具体实验结果如下:
(1)不同酸浓度对火焰原子吸收测钙的吸光度是有一定的影响。
当样液中硝酸的体积浓度达到1%时,钙吸光度已出现较明显的降低;盐酸及高氯酸的体积浓度达到2%时,钙吸光度值也出现明显降低的现象;故在测定钙时,消化结束后赶酸应尽可能彻底,或在满足灵敏度要求的前提下加大稀释倍数,以达到降低酸对钙测定值的影响。
此外,硫酸加入容易导致钙以硫酸钙的形式形成沉淀而造成损失,因此,在样品处理的各个步骤都应避免采用硫酸。
(2)镧作释放剂可以消除磷酸、铝、硫酸盐、磷酸盐和硅酸盐等对测定钙的干扰。
不同镧溶液浓度对测定的影响不同,试验表明,当样液中镧的浓度在0.2-2.0g/L范围时,钙的测定值有最强吸收,故可根据实际需要在此范围选择合适的镧溶液浓度。
(3)线性范围和方法检出限:
经过多次实验(n>50)确定火焰原子吸收光谱测定钙的线性范围是:0~8.00 mg/L。
钙含量测定的线性方程:y= 0.04586x+0.00965,相关系数(r)为0.9999。
当称样量为0.5g,定容体积为10.0mL时,方法检出限(LOD)为0.16mg/kg,方法定量限(LOQ)为0.5 mg/kg。
(4)精密度和准确度:随机选择某大米和猪肉样品,分别平行制备7个,测定样品中钙的含量,计算相对标准偏差(RSD %)。
在这两种样品中分别加入高、中和低浓度的标准溶液,测定样品的加标回收率。
本方法测定食品中钙的平均回收率为86 %~112 %,精密度为0.2 %~1.0 %,采用四种消解方式,测定GBW10018 鸡肉和GBW10015 菠菜两种标准物质,结果表明,四种样品前处理方式对测定食品中钙无显著性差异。
方法学试验各项测定参数均符合《GB/T 27404-2008实验室质量控制规范食品理化检测》的技术要求。
(5)干法灰化温度的影响比较了干灰化温度为550度和850度时的消化效果,当干灰化温度提高到850度时,大多数样品均能一次性消化完全,可避免反复加酸溶解及回炉,回收率普遍理想。
故在本次国标修订工作时,增加850度干灰温度的选择条件。
钙的滴定法有络合滴定法和氧化还原法。
氧化还原法是间接滴定钙,沉淀分离步骤容易造成损失,且能与草酸根离子生成沉淀的离子容易干扰实验结果,方法准确性受影响。
络合滴定法测定常量或高含量食品中的钙比较简便和实用,准确度较高,故本标准整合过程中保留GB5009.92-2003EDTA络合滴定法而不考虑采纳GB/T14610-2008、GB/T 9695.13-2009氧化还原滴定法。
钙测定的电感耦合等离子体光谱法和电感耦合等离子体质谱法由深圳市疾控中心在《食品中多元素的测定》标准方法中整合。
采用微波消解-火焰原子吸收光谱标准曲线法测定广东各地区各类食品中钙含量,钙含量范围在2.5mg/kg~5000 mg/kg之间,本标准方法能够满足常见食品中钙的测定要求。
三、国际国内标准情况
我国涉及食品中钙检测方法的国家、行业标准见如下有:GB 5413.21-2010《食品安全国家标准婴幼儿食品和乳品中钙、铁、锌、钠、钾、镁、铜和锰的测定》、GB/T23375 -2009 《蔬菜及其制品中铜、铁、锌、钙、镁、磷的测定》、GB/T14610-2008《粮油检验谷物及制品中钙的测定》、GB/T5009.92-2003《食品中钙的测定》、GB/T 9695.13-2009《肉与肉制品钙含量测定》、NY 82.19-1988《果汁测定方法钙和镁的测定》。
国外发布的食品中钙的检测方法主要为:火焰原子吸收分光光度法和电感耦合等离子体原子发射光谱法,滴定法。
前处理方式有湿法消解和干灰化法。
包括:
美国食品药品监督管理局(USFDA)发布的《AOAC 967.30 Calcium and Magnesium in Drugs Titrimetric Method》、《AOAC 976.09 Calcium in Beer Titrimetric Method I》、《AOAC 976.10 Calcium in Beer Titrimetric Method II》、《AOAC 977.29 Calcium, Potassium, and Sodium in Electrolyte Replenishers Atomic Absorption Spectrophotometric– Flame Photometric Method》、《AOAC 983.19 Calcium in Mechanically Separated Poultry and Beef Titrimetric Method》、《AOAC 984.27 Calcium, Copper, Iron, Magnesium, Manganese, Phosphorus, Potassium, Sodium, and Zinc in Infant Formula Inductively Coupled Plasma Emission Spectroscopic Method》、《AOAC 991.25 Calcium, Magnesium, and Phosphorus in Cheese Atomic Absorption Spectrophotometric and Colorimetric Methods》等。
本方法与国标方法和国际标准类同,适用于各种食品中钙的测定。
四、其他需要在网上公开说明的事项
无。