纳米金尺寸对应紫外峰
- 格式:pdf
- 大小:46.78 KB
- 文档页数:7

金纳米颗粒的尺寸与紫外吸收峰的关系金纳米颗粒是近年来在纳米材料领域备受关注的一种材料,其具有独特的物理、化学性质和广泛的应用前景。
其中,金纳米颗粒的尺寸对其紫外吸收峰的位置和强度有着重要影响。
本文将就金纳米颗粒的尺寸与紫外吸收峰的关系展开讨论。
一、金纳米颗粒的尺寸对其紫外吸收峰的位置的影响金纳米颗粒的尺寸对其表面等离子体共振吸收的波长有显著影响。
当金纳米颗粒的尺寸较小,处于纳米尺度时,其表面等离子体共振吸收峰位于紫外光区域。
随着金纳米颗粒尺寸的增大,表面等离子体共振吸收峰逐渐向可见光区域移动。
因此,金纳米颗粒的尺寸越大,其紫外吸收峰的位置就越靠近可见光区域。
二、金纳米颗粒的尺寸对其紫外吸收峰的强度的影响金纳米颗粒的尺寸对其表面等离子体共振吸收峰的强度也有重要影响。
当金纳米颗粒的尺寸较小时,其表面积相对较大,使得表面等离子体共振吸收峰的强度较强。
随着金纳米颗粒尺寸的增大,其表面积相对减小,从而使表面等离子体共振吸收峰的强度逐渐减弱。
因此,金纳米颗粒的尺寸越小,其紫外吸收峰的强度就越强。
三、金纳米颗粒尺寸与紫外吸收峰的关系的应用基于金纳米颗粒尺寸与紫外吸收峰的关系,人们可以通过调控金纳米颗粒的尺寸来实现对其紫外吸收峰的调节。
这一特性使得金纳米颗粒在生物医学、光电子学、催化剂等领域具有广泛的应用。
例如,在生物医学领域,通过调节金纳米颗粒的尺寸,可以实现对其在纳米材料与生物分子相互作用过程中的光学性质的调控,从而用于生物成像、光热治疗等方面。
此外,在光电子学领域,金纳米颗粒也可以作为表面等离子体共振传感器的基础材料,通过调控其尺寸实现对传感器的灵敏度和选择性的调节。
金纳米颗粒的尺寸与紫外吸收峰的关系是一个重要的研究课题,其尺寸对其紫外吸收峰的位置和强度有着显著影响。
人们通过调节金纳米颗粒的尺寸,可以实现对其紫外吸收峰的调节,从而在生物医学、光电子学、催化剂等领域实现广泛的应用。
金纳米颗粒的尺寸与紫外吸收峰的关系的研究将为纳米材料的合成与应用提供重要的理论指导和实验依据。

CTAB包被的不同形态纳米金的制备及其抗菌性能研究马亚云;刘梅;李娇;李宣仪;杨宗琪【摘要】本文以CTAB为包被试剂合成了球形、棒状和三角形三种不同形态的纳米金颗粒,研究了它们对金黄色葡萄球菌(Staphylococcus aureus,S.aureus)和大肠杆菌(Escherichia coli,E.coli)杀菌性能的差异.通过平板计数法和浊度法;确定了它们对两种菌的最小杀菌浓度(minimum bactericidal concentrations,MBC)和最小抑菌浓度(minimum inhibitory concentrations,MIC).棒状纳米金、三角形纳米金、球形纳米金对大肠杆菌的MIC分别为0.65 μg/mL、3.71 μg/mL、21.21μg/mL,MBC分别为1.30 μg/mL、11.09 μg/mL、21.21 μg/mL;对金黄色葡萄球菌的MIC分别为0.26μg/mL、0.56 μg/mL、2.65 μg/mL,MBC分别为0.52 μg/mL、1.11 μg/mL、2.65 μg/mL.结果表明无论是对大肠杆菌还是金黄色葡萄球菌,棒状纳米金的杀菌效果均高于其它两种形态,并且三种不同形态的纳米金对金黄色葡萄球菌的杀菌效果均优于大肠杆菌.【期刊名称】《聊城大学学报(自然科学版)》【年(卷),期】2019(032)005【总页数】7页(P64-70)【关键词】纳米金;不同形态;金黄色葡萄球菌;大肠杆菌;抗菌性能【作者】马亚云;刘梅;李娇;李宣仪;杨宗琪【作者单位】陕西师范大学食品工程与营养科学学院,陕西西安710119;陕西师范大学食品工程与营养科学学院,陕西西安710119;陕西师范大学食品工程与营养科学学院,陕西西安710119;陕西师范大学食品工程与营养科学学院,陕西西安710119;陕西师范大学食品工程与营养科学学院,陕西西安710119【正文语种】中文【中图分类】TS207.30 引言食品安全问题已成为当今世界极为关注的公共卫生热点问题,而食源性致病菌是引起食源性疾病的主要原因之一,抗生素的出现在控制这类疾病上发挥了很大作用.然而抗生素的滥用,使得细菌逐渐对传统抗生素产生了耐药性,抗生素耐药性病原体的出现严重危及了人类健康.因此,研究新型、安全、高效的抗菌材料迫在眉睫[1].近年来随着纳米技术的发展,纳米材料的抗菌性研究成为当前研究的一大热点.已报道过的抗菌纳米材料[2]包括纳米化的传统抗菌材料(如纳米化抗生素、纳米化抗菌肽等)、无机金属和金属氧化物纳米颗粒(如金、银、铜、氧化锌等)以及新型表面改性的纳米颗粒.纳米颗粒作为一种新型抗菌药物,被认为具有不同于常规药物的作用机理,与传统抗生素相比,很难诱导细菌产生耐药性,因此成为新型药物研发方向之一,引起了研究人员极大的兴趣[3,4].作为纳米颗粒中极具代表性的金纳米粒子(gold nanoparticles,AuNPs)其应用极其广泛.纳米金以其良好的稳定性、尺寸效应、表面效应、光学效应以及独特的生物亲和性,在催化[5]、生物医学[6]等领域具有广泛的应用.在生物医学领域,“AuNPs”已经成为了一种备受青睐的纳米材料,例如将其广泛应用于生物传感方向[7-9],药物输送载体[10,11],不同抗菌药物对纳米金表面进行修饰还可以将其作为一种新型的抗菌药物[3].但是,与得到广泛关注的银纳米粒子的抗菌性能研究相比,对纳米金自身抗菌性能的研究相对较少.2015年Z.Vivian Feng课题组[12]通过在纳米金表面包被不同试剂以获得带不同电荷的纳米金,从而进行抗菌效果的比较,发现负电荷的纳米金基本不具备杀菌效果,而正电荷的纳米金具备杀菌效果,且随着电荷密度的增加,杀菌效果不断增强.2017年,Jelle Penders课题组[13]分别研究了带负电的金纳米微球,金纳米花,金纳米星对金黄色葡萄球菌生长的滞后时间和指数增长率的影响,观察到一种明显的浓度和形状依赖效应.由于形状的变化引起了抗菌效果的显著差异,推测这是由于表面面积较高,表面突起较多,这可能会使金纳米花更容易附着在细菌上,然后使膜破裂,从而导致细胞死亡.十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide,CTAB)是合成表面带正电荷的纳米金最为常用的一种包被试剂,同时基于CTAB包被的方法已经被发现可以合成诸如棒、三角形、球形、立方体等众多形状的纳米金[14],其中棒状、球形、三角形纳米金是稳定性较好、合成方法简单、并且应用较为广泛的典型三种形态的纳米金.基于此我们选择以CTAB为包被剂,表面带正电荷的球形、棒状和三角形三种不同形貌的金纳米颗粒的抗菌活性作为研究对象.本文以CTAB为包被试剂合成了球形、棒状和三角形三种不同形貌的表面带正电荷的纳米金颗粒,并以革兰氏阳性菌中的金黄色葡萄球菌及革兰氏阴性菌中的大肠杆菌为测试菌株,通过平板计数法和浊度法,确定纳米金颗粒对两种菌的最小杀菌浓度和最小抑菌浓度,研究了三种不同形态的正电荷纳米金对测试菌株的抗菌效果,并对其抗菌作用机理进行了探讨.1 实验部分1.1 试剂与仪器氯金酸(HAuCl4)、十六烷基三甲基溴化铵(CTAB)、硝酸银(AgNO3)、硼氢化钠(NaBH4)、抗坏血酸(AA)、柠檬酸三钠(C6H9Na3O9 )、异丙醇(C3H8O)、无水乙醇(C2H5OH)、氯化钠(NaCl)、碘化钾(KI)、磷酸盐缓冲溶液(PBS)、琼脂粉、脑心浸液培养基(BHI)、肉汤培养基(LB)以上试剂均为市售分析纯,实验用水为超纯水.供试菌株金黄色葡萄球菌(CICC 10384)、大肠杆菌(K12)均购于中国工业微生物菌种保藏管理中心.LDZX-30 KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;YT-CJ-2 D型超净工作台,北京亚泰科隆仪器技术有限公司;DH 4000 II电热恒温培养箱,天津市泰勒斯仪器有限公司;PB-10 Satorius Basic pH Meter,北京赛多利斯科学仪器有限公司;ZD-85 A双功能恒温气浴摇床,江苏省金坛市友联仪器研究所;HC-3018 R高速冷冻离心机,科大创新股份有限公司中海分公司;DF-101 S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;UV-1800型紫外-可见光谱仪,日本日立公司;JEM-2100型透射电子显微镜,日本 Jeol 公司;Cannon 500 D数码相机,佳能有限责任公司.1.2 纳米金的制备1.2.1 球形纳米金的制备.根据文献[15],在20 mL HAuCl4(2.5×10-4 M)溶液中加入0.0015 g柠檬酸三钠搅拌使柠檬酸三钠浓度为2.5×10-4 M,再加入0.6 mL 冰水配置的NaBH4溶液(0.1 M),溶液立刻变为粉色,再继续搅拌2-5 h,作为种子液.在200 mL HAuCl4 (2.5×10-4 M)溶液中加入6 g CTAB使CTAB浓度为0.08 M,在45 ℃条件下加热直至溶液变为橘色,冷却至室温,作为生长液待用(注意:若形成结晶则慢慢地用温和的温度溶解).在9 mL生长液中加入0.05 mL现配的Vc(0.1 M),在剧烈搅拌下加入1 mL种子液,继续搅拌10 min,使其变为深红色,然后在9 ml生长液中加入0.05 mL Vc(0.1 M),在剧烈搅拌下加入1 mL 深红色溶液,继续搅拌10 min,使其变为棕红色,即可得到粒径为17±2.5 nm 的球形纳米金.后处理:在10000 r/min,30 ℃ 条件下离心15 min,除去上清液,补水至10mL,重复上述离心过程2次,最后将所得的沉积物用水稀释至原体积的一半,并在4 ℃条件下避光保存.1.2.2 棒状纳米金的制备.根据文献方法[16],在5 mL CTAB(0.2 M)溶液中,加入5 mL HAuCl4(5.0 mM)溶液,搅拌,溶液由亮黄色变为橙色,继续搅拌并加入0.6 mL NaBH4(0.01 M)溶液(现用现配),搅拌2 min,溶液变为黄棕色,最后将金纳米粒子溶液在30 ℃水浴锅中恒温加热2 h,作为种子液待用.在5 mLCTAB(0.2 M)溶液中,在搅拌的过程中加入0.1 mL AgNO3 (0.004 M)溶液,再加入5 ml HAuCl4(1 mM)溶液,继续加入70 mL AA(0.0788 M)溶液.待溶液变为无色后,加入12 μL晶种.继续搅拌15 min,溶液变为紫色.最后将金纳米粒子溶液在30 ℃水浴锅中恒温加热2 h,溶液变为深蓝色,即可得到棒状纳米金.后处理过程同球形纳米金一样.1.2.3 三角形纳米金的制备.根据文献[17],在37.6 mL水中加入0.4 mLHAuCl4(2.5×10-4 M)和1 mL柠檬酸钠(10 mM),再加入1 mL冰水配置的NaBH4 溶液(0.1 M),大力搅拌2 min溶液变为橙红色,再放置2 h,确保未反应的NaBH4 完全水解,制成种子液.100 mL的生长液中包含2.5×10-4 M HAuCl4 溶液和0.05 M CTAB,再往溶液里加入55 μL KI(0.1 M)、0.55 mL Vc(0.1 M)、0.55 mL NaOH(0.1 M)轻轻地搅拌直至溶液变为橘色,冷却至室温,作为生长液待用.在生长液中加入0.1 mL种子液,添加后,生长溶液的颜色由透明变为淡红色,然后在30 min内转为深红色(反应溶液保持在30 ℃),即得到三角形纳米金.后处理过程同球形纳米金一样.1.3 样品的表征用UV-1800 紫外-可见光谱仪(UV-Vis,日本公司,日本)记录样品的紫外光谱,迅速区分球形纳米金、棒状纳米金与三角形纳米金.用JEM-2100型透射电子显微镜(TEM,日本 Jeol 公司,日本 )观测三种不同形态纳米金的形态和粒径.1.4 抗菌性能的测试以 E.coli和S.aureus 为测试菌种,采用平板计数法及96孔板法来检测纳米金对测试菌种的最小杀菌浓度(MBC)和最小抑菌浓度(MIC).1.4.1 培养基的制备.称取37 g脑心浸出液培养基于1 L蒸馏水中,煮沸使其充分溶解后,调节pH至7.2-7.3,加入15 g琼脂粉(若配制液体培养基则不需要加入琼脂粉),煮沸溶解后,于121 ℃高压灭菌20 min.灭菌后,于无菌操作台上倾注平板备用.用同样制备方法制备肉汤培养基.1.4.2 菌悬液的制备.从80 ℃冰箱中取出菌冻存管,待菌液溶解后,采用二倍稀释法[18,19]将菌液分别稀释至10-2、10-4、10-6 倍,各取100 μL涂于平板上,在37 ℃下培养18 h.在超净台中,取出20 mL灭菌后的液体培养基转移到100 mL锥形瓶中,用10 μL移液枪吸取一个完整的菌落,将枪头打入锥形瓶中,放入摇床(37 ℃,260 r/min)孵育14 h,之后取5 mL细菌悬浮液于10 mL离心管中,离心 (6000 r/min,2 min),除去上清液后,加入5 mL生理盐水,混匀后离心(6000 r/min,2 min),重复两次,再将洗去培养基的菌体中加入5 mL生理盐水,混合均匀后待用.1.4.3 最小杀菌浓度.将稀释到不同浓度的纳米金加到PBS缓冲溶液中,再加入100 μL稀释倍数为2×104的菌液混匀,使反应体系为1000 μL.放入摇床孵育4h后,取出100 μL涂于培养平板上,于37 ℃下倒置培养18 h,观察菌落生长情况.以只有PBS缓冲溶液和菌液的混合液作为实验空白对照.平行实验3次.观察菌落生长情况,以观察到少于5个菌落的样品对应的浓度作为最低杀菌浓度MBC值.1.4.4 最小抑菌浓度.将稀释到不同浓度的纳米金加到液体培养基中,再加入100μL稀释倍数为2×104的菌液混匀,使反应体系为1000 μL.取200 μL加入到96孔板对应区域作为实验组;把实验组的纳米金溶液换成等量的生理盐水,然后取200 μL加入到96孔板对应区域作为阳性对照;把实验组的菌液和液体培养基换成等量的生理盐水,然后取200 μL加入到96孔板对应区域作为阴性对照.将96孔板放入恒温培养箱中,在37 ℃条件下培养24 h,能阻止样品形成明显浊度的纳米金浓度即为最小抑菌浓度MIC.2 结果与讨论2.1 纳米金的表征2.1.1 紫外-可见光吸收光谱分析.图1为纳米金合成之后进紫外-可吸收光谱分析所得,紫外光谱分析显示:球形纳米金吸收峰在520 nm处,棒状纳米金吸收峰在525 nm和604 nm处,三角形纳米金吸收峰在728 nm和928 nm处,三者都与参考文献中的吸收峰基本一致,证实成功合成了球形纳米金、棒状纳米金和三角形纳米金.图1 CTAB包被的球形纳米金(a)、棒状纳米金(b)、三角形纳米金(c)的紫外-可见吸收光谱图2.1.2 透射电镜分析(TEM) .通过透射电镜可以直观的观察到所合成的纳米金的三种不同形态和粒径,如图2所示.从图中可以看出,三种不同形态的纳米金制备成功,并且均相对均匀,粒子之间分散较好.所合成的球形纳米金粒径大约为17 ± 2.5 nm,所合成的棒状纳米金的长度约为52.31 ± 0.86 nm,宽约为22.49 ± 0.56 nm,长径比约为2.3,所合成的三角形纳米金为正三角形,边长为100 ± 25 nm.图2 CTAB包被的球形纳米金(a)、棒状纳米金(b)、三角形纳米金(c)的TEM图2.2 不同形态纳米金的杀菌作用研究2.2.1 球形纳米金最小杀菌浓度.从图3可知,球形纳米金对大肠杆菌的MBC,当纳米金浓度大于21.21 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此MBC为21.21 μg/mL.球形纳米金对金黄色葡萄球菌的MBC,当纳米金浓度大于5.30 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此球形纳米金的MBC为5.30 μg/mL.图3 不同浓度的球形纳米金下大肠杆菌(a)、金黄色葡萄球菌(b)的平板图(纳米金与菌液反应4 h,平板在37℃下培育18 h)2.2.2 棒状纳米金最小杀菌浓度.从图4可知,棒状纳米金对大肠杆菌的MBC,当纳米金浓度大于1.30 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此MBC为1.30 μg/mL.棒状纳米金对金黄色葡萄球菌的MBC,当纳米金浓度大于0.52 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此棒状纳米金的MBC为0.52 μg/mL.图4 不同浓度的棒状纳米金下大肠杆菌(a)、金黄色葡萄球菌(b)的平板图(纳米金与菌液反应4 h,平板在37 ℃下培育18 h)2.2.3 三角形纳米金最小杀菌浓度.从图5可知,三角形纳米金对大肠杆菌的MBC,当纳米金浓度大于11.09 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此MBC为11.09 μg/mL.三角形纳米金对金黄色葡萄球菌的MBC,当纳米金浓度大于1.11 μg/mL时,观察到平板上的菌落数均少于5个菌落,因此三角形纳米金的MBC为1.11 μg/mL.图5 不同浓度的三角形纳米金下大肠杆菌(a)、金黄色葡萄球菌(b)的平板图(纳米金与菌液反应4 h,平板在37℃下培育18 h)2.3 不同形态纳米金的抑菌作用研究2.3.1 金黄色葡萄球菌.以金黄色葡萄球菌作为研究对象,将合成的不同形态纳米金进行稀释,球形纳米金稀释倍数分别为10、20、40、80、160倍,棒状纳米金稀释倍数为1000、2000、4000、8000、10000倍,三角形纳米金稀释倍数为50、100、200、400、800倍,使用稀释倍数对应的纳米金浓度分别进行最小抑菌浓度的测定,其96孔板结果如图6所示.结果显示对于金黄色葡萄球菌,球形纳米金的最小抑菌浓度为2.65 μg/mL,棒状纳米金的最小抑菌浓度为0.26 μg/mL,三角形纳米金的MIC为0.56 μg/mL.图6 CTAB包被的球形纳米金(a)、棒状纳米金(b)、三角形纳米金(c)对金黄色葡萄球菌37 ℃下培育24 h的得到的最小抑菌浓度图(图中数字为纳米金的浓度,单位为μg/mL)2.3.2 大肠杆菌.以大肠杆菌作为研究对象,将合成的不同形态纳米金进行稀释,球形纳米金稀释倍数分别为5、10、20、40、80倍,棒状纳米金稀释倍数为400、800、1000、2000、4000倍,三角形纳米金稀释倍数为30、60、120、240、800、480倍,不同形态的纳米金在不同稀释倍数对应的浓度下进行最小抑菌浓度的测定,其96孔板结果如图7所示.结果显示对于大肠杆菌,球形纳米金的最小抑菌浓度为21.21 μg/mL,棒状纳米金的最小抑菌浓度为0.65 μg/mL,三角形纳米金的MIC为3.70 μg/mL.图7 CTAB包被的球形纳米金(a)、棒状纳米金(b)、三角形纳米金(c)对大肠杆菌37℃培育24 h的得到的最小抑菌浓度图(图中数字为纳米金的浓度,单位为μg/mL)综上所述,通过平板计数法和96孔板法,确定了不同形貌纳米金颗粒对金黄色葡萄球菌及大肠杆菌的最小杀菌浓度(MBC)和最小抑菌浓度(MIC)如下表1所示,可以知道无论是对金黄色葡萄球菌还是对大肠杆菌,三种形态纳米金中棒状纳米金的杀菌效果是最好的,杀菌效果明显大于其它两种形态纳米金的杀菌效果.并且无论是何种形态的纳米金,其对金黄色葡萄球菌的杀菌效果都明显优于对大肠杆菌. 表1 不同形貌纳米金MIC和MBCMBC/μg·mL-1MIC/μg·mL-1E.coliS.aureusE.coliS.aureus球形21.215.3021.212.65棒状1.300.520.650.26三角形11.091.113.700.562.4 抗菌机理的探讨2014年,蒋兴宇课题组[20]就通过转录和蛋白质组学的方法研究了金纳米颗粒对革兰氏阴性菌大肠杆菌的杀菌机制,发现其作用方式有两种,一种是通过破坏细菌细胞膜的膜电位,来抑制ATP酶的活性,降低ATP水平,另一种是抑制核糖体亚基结合转运RNA.并且发现虽然生成ROS是大多数抗生素和抗菌纳米材料杀菌的主要原因,但金纳米颗粒的抗菌活性不会诱发任何与之相关的过程.张鹏等人[21]利用聚乙烯亚胺和牛血清蛋白修饰的金纳米球和金纳米棒来作为基因载体,发现棒状金纳米颗粒的尖端具有较大曲率,导致其电荷密度比球状金纳米颗粒大;而且棒状颗粒大多会通过尖端与细胞膜接触,导致以棒状颗粒作为基因载体时,可有较高的基因转染效率,棒状纳米金由于自身特殊的形态使其在与细菌接触方面有优势.我们的实验结果中,棒状纳米金的杀菌效果较其它两种形态纳米金更好,推测有可能是因为这种特殊的接触方式.纳米颗粒的表面电荷在其抗菌能力上起着明显的作用[22].比如,Angélique团队[23]研究不同的粒子直径和Zeta电位对二氧化钛纳米颗粒的杀菌活性的影响时发现,直径约为相同大小的二氧化钛纳米颗粒,当Zeta电位较高时表现出更强的抗菌效.这表明表面电荷的增强也是一种增强杀菌效果的途径,并且纳米粒子的表面带负电荷,会对表面带负电的细菌有一定的排斥作用[24,25].我们做了Zeta电位来验证本实验中不同形态的纳米金的杀菌效果与电荷密度的关系,棒状纳米金Zeta电位为56.8 mV,球形纳米金Zeta电位为42.1 mV,三角形纳米金Zeta电位为33.2 mV.如图8所示,三种形态的纳米金确实都带正电,且棒状纳米金较其它两种形态纳米金所带电荷密度较高,同时我们实验结果表明相较于其它两种形态,棒状纳米金的杀菌效果更好,这也进一步说明了表面带有正电荷的纳米金会随着电荷密度的增加,杀菌效果不断增强.图8 CTAB包被的球形纳米金、棒状纳米金、三角形纳米金的Zeta电位3 结论采用CTAB包被制备出不同形态(球形、棒状、三角形)的纳米金,将金黄色葡萄球菌和大肠杆菌作为受试菌株进行抗菌研究,从抗菌特性的研究结果中可以很明显的看出,无论是对金黄色葡萄球菌还是大肠杆菌,棒状纳米金的杀菌效果都要高于其它两种形态的纳米金.细菌表面带负电荷,带正电的纳米粒子被表面带负电的细菌所吸引,与细菌的细胞膜接触,破坏细菌的细胞膜从而进入细菌内部杀死细菌.而棒状纳米金从空间效应上更易于与细菌接触,这也是它之所以具有较高杀菌特性的原因.三种形态的纳米金均对金黄色葡萄球菌表现出优于大肠杆菌的杀菌效果,这可能是因为两种细菌的细胞壁不一样所导致的,这些结果为我们进一步开展工作奠定了基础.参考文献【相关文献】[1] Dizaj S M,Lotfipour F,Barzegarjalali M,et al.Antimicrobial activity of the metals and metal oxide nanoparticles [J].Materials Science & Engineering C,2014,44(44):278-284.[2] 马万顺,崔燕,赵玉云,等.纳米颗粒抗菌机理的研究进展[J].生物物理学报,2010,26(8):638-648.[3] Zhao Y,Tian Y,Cui Y,et al.Small molecule-capped gold nanoparticles as potent antibacterial agents that target Gram-negative bacteria[J].Journal of the American Chemical Society,2010,132(35):12349-12356.[4] 李艳华,陈曦萌.石墨烯基银抗菌材料的制备方法及抗菌机理研究[J].聊城大学学报(自然科学版),2014,27(3):71-74.[5] Avelino C,Hermenegildo G.Supported gold nanoparticles as catalysts for organic reactions[J].Chemical Society Reviews,2008,37:2096-2126.[6] Prabaharan M,Grailer J J,Pilla S,et al.Gold nanoparticles with a monolayer of doxorubicin-conjugated amphiphilic block copolymer for tumor-targeted drugdelivery[J].Biomaterials,2009,30(30):6065-6075.[7] Yanez-Sedeno P,Pingarron J M.Gold nanoparticle-based electrochemical biosensors[J].Electrochimica Acta,2005,382(4):884-886.[8] Lin Y W,Huang C C,Chang H T.Gold nanoparticle probes for the detection of mercury,lead and copper ions[J].Analyst,2011,136(5):863-871.[9] Guo Y,Wang Z,Qu W,et al.Colorimetric detection of mercury,lead and copper ions simultaneously using protein-functionalized gold nanoparticles[J].Biosensors & Bioelectronics,2011,26(10):4064-4069.[10] Gu H W,Ho P L,Tong E,et al.Presenting vancomycin on nanoparticles to enhance antimicrobial activities[J].Nano Letters,2003,3(9):1261-1263.[11] Tom R T,Suryanarayanan V,Reddy P G,et al.Ciprofloxacin-protected gold nanoparticles[J].Langmuir,2004,20(5):1909-1914.[12] Pal S,Tak Y K,Song J M.Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study of the Gram-negative bacterium Escherichia coli[J].Applied & Environmental Microbiology,2007,73(6):1712-1720. [13] Penders J,Stolzoff M,Hickey D J,et al.Shape-dependent antibacterial effects of non-cytotoxic gold nanoparticles[J].International Journal of Nanomedicine,2017,12:2457-2468.[14] Yang X,Yang M,Pang B,et al.Gold nanomaterials at work inbiomedicine[J].Chemical Reviews,2015,115(19):10410-10488.[15] Jana N R,Gearheart L,Murphy C J.Seeding growth for size control of 5-40 nm diameter gold nanoparticles[J].Langmuir,2001,17(22):6782-6786.[16] Wang Y,Zhou X,Xu C,et al.Gold nanorods as visual sensing platform for chiral recognition with naked eyes[J].Scientific Reports,2018,8(1):5296-5304.[17] Guo Z,Fan X,Liu L,et al.Achieving high-purity colloidal gold nanoprisms and their application as biosensing platforms[J].Journal of Colloid & Interface Science,2010,348(1):29-36.[18] Fang M,Chen J H,Xu X L,et al.Antibacterial activities of inorganic agents on six bacteria associated with oral infections by two susceptibility tests[J].International Journal of Antimicrobial Agents,2006,27(6):513-517.[19] Kim J,Marshall M R,Wei C I.Antibacterial activity of some essential oil components against five foodborne pathogens[J].Journal of Agricultural & Food Chemistry,1995,43(11):1027-1037.[20] Cui Y,Zhao Y,Tian Y,et al.The molecular mechanism of action of bactericidal gold nanoparticles on Escherichia coli[J].Biomaterials,2012,33(7):2327-2333.[21] Zhang P,Li B,Du J,et al.Gold nanoparticles coated by polyethylenimine-g-bovine serum albumin with different morphologies for effective gene delivery[J].Journal of Controlled Release,2017,259:102-103.[22] Seil J T,Webster T J.Antimicrobial applications of nanotechnology:methods and literature[J].International Journal of Nanomedicine,2012,7(1):2767-2781.[23] Angelique S,Sylvain L,Martine M ,et al.Size-,composition- and shape-dependent toxicological impact of metal oxide nanoparticles and carbon nanotubestoward bacteria[J].Environmental Science & Technology,2009,43(21):8423-8429. [24] Silhavy T J,Kahne D,Walker S.The bacterial cell envelope[J].Cold Spring Harbor Perspectives in Biology,2010,2(5):a000414.[25] Dickson J S,Koohmaraie M.Cell surface charge characteristics and their relationshipto bacterial attachment to meat surfaces[J].Applied & Environmental Microbiology,1989,55(4):832-836.。

金纳米颗粒的尺寸与紫外吸收峰的关系金纳米颗粒是一种具有许多应用潜力的纳米材料。
它们具有小尺寸、高比表面积和特殊的光学性质,因此被广泛应用于光学、电子学、催化剂等领域。
其中,金纳米颗粒的尺寸与其紫外吸收峰之间存在一定的关系。
金纳米颗粒的尺寸通常通过直径来表示,常用的单位有纳米(nm)。
尺寸较小的金纳米颗粒通常具有更高的比表面积,这意味着它们能够吸收更多的光线。
当金纳米颗粒吸收光线时,会发生表面等离子共振现象,即金纳米颗粒表面的电子在光的作用下产生共振振荡。
这种共振振荡会导致金纳米颗粒对特定波长的光有较强的吸收能力,形成紫外吸收峰。
根据研究发现,金纳米颗粒的尺寸与其紫外吸收峰之间存在一定的关系。
一般而言,金纳米颗粒的尺寸越小,其紫外吸收峰就会越靠近短波长的紫外光区域。
这是因为尺寸较小的金纳米颗粒具有更高的能级间距,能够吸收更高能量的光,因此其紫外吸收峰在紫外光区域出现。
相反,尺寸较大的金纳米颗粒具有较低的能级间距,主要吸收可见光,因此其紫外吸收峰在可见光区域出现。
具体来说,当金纳米颗粒的直径在1-10纳米范围内时,其紫外吸收峰通常在250-400纳米之间。
随着金纳米颗粒直径的增加,紫外吸收峰会逐渐向可见光区域移动。
当金纳米颗粒的直径超过10纳米时,其紫外吸收峰可能出现在400-550纳米之间,即可见光区域。
需要注意的是,金纳米颗粒的尺寸与紫外吸收峰之间的关系并非绝对。
除了尺寸,金纳米颗粒的形状、表面修饰和环境等因素也会对其光学性质产生影响。
此外,金纳米颗粒的光学性质还受到局域表面等离子共振和远场耦合等现象的影响。
因此,在研究金纳米颗粒的光学性质时,需要综合考虑多个因素。
总结起来,金纳米颗粒的尺寸与紫外吸收峰之间存在一定的关系。
一般而言,尺寸较小的金纳米颗粒会在紫外光区域出现紫外吸收峰,而尺寸较大的金纳米颗粒会在可见光区域出现紫外吸收峰。
这一关系可以通过调控金纳米颗粒的尺寸来实现对其光学性质的调控。
在未来的研究中,进一步深入理解金纳米颗粒的光学性质将有助于其在光学、电子学和催化剂等领域的应用。

Supporting Information‘Determination of Size and Concentration of Gold Nanoparticles from UV/vis Spectra’Wolfgang Haiss*1,2, Nguyen T. K. Thanh1,2, Jenny Aveyard1 and David G. Fernig2Centre for Nanoscale Science,1Department of Chemistry, University of Liverpool, Crown Street L69 7ZD, U.K2School of Biological Sciences, University of Liverpool, Crown Street L69 7ZB, U.KTable of Content1. Tabular material for the determination of the size of uncoated spherical gold nanoparticles in water from UV/vis spectra.2. Tabular Material for the determination of the concentration of uncoated spherical gold nanoparticles in water from UV/vis spectra.3. The FORTRAN 77 program ‘mie-mfp.f’ which was used to calculate Q ext(λ,d).1. Tabular material for the determination of the size of uncoated spherical gold nanoparticles in water from UV/vis spectra.The values in Tables S-1 and S-2 can be used to calculate the size of GNPs form UV/vis spectra. For particles having a diameter larger than 35 nm Table S-1 and Table S-2 can be used to determine the particle diameter d. For smaller particles the absorbance ratio of Table S-2 can be used but it should be noted that particle sizes can be obtained from Equation 12 with slightly improved precision if the initial gold concentration is known. For particle diameters smaller than 10 nm the values in Table S-2 should only be considered as an estimate since surface effects may get increasingly important in this size region.λspr/ nm d / nm λspr / nm d / nm λspr / nm d / nm 525.0 32 534.9 58 552.1 84 525.6 34 535.9 60 553.8 86 526.2 36 536.9 62 555.7 88 526.8 38 538.0 64 557.6 90 527.5 40 539.2 66 559.6 92 528.2 42 540.4 68 561.7 94 528.9 44 541.6 70 563.9 96 529.6 46 542.9 72 566.2 98 530.4 48 544.3 74 568.6 100 531.2 50 545.7 76 571.1 102 532.1 52 547.2 78 573.7 104 533.0 54 548.8 80 576.5 106 533.9 56 550.4 82 579.3 108Table S-1: Position of the surface plasmon resonance peak in dependence of the particle diameter calculated from Equation 10.A spr/A450 d / nm A spr/A450 d / nm A spr/A450 d / nm1.10 3 1.56 12 1.96 401.19 4 1.61 142.00 451.27 5 1.65 162.03 501.33 6 1.69 182.07 551.387 1.73 202.10 601.428 1.80 252.12 651.469 1.86 302.15 701.5010 1.92 352.17 75Table S-2: Ratio of the absorbance of GNPs at the surface plasma resonance peak (A spr) to the absorbance at 450 nm (A450) in dependence the particle diameter calculated from Equation 11 using the fit parameters to the experimental results.2. Tabular material for the determination the concentration of uncoated spherical gold nanoparticles in water from UV/vis spectra.The data of ε450(d ) in Table S-3 can be used to calculate the particle concentration c in mol per litre from the absorption A at 450 nm for a standard path length l of 1 cm according to:c = A 450/ε450The data have been experimentally verified in the d range from 5 – 100 nm (see Figure 8). For particle diameters smaller than 5 nm the values should only be considered as an estimate since surface effects may get increasingly important in this size region.d /nm ε450 / M -1cm -1 d / nm ε450 / M -1cm -1d / nm ε450 / M -1cm -12 4.25E+0535 3.21E+09 68 2.50E+103 1.49E+06 36 3.52E+09 69 2.61E+104 3.62E+06 37 3.84E+09 70 2.71E+105 7.20E+06 38 4.18E+09 71 2.82E+10 6 1.26E+07 39 4.54E+09 72 2.93E+10 7 2.03E+07 40 4.92E+09 73 3.05E+108 3.07E+07 41 5.32E+09 74 3.16E+10 9 4.43E+07 42 5.74E+09 75 3.28E+10 10 6.15E+07 43 6.18E+09 76 3.40E+10 11 8.27E+07 44 6.65E+09 77 3.52E+10 12 1.09E+08 45 7.13E+09 78 3.64E+10 13 1.39E+08 46 7.65E+09 79 3.77E+10 14 1.76E+08 47 8.18E+09 80 3.89E+10 15 2.18E+08 48 8.74E+09 81 4.02E+10 16 2.67E+08 49 9.32E+09 82 4.14E+10 17 3.24E+08 50 9.92E+09 83 4.27E+10 18 3.87E+08 51 1.06E+10 84 4.40E+10 19 4.60E+08 52 1.12E+10 85 4.53E+10 20 5.41E+08 53 1.19E+10 86 4.65E+10 21 6.31E+08 54 1.26E+10 87 4.78E+10 22 7.31E+08 55 1.33E+10 88 4.91E+10 23 8.42E+08 56 1.41E+10 89 5.04E+10 24 9.64E+08 57 1.48E+10 90 5.17E+10 25 1.10E+09 58 1.57E+10 91 5.30E+10 26 1.24E+09 59 1.65E+10 92 5.43E+10 27 1.40E+09 60 1.73E+10 93 5.56E+10 28 1.58E+09 61 1.82E+10 94 5.69E+10 29 1.76E+09 62 1.91E+10 95 5.82E+10 30 1.96E+09 63 2.00E+10 96 5.94E+10 31 2.18E+09 64 2.10E+10 97 6.07E+10 32 2.41E+09 65 2.19E+10 98 6.19E+10 33 2.66E+09 66 2.29E+10 99 6.31E+10 34 2.93E+0967 2.40E+10100 6.44E+10Table S-3: Molar decadic extinction coefficient (ε) at λ = 450 nm calculated from the fit (Equation 13) to the theoretical extinction efficiencies for gold nano particles in water with diameter d ranging from 2 to 100 nm.3. The FORTRAN 77 program ‘mie-mfp.f’ which was used to calculate Q ext(λ,d). PROGRAM MIE-MFPREAL A(1100), B(1100), C(1100)COMPLEX RFREL1,RFREL2CHARACTER*64 file_in, file_outC ***************************************************************C This program calculates the scattering efficiency (QSCA;col2),C the extinction efficiency (QEXT;col3) for a coated sphereC using Mie theory. The wavelength of the incident lightC is scanned between two values with a step-width.C The complex refractive index of the sphere as a functionC of the wavelength/nm in vacuum is read in from a separate file.C Linear interpolation is used to interpolate theseC experimentally determined data.C ***************************************************************C ***************************************************************C Input of parameters:WRITE(6,*) 'ENTER THE START WAVELENGT / NM:'READ(5,*) WAVEL1WRITE(6,*) 'ENTER END WAVELENGT / NM:'READ(5,*) WAVEL2WRITE(6,*) 'ENTER THE NUMBER OF VALUES TO BE CALCULATED:'READ(5,*) NUMVALWRITE(6,*) 'REFRACTIVE INDEX OF THE SURROUNDING MEDIUM:'READ(5,*) REFMEDWRITE(6,*) 'REAL PART REFRACTIVE INDEX OF THE COATING:'READ(5,*) REFRE2WRITE(6,*) 'IMMAG. PART OF THE REFR. INDEX OF THE COATING:'READ(5,*) REFIM2WRITE(6,*) 'SPHERE RADIUS / NM:'READ(5,*) RADCORWRITE(6,*) 'COATING RADIUS / NM:'READ(5,*) RADCOTWRITE(6,*) 'ENTER THE PLASMA FREQUENCY IN HZ/1E+14 (138. for Au):'READ(5,*) OMPWRITE(6,*) 'ENTER THE COLLISION FREQ. IN Hz/1E+14 (0.333 for Au):'READ(5,*) OM0WRITE(6,*) 'ENTER END FERMI VELOCITY IN cm/s (1.4E+8 for Au):'READ(5,*) FVWRITE(6,*) 'SPECIFY THE FILENAME OF THE CORE REFRACTIVE INDEX:'READ(5,'(A)') file_inWRITE(6,*) 'SPECIFY THE FILENAME OF THE OUTPUT FILE:'READ(5,'(A)') file_outC ***************************************************************pi=3.14159265TAU= (1/OM0)*1E-14FMPINF=FV*TAUC ***************************************************************C Output of parameters to file_out:OPEN(UNIT=11,FILE=file_out,STATUS='NEW')WRITE(11,*) 'WAV ','QSCA ','QEXT ','NSTOP 'C ***************************************************************C ***************************************************************C Data of REFRE1 (col2;B(K)) and REFIM1 (col3;C(K))are read fromC the input file into 1-dimensional arrays (A=WAVEL; B=n; C=k).C Note that the data-file must contain increasing values of theC wavelength in column 1 it also must contain a single number inC line 1, specifying the total Nr of Data lines.OPEN(UNIT=10,FILE=file_in,STATUS='OLD')READ(10,*) NDO 5 K=1,NREAD(10,*) A(K), B(K), C(K)5 CONTINUEC ***************************************************************C Calculating the wavelength step-width:DELTA = (WAVEL2 - WAVEL1)/(NUMVAL - 1)C Repeating the calculations:DO 100 I = 1,NUMVALWAVEL = WAVEL1 + (I-1)*DELTAC ***************************************************************C Linear interpolation of n and k from input file:IF(WAVEL.EQ.A(1)) THENK=1ELSEK=215 IF (A(K).LT.WAVEL) THENK=K+1GO TO 15END IFrn = B(K-1) + (WAVEL - A(K-1))/(A(K) - A(K-1))*(B(K) - B(K-1))rk = C(K-1) + (WAVEL - A(K-1))/(A(K) - A(K-1))*(C(K) - C(K-1))END IFC ***************************************************************CALL MFP (FV,WAVEL,RADCOR,OMP,OM0,rn,rk,rnr,rkr,OM0R)C This Subroutine corrects the bulk values of n and k for smallC particles taking into account the 'mean free path effect' onC the 'free' conduction electrons in the Drude model.REFRE1 = rnrREFIM1 = rkrTAUR=(1/OM0R)*1E-14FMPR=FV*TAURC Calculating relative size parameters for core (X) and coating (Y) X=2.*pi*RADCOR*REFMED/WAVELy=2.*pi*RADCOT*REFMED/WAVELC Calculating the complex relative refractive indices:RFREL1=CMPLX(REFRE1,REFIM1)/REFMEDRFREL2=CMPLX(REFRE2,REFIM2)/REFMEDCALL BHCOAT (X,Y,RFREL1,RFREL2,QEXT,QSCA,QBACK,NSTOP)C Recalibration of the scattering efficiencies QC with respect to RADCOR instead of RADCOTQEXT = QEXT*(RADCOT/RADCOR)*(RADCOT/RADCOR)QSCA = QSCA*(RADCOT/RADCOR)*(RADCOT/RADCOR)QBACK= QBACK*(RADCOT/RADCOR)*(RADCOT/RADCOR)WRITE (11,*) WAVEL,QSCA,QEXT,NSTOP100 CONTINUEWRITE(11,*) 'FMPINF: ',FMPINF ,'cm 'WRITE(11,*) 'FMPR: ',FMPR ,'cm 'WRITE(11,*) 'TAU: ',TAU ,'s 'WRITE(11,*) 'TAUR: ',TAUR ,'s 'WRITE(11,*) 'OMP: ',OMP ,'1E+14Hz 'WRITE(11,*) 'OM0: ',OM0 ,'1E+14Hz 'WRITE(11,*) 'FER-VEL: ',FV,'cm/s 'WRITE(11,*) 'REFMED: ',REFMEDWRITE(11,*) 'REFRE2: ',REFRE2WRITE(11,*) 'REFIM2: ',REFIM2WRITE(11,*) 'RADCOR: ',RADCORWRITE(11,*) 'RADCOT: ',RADCOTWRITE(11,*) 'FILEIN: ',file_inWRITE(11,*) 'FILEOUT: ',file_outSTOPENDSUBROUTINE BHCOAT (X,Y,RFREL1,RFREL2,QEXT,QSCA,QBACK,NSTOP)C *************************************************************** C The Subroutine BHCOAT was produced from the original FORTRANC code of Bohren and Huffman which can be found in the appendix C of their Book: Bohren, C. F.; Huffman, D. R.C Absorption and Scattering of Light by Small Particles;C Wiley Interscience: New York, 1983C *************************************************************** COMPLEX RFREL1,RFREL2,X1,X2,Y2,REFRELCOMPLEX D1X1,D0X1,D1X2,D0X2,D1Y2,D0Y2COMPLEX XI0Y,XI1Y,XIY,CHI0Y2,CHI1Y2,CHIY2,CHI0X2,CHI1X2,CHIX2COMPLEX CHIPX2,CHIPY2,ANCAP,BNCAP,DNBAR,GNBAR,AN,BN,CRACK,BRACK COMPLEX XBACK,AMESS1,AMESS2,AMESS3,AMESS4DEL=1.0E-8X1=RFREL1*XX2=RFREL2*XY2=RFREL2*YYSTOP = Y + 4.*Y**.3333 + 2.REFREL=RFREL2/RFREL1NSTOP = YSTOPD0X1=CCOS(X1)/CSIN(X1)D0X2=CCOS(X2)/CSIN(X2)D0Y2=CCOS(Y2)/CSIN(Y2)PSI0Y=COS(Y)PSI1Y=SIN(Y)CHI0Y=-SIN(Y)CHI1Y=COS(Y)XI0Y=CMPLX(PSI0Y,-CHI0Y)XI1Y=CMPLX(PSI1Y,-CHI1Y)CHI0Y2=-CSIN(Y2)CHI1Y2=CCOS(Y2)CHI0X2=-CSIN(X2)CHI1X2=CCOS(X2)QSCA=0.0QEXT=0.0XBACK=CMPLX(0.0,0.0)N=1IFLAG=0200 RN=NPSIY=(2.*RN-1.)*PSI1Y/Y-PSI0YCHIY=(2.*RN-1.)*CHI1Y/Y-CHI0YXIY=CMPLX(PSIY,-CHIY)D1Y2=1./(RN/Y2-D0Y2)-RN/Y2IF (IFLAG.EQ.1) GO TO 999D1X1=1./(RN/X1-D0X1)-RN/X1D1X2=1./(RN/X2-D0X2)-RN/X2CHIX2=(2.*RN-1.)*CHI1X2/X2-CHI0X2CHIY2=(2.*RN-1.)*CHI1Y2/Y2-CHI0Y2CHIPX2=CHI1X2-RN*CHIX2/X2CHIPY2=CHI1Y2-RN*CHIY2/Y2ANCAP=REFREL*D1X1-D1X2ANCAP=ANCAP/(REFREL*D1X1*CHIX2-CHIPX2)ANCAP=ANCAP/(CHIX2*D1X2-CHIPX2)BRACK=ANCAP*(CHIY2*D1Y2-CHIPY2)BNCAP=REFREL*D1X2-D1X1BNCAP=BNCAP/(REFREL*CHIPX2-D1X1*CHIX2)BNCAP=BNCAP/(CHIX2*D1X2-CHIPX2)CRACK=BNCAP*(CHIY2*D1Y2-CHIPY2)AMESS1=BRACK*CHIPY2AMESS2=BRACK*CHIY2AMESS3=CRACK*CHIPY2AMESS4=CRACK*CHIY2IF(CABS(AMESS1).GT.DEL*CABS(D1Y2)) GO TO 999IF(CABS(AMESS2).GT.DEL) GO TO 999IF(CABS(AMESS3).GT.DEL*CABS(D1Y2)) GO TO 999IF(CABS(AMESS4).GT.DEL) GO TO 999BRACK=CMPLX(0.0,0.0)CRACK=CMPLX(0.0,0.0)IFLAG=1999 DNBAR=D1Y2-BRACK*CHIPY2DNBAR=DNBAR/(1.-BRACK*CHIY2)GNBAR=D1Y2-CRACK*CHIPY2GNBAR=GNBAR/(1.-CRACK*CHIY2)AN=(DNBAR/RFREL2+RN/Y)*PSIY-PSI1YAN=AN/((DNBAR/RFREL2+RN/Y)*XIY-XI1Y)BN=(RFREL2*GNBAR+RN/Y)*PSIY-PSI1YBN=BN/((RFREL2*GNBAR+RN/Y)*XIY-XI1Y)QSCA=QSCA+(2.*RN+1.)*(CABS(AN)*CABS(AN)+CABS(BN)*CABS(BN))XBACK=XBACK+(2.*RN+1.)*(-1.)**N*(AN-BN)QEXT=QEXT+(2.*RN+1.)*(REAL(AN)+REAL(BN))PSI0Y=PSI1YPSI1Y=PSIYCHI0Y=CHI1YCHI1Y=CHIYXI1Y=CMPLX(PSI1Y,-CHI1Y)CHI0X2=CHI1X2CHI1X2=CHIX2CHI0Y2=CHI1Y2CHI1Y2=CHIY2D0X1=D1X1D0X2=D1X2D0Y2=D1Y2N=N+1IF(N-1-NSTOP) 200,300,300300 QSCA=(2./(Y*Y))*QSCAQEXT=(2./(Y*Y))*QEXTQBACK=XBACK*CONJG(XBACK)QBACK=(1./(Y*Y))*QBACKRETURNENDSUBROUTINE MFP (FV,WAVEL,RADCOR,OMP,OM0,rn,rk,rnr,rkr,OM0R)C *************************************************************** C This program corrects the bulk values of n and k for smallC particles taking into account the 'mean free path effect' onC the 'free' conduction electrons in the extended Drude model.C All calculations performed in cm-g-s units.C Plasma Frequency and collision frequency both internally devided C by 1E+14 to avoid overflowC *************************************************************** CL = 2.998E+10pi = 3.14159265C Calculate EPS1 and EPS2 from rn and rk:EPS1 = rn*rn - rk*rkEPS2 = 2.*rn*rkC Calculate OM and A1 and A2:OM = (2.*pi*CL/(WAVEL*1.E-7))/1.E+14A1 = 1.-(OMP*OMP/(OM*OM + OM0*OM0))A2 = OMP*OMP*OM0/(OM*(OM*OM + OM0*OM0))C Contribution of the bond electrons to n (B1) and k (B2):B1 = EPS1 - A1B2 = EPS2 - A2C Calculate R dependent OM0 (OM0R)OM0R = OM0 + (FV/(RADCOR*1.E-7))/1.E+14C Calculate R dependent contributions of the free electrons:A1R = 1.-(OMP*OMP/(OM*OM + OM0R*OM0R))A2R = OMP*OMP*OM0R/(OM*(OM*OM + OM0R*OM0R))C Calculate R dependent EPS (EPS1R and EPS2R)EPS1R = A1R + B1EPS2R = A2R + B2C Reconvert EPS1R and EPS2R back to n and k:rnr = SQRT((A1R + B1)/2. + SQRT((A1R/2.+B1/2.)*(A1R/2.+B1/2.)_+(A2R/2.+B2/2.)*(A2R/2.+B2/2.)))rkr = SQRT(-(A1R + B1)/2. + SQRT((A1R/2.+B1/2.)*(A1R/2.+B1/2.)_+(A2R/2.+B2/2.)*(A2R/2.+B2/2.)))C WRITE(6,*) 'rn= ',rnC WRITE(6,*) 'rnr= ',rnrC WRITE(6,*) 'OM0= ',OM0C WRITE(6,*) 'OM0R= ',OM0RC WRITE(6,*) 'OM= ',OMEND。

金纳米粒子的紫外吸收峰220-概述说明以及解释1.引言1.1 概述金纳米粒子是一种具有特殊结构和性质的纳米材料,在科学研究和工业应用领域具有广泛的潜力。
金纳米粒子的制备方法多种多样,其中包括化学合成、溶液法、电化学法等。
这些方法可以根据需要控制金纳米粒子的形状、尺寸和表面性质,从而使其具备特定的物理和化学特性。
金纳米粒子的性质和应用也十分丰富和多样化。
由于其尺寸效应和表面效应的特殊性质,在光学、电学、磁学等领域展现出了独特的优势。
金纳米粒子在荧光标记、生物传感、催化剂等领域的应用具有广泛的前景。
此外,金纳米粒子还被广泛用于纳米电子器件、纳米催化反应、纳米医学等领域的研究和开发。
本文主要关注金纳米粒子的紫外吸收峰220的特性和影响因素。
紫外吸收峰220是金纳米粒子的一种光学性质,具体指金纳米粒子在紫外光区域的吸收峰位于波长220纳米附近。
这一特性对于金纳米粒子的表征和应用具有重要意义。
本文通过对金纳米粒子的制备方法、性质和应用的介绍,以及对金纳米粒子紫外吸收峰220的特性和影响因素的探讨,旨在增加对金纳米粒子的理解并推动金纳米粒子在相关领域的研究和应用的进一步发展。
此外,本文还展望了金纳米粒子未来研究的方向,并总结了金纳米粒子的紫外吸收峰220的影响因素,提供了对金纳米粒子研究的有益参考。
1.2文章结构1.2 文章结构本文将从以下几个方面进行探讨金纳米粒子的紫外吸收峰220以及相关的性质和应用。
首先,在引言部分,将对金纳米粒子的背景和重要性进行概述,以及文章的目的和结构进行介绍。
接下来,正文部分将着重介绍金纳米粒子的制备方法。
将介绍常见的化学合成、物理法等制备方法,并重点分析不同制备方法对金纳米粒子的粒径、形态和表面性质的影响。
然后,将深入探讨金纳米粒子的性质和应用。
将介绍金纳米粒子的表面等离子共振现象,以及其与电磁波的相互作用机制。
同时,还将探讨金纳米粒子在生物医学、催化和传感等领域的应用。
特别地,将重点关注金纳米粒子的紫外吸收峰220带来的应用前景和潜在的研究方向。

化合物结构鉴定紫外-可见光谱分析作业1.说明纳米Ru、Rh、Ir 等十种纳米材料的紫外可见光谱(附图)2.说明马尾紫、孔雀绿、多氯代酚、苏丹、peo-ppo-peo、pvp等十种有机物或聚合物的紫外可见光谱(附图)解答如下:1(1)、纳米ZnS的紫外-可见光谱分析紫外吸收光谱表征:紫外-可见吸收光谱可观察能级结构的变化,通过吸收峰位置变化可以考察能级的变化。
由图5可知,硫化锌在200~340 nm波长范围内对紫外光有较强的吸收。
1(2)、NiFeAu纳米材料的紫外-可见光谱分析紫外吸收光谱表征:上图比较了相关纳米粒子的紫外-可见吸收光谱.图b是NiFeAu纳米粒子分散在正己烷中的紫外-可见吸收光谱可以看出NiFeAu纳米粒子在约557nm有一个较宽的吸收峰.对比用同样方法合成的NiFe图a在所测试的范围内无特征的吸收峰可以判断多功能性NiFeAu纳米粒子具有源于Au表面等离子共振吸收的光学性质.与用同样方法合成的纳米Au粒径8nm在可见光区526nm有强的吸收峰相比图c NiFeAu纳米粒子的吸收峰形明显变宽并出现红移该观察说明除了粒径大小变化的因素Fe和Ni的存在影响了Au的表面等离子共振吸收也间接证明了NiFeAu纳米复合粒子的生成.Au的特征吸收峰的峰形和强度不同原因在于纳米粒子的组成发生了变化.根据纳米颗粒光学响应模型Mie理论表面等离子共振吸收是由入射光频率和金属纳米颗粒中的自由电子的集体发生共振时产生的而表面等离子共振吸收的共振条件对纳米颗粒周围的环境十分敏感纳米粒子的组成结构尺寸形状电解质或者粒子间的相互作用力不同特征吸收峰的强度和形状都会受到影响而不一样.1(3)、TiO纳米材料的紫外-可见光谱分析2紫外吸收光谱表征:水悬浮液的 UV-vis 吸收和透射光谱。
由图上图是0.05% 金红石纳米Tio2在紫外光范围内都可见, 即使在很低的浓度下( 0.05% ) , 金红石型纳米Tio2有很强的吸收性能, 其最高吸收峰达到2.0以上, 对应的紫外光透过率接近0。
![纳米金的制备与表征[1]](https://uimg.taocdn.com/7803c662e45c3b3567ec8b90.webp)

ZnMgO紫外探测器研究现状1 引言ZnO是一种直接宽带隙的半导体材料(禁带宽度为3.37 eV),在室温下有很高的激子束缚能(60 meV),外延生长温度低,抗辐射能力强。
通过Mg的掺入可实现禁带宽度从3.3 eV 到7.8 eV可调的ZnMgO合金,ZnMgO作为优良的紫外光电材料在光电系统中有着广泛的应用,像LED、光探测器和太阳能电池等,特别是紫外光探测器方面的应用。
紫外探测器广泛用于矿井可燃气体和汽车尾气的监测、固体燃料成分分析、环境污染监测、细胞癌变分析、DNA 测试、准分子激光器检测等领域。
在军事上可用于导弹跟踪、火箭发射、飞行器制导以及生化武器的探测。
在现实生活中,用于火灾监测、紫外通信以及紫外线辐射的测量。
随着紫外线的广泛应用,紫外探测器在环保、医学、军事等领域将得到更广泛的应用。
作为一种宽禁带半导体材料,ZnMgO近年来受到了研究人员的广泛关注。
2 ZnMgO紫外光探测器的研究进展ZnMgO薄膜材料生长和紫外探测器的研究主要有美国、日本,印度、南韩等国家,薄膜生长方法以脉冲激光沉积(PLD),分子束外延(MBE),金属有机化学气相沉积(MOCVD),和磁控溅射等为主。
自1998年日本东京技术研究所用PLD方法在蓝宝石(0001)衬底上生长出了Mg组分达0.33的ZnMgO单晶薄膜之后,高Mg组分的ZnMgO薄膜材料生长和紫外探测器研究引起了人们的极大兴趣。
美国北卡罗那州大学,马里兰大学都相继报道了ZnMgO薄膜的生长及光学特性研究;南韩Pohang科技大学采用MOCVD方法在蓝宝石衬底上生长了Mg组分(0-0.49)连续可调的ZnMgO薄膜,并有X-射线衍射(XRD)谱表明未发生结构分相。
这些结果已远远超过平衡态下Mg在ZnO中的固溶度值≤4%。
以上ZnMgO薄膜大都是在单晶衬底和较高的衬底温度(350-750℃)上生长,而日本Ritsumeikan大学和印度德里大学均采用磁控溅射方法,在不加热的硅和石英衬底上生长出了Mg组分0.42和0.46的ZnMgO薄膜,结果表明薄膜仍未发生结构分相。
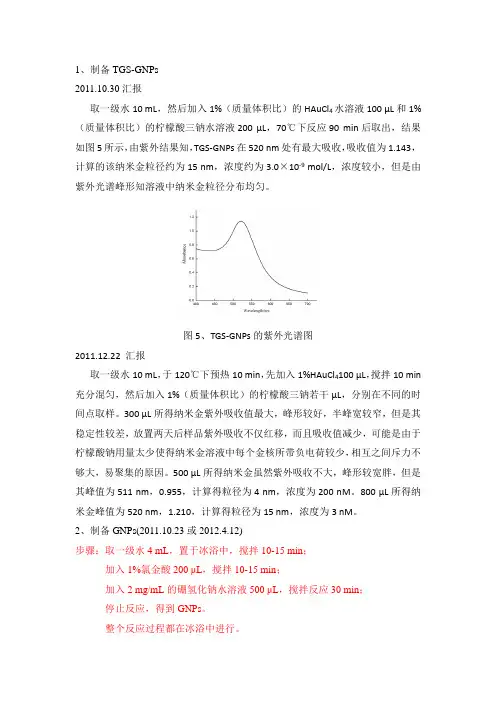
1、制备TGS-GNPs2011.10.30汇报取一级水10 mL,然后加入1%(质量体积比)的HAuCl4水溶液100 μL和1%(质量体积比)的柠檬酸三钠水溶液200 μL,70℃下反应90 min后取出,结果如图5所示,由紫外结果知,TGS-GNPs在520 nm处有最大吸收,吸收值为1.143,计算的该纳米金粒径约为15 nm,浓度约为3.0×10-9 mol/L,浓度较小,但是由紫外光谱峰形知溶液中纳米金粒径分布均匀。
图5、TGS-GNPs的紫外光谱图2011.12.22 汇报取一级水10 mL,于120℃下预热10 min,先加入1%HAuCl4100 μL,搅拌10 min 充分混匀,然后加入1%(质量体积比)的柠檬酸三钠若干μL,分别在不同的时间点取样。
300 μL所得纳米金紫外吸收值最大,峰形较好,半峰宽较窄,但是其稳定性较差,放置两天后样品紫外吸收不仅红移,而且吸收值减少,可能是由于柠檬酸钠用量太少使得纳米金溶液中每个金核所带负电荷较少,相互之间斥力不够大,易聚集的原因。
500 μL所得纳米金虽然紫外吸收不大,峰形较宽胖,但是其峰值为511 nm,0.955,计算得粒径为4 nm,浓度为200 nM。
800 μL所得纳米金峰值为520 nm,1.210,计算得粒径为15 nm,浓度为3 nM。
2、制备GNPs(2011.10.23或2012.4.12)步骤:取一级水4 mL,置于冰浴中,搅拌10-15 min;加入1%氯金酸200 μL,搅拌10-15 min;加入2 mg/mL的硼氢化钠水溶液500 μL,搅拌反应30 min;停止反应,得到GNPs。
整个反应过程都在冰浴中进行。
结果:样品的紫外吸收值为505-515 nm,2.5-3.0。
2011.10.23的实验、2011.10.30汇报冰浴条件下,在4 mL一级水中加入1%(质量体积比)的HAuCl4水溶液200 μL,然后缓慢搅拌下加入还原剂NaBH4 500 μL(2 mg/mL),冰浴反应30 min后取出,结果如图4所示,GNPs在510 nm处有最大吸收,吸收值为2.225,通过计算得知,该纳米金的粒径约为4 nm,浓度约为6.0×10-7 mol/L,浓度较高,但是紫外峰形较宽,可能粒径分布较宽。


金纳米颗粒的尺寸与紫外吸收峰的关系金纳米颗粒是一种具有广泛应用前景的纳米材料,其尺寸与紫外吸收峰之间存在着密切的关系。
本文将从金纳米颗粒的尺寸和紫外吸收峰的特性入手,探讨二者之间的关系。
我们需要了解金纳米颗粒的尺寸对其光学性质的影响。
金纳米颗粒的尺寸通常在1-100纳米之间,当其尺寸小于10纳米时,其表面会出现量子尺寸效应,导致其光学性质发生变化。
此时,金纳米颗粒的吸收峰会向蓝色方向移动,即吸收波长变短,同时吸收强度也会增强。
当金纳米颗粒的尺寸大于10纳米时,其光学性质则受到经典物理学的影响,吸收峰会向红色方向移动,即吸收波长变长,同时吸收强度也会减弱。
我们需要了解金纳米颗粒的尺寸与紫外吸收峰之间的关系。
实验表明,金纳米颗粒的尺寸越小,其紫外吸收峰就越靠近短波长端,即吸收波长越短。
这是因为当金纳米颗粒的尺寸小于10纳米时,其表面会出现量子尺寸效应,导致其电子结构发生变化,从而影响其吸收峰的位置。
此外,金纳米颗粒的尺寸还会影响其吸收强度,通常情况下,金纳米颗粒的吸收强度随着尺寸的减小而增强。
我们需要了解金纳米颗粒的尺寸与紫外吸收峰的应用。
金纳米颗粒的尺寸与紫外吸收峰的关系可以用于制备具有特定光学性质的金纳米颗粒。
例如,通过控制金纳米颗粒的尺寸,可以制备出具有特定吸收波长的金纳米颗粒,从而实现对特定波长的光的选择性吸收。
此外,金纳米颗粒的尺寸与紫外吸收峰的关系还可以用于制备具有特定表面等离子体共振(SPR)特性的金纳米颗粒,从而实现对特定分子的检测和识别。
金纳米颗粒的尺寸与紫外吸收峰之间存在着密切的关系,这种关系不仅对金纳米颗粒的光学性质具有重要影响,还可以用于制备具有特定光学性质的金纳米颗粒,具有广泛的应用前景。
纳米金的产品介绍和应用(Gold...纳米金的产品介绍和应用(Gold Nanoparticles Overview and Application)Gold Nanoparticles纳米金是一种以氯金酸(HAuC14)为主要材料,通过还原来制备成的胶体金(colloidalgold),它通常是一种金颗粒的悬浮液,其粒径为1-100nm不等,颜色呈紫红色。
该产品可被应用于诊断探针、免疫印迹、治疗药物、药物传送等等。
胶体金颗粒也是Gold Nanoparticles纳米金颗粒的结构,实际上是由一个金(Au)做为核心,其Au核心的外围包裹的内外二层离子层,内层离子层带负离子auc12,其作用是紧紧链接金核(Au),外层离子层带正离子H,其作用是均匀的分散在胶体间的溶液中,以维持稳定的悬浮状态。
Gold Nanoparticles纳米金颗粒的性状一般小于30纳米的都会呈现是规律的圆球形状,如果大于30纳米的胶体金(Gold Nanoparticles)一般是呈现的椭圆状的。
颜色上来讲也有比较细微的划分,一般是2-5nm间的会呈现橙黄色,8nm-25nm的会呈现酒红色,30nm-100nm的是呈现紫红色。
光吸收性胶体金在可见光范围内有一单一光吸收峰,这个光吸收峰的波长(λmax)在510~550nm范围内,随胶体金颗粒大小而变化,大颗粒胶体金的λmax偏向长波长,反之,小颗粒胶体金的λmax 则偏于短波长。
以下列表是纳米金粒子的大小,个数和SPR波长列表:Particle Size (nm) Particle Conc. (Particles/mL) SPR Wavelength (nm) (mg/mL) 2nm 1.5x10E14 Not measured 0.1mg/ml3nm 1.5x10E14 512~515 0.1mg/ml5nm 5.0x10E13 515~520 0.1mg/ml10nm 5.7x10E12 515~520 0.1mg/ml15nm 1.4x10E12 517~522 0.1mg/ml20nm 7.0x10E11 525 0.1mg/ml30nm 2.0x10E11 527 0.1mg/ml40nm 9.0x10E10 530 0.1mg/ml50nm 4.5x10E10 535 0.1mg/ml60nm 3.1x10E10 540 0.1mg/ml80nm 2.6x10E10 553 0.1mg/ml100nm 1.1x10E11 572 0.1mg/ml纳米金颗粒Gold Nanoparticles应用包括有:1:纳米金应用于毛细管电泳检测尿液中8-OHdG2:纳米金应用于蛋白质纤维染色的研究3:纳米金应用于肺癌靶向诊疗的研究进展4:纳米金应用于肿瘤诊疗的研究进展5:纳米金颗粒在仿生工程中的应用6:纳米金生物探针及其应用7:纳米金在生物标记分析中的应用进展8:纳米金在光学和电化学传感器中的应用西安瑞禧生物是国内知名的纳米产品试剂供应商,我公司提供各种不同的金纳米系列产品、银纳米系列产品、磁性纳米颗粒系列产品、聚苯乙烯微球系列产品、金纳米棒系列产品、功能性琼脂糖珠产品、和荧光量子点系列产品。
金纳米颗粒的拉曼特征峰
金纳米颗粒在拉曼光谱中显示出许多特征峰,这些峰对应于不同的振动模式和化学键的特征。
以下是一些常见的金纳米颗粒的拉曼特征峰:
1.悬浮模式(Suspension Mode):
o悬浮模式的特征峰在500-800 cm^-1范围内,主要是Au-Au振动模式。
2.嵌入模式(Embedded Mode):
o嵌入模式的特征峰在200-400 cm^-1范围内,主要是Au-S振动模式。
3.金金属四面体模式(Gold Metal Tetrahedral Mode):
o金金属四面体模式的特征峰在400-600 cm^-1范围内,主要是Au-Au振动模式。
4.表面等离激元共振模式(Surface Plasmon Resonance
Mode):
o表面等离激元共振模式的特征峰通常在500-700 cm^-1范围内,对应于金纳米颗粒的表面等离激元共振特
性。
需要注意的是,金纳米颗粒的大小、形状、表面修饰和相互之间的距离等因素都会影响拉曼光谱中的特征峰位置和相对强度。
因此,具体的拉曼光谱特征会因样品的不同而有所变化。
此外,其他配体或分子的存在也在拉曼光谱中显示出额外的特征峰。
因此,对于特定的金纳米颗粒样品,最好进行实际的实验测量以确定特征峰的位置和强度。
检测标记用的纳米金尺寸越小越好吗
2016-06-14 12:31来源:内江洛伯尔材料科技有限公司作者:研发部
因优化信号选择金粒子的大小
纳米金因其良好的生物适应性和独特的光学性能被广泛用于生物标记检测,大量的研究表明,只有尺寸均一的球形金纳米粒子才有最佳的标记效果。
是否纳米粒子尺寸越小,标记效果越好呢?
不是。
标记检测信号是由金颗粒聚集于测试线或控制线而出现的信号。
这些粒子必须足够大到能被看见,粒子的尺寸越大,这些粒子聚集后就越容易被看见。
例如1nm直径的粒子,无论其聚集数量多少几乎都是不可能被看见的,因为1nm的粒子没有更大粒子所具有的亮红色。
只有直径达到20nm的粒子才会出现可见的信号。
随着粒子尺寸的增大,位阻现象又成了一个问题。
例如,如果IgG(160,000道尔顿)分子仅仅8nm长,大约4nm从金颗粒表面伸展开,那么,100nm的粒子将会使这些小的表面分子显得更小而很难与特异性的蛋白相互作用。
此外,这些粒子的尺寸越大,它们在既定体积溶液中存在的数量越小。
这种可见度的需要与位阻现象之间的矛盾现象表明,对于大多数的免疫检测应用而言,最适的粒子大小是40nm.在某些情况下当位阻现象成为较大问题时(如针对较小的抗原),20nm的粒子则更为合适;当希望出现更深颜色或当分子表面较低的曲率提高了抗原抗体分子间的交互作用,较大一点的粒子则更为可取。
应该由实验决定确定多少颗粒大小能带来高灵敏度、浅背景色和高稳定性。
金纳米粒子的紫外吸收峰好嘞,今天咱们聊聊金纳米粒子的紫外吸收峰。
听起来是不是有点高大上?其实就是一个小小的金粒子,能在紫外线下展现出奇妙的特性。
想象一下,咱们生活中的一些金饰,那些闪闪发光的金色,不就是让人心情愉悦的象征吗?而金纳米粒子可是把这份魅力放大了好几倍,特别是在科学的舞台上。
先说说这金纳米粒子,听起来像是什么外星科技,其实就是把金属金切割得特别特别小,小到只有几纳米那么大。
像小小的沙粒,肉眼根本看不见。
可是,它们的光学特性可就不简单了,遇到紫外光的时候,简直像个小明星,闪耀得让人目不暇接。
嘿,想象一下,紫外光照射在这些金粒子上,它们可不是什么老实的孩子,瞬间就吸收了光线,发出特别的光彩,真的是让人眼前一亮。
然后,咱们来聊聊吸收峰这个事儿。
这个词听上去有点儿复杂,实际上就是金纳米粒子在紫外光照射下表现出来的一种特定吸收行为。
就好比说,咱们听歌时有些旋律总是特别动人,一听就让人心潮澎湃。
金纳米粒子在紫外光下的吸收峰也是如此,找到了它们最爱的“旋律”,产生了强烈的吸收。
这样一来,科学家们可以通过这些吸收峰来研究金粒子的特性,甚至用它们来开发新技术。
说到这里,有没有觉得金纳米粒子像个小魔法师,能把光变得如此有趣?这些粒子在医学上也是有用武之地的。
想象一下,科学家们用它们来做靶向药物传递,能够精准地将药物送到需要的地方,减少副作用,真是科技改变生活啊!就像是给身体装上了一道“金盾”,让它更强大。
金纳米粒子的应用可不仅限于医学。
咱们在日常生活中见到的太阳能电池,金纳米粒子也是一员大将,帮助提高能量转化效率。
想想看,如果能把太阳的光线变成电,咱们的生活岂不是更方便?未来的日子里,金纳米粒子可能会在更多的领域发光发热,真是让人期待不已。
说到紫外吸收峰,咱们也不得不提一下测量这些特性的仪器。
像显微镜、光谱仪什么的,都是一把好手。
就好比一位好侦探,能把这些金粒子的秘密一点点挖掘出来。
通过这些工具,研究者们可以观察到金纳米粒子在不同波长下的表现,真是让人拍案叫绝!哎,我总觉得金纳米粒子像是个调皮的孩子,总是让人惊喜不断。
化合物结构鉴定紫外-可见光谱分析作业1.说明纳米Ru、Rh、Ir 等十种纳米材料的紫外可见光谱(附图)2.说明马尾紫、孔雀绿、多氯代酚、苏丹、peo-ppo-peo、pvp等十种有机物或聚合物的紫外可见光谱(附图)解答如下:1(1)、纳米ZnS的紫外-可见光谱分析紫外吸收光谱表征:紫外-可见吸收光谱可观察能级结构的变化,通过吸收峰位置变化可以考察能级的变化。
由图5可知,硫化锌在200~340 nm波长范围内对紫外光有较强的吸收。
1(2)、NiFeAu纳米材料的紫外-可见光谱分析紫外吸收光谱表征:上图比较了相关纳米粒子的紫外-可见吸收光谱.图b是NiFeAu纳米粒子分散在正己烷中的紫外-可见吸收光谱可以看出NiFeAu纳米粒子在约557nm有一个较宽的吸收峰.对比用同样方法合成的NiFe图a在所测试的范围内无特征的吸收峰可以判断多功能性NiFeAu纳米粒子具有源于Au表面等离子共振吸收的光学性质.与用同样方法合成的纳米Au粒径8nm在可见光区526nm有强的吸收峰相比图c NiFeAu纳米粒子的吸收峰形明显变宽并出现红移该观察说明除了粒径大小变化的因素Fe和Ni的存在影响了Au的表面等离子共振吸收也间接证明了NiFeAu纳米复合粒子的生成.Au的特征吸收峰的峰形和强度不同原因在于纳米粒子的组成发生了变化.根据纳米颗粒光学响应模型Mie理论表面等离子共振吸收是由入射光频率和金属纳米颗粒中的自由电子的集体发生共振时产生的而表面等离子共振吸收的共振条件对纳米颗粒周围的环境十分敏感纳米粒子的组成结构尺寸形状电解质或者粒子间的相互作用力不同特征吸收峰的强度和形状都会受到影响而不一样.1(3)、TiO纳米材料的紫外-可见光谱分析2紫外吸收光谱表征:水悬浮液的 UV-vis 吸收和透射光谱。
由图上图是0.05% 金红石纳米Tio2在紫外光范围内都可见, 即使在很低的浓度下( 0.05% ) , 金红石型纳米Tio2有很强的吸收性能, 其最高吸收峰达到2.0以上, 对应的紫外光透过率接近0。
Supporting Information‘Determination of Size and Concentration of Gold Nanoparticles from UV/vis Spectra’Wolfgang Haiss*1,2, Nguyen T. K. Thanh1,2, Jenny Aveyard1 and David G. Fernig2Centre for Nanoscale Science,1Department of Chemistry, University of Liverpool, Crown Street L69 7ZD, U.K2School of Biological Sciences, University of Liverpool, Crown Street L69 7ZB, U.KTable of Content1. Tabular material for the determination of the size of uncoated spherical gold nanoparticles in water from UV/vis spectra.2. Tabular Material for the determination of the concentration of uncoated spherical gold nanoparticles in water from UV/vis spectra.3. The FORTRAN 77 program ‘mie-mfp.f’ which was used to calculate Q ext(λ,d).1. Tabular material for the determination of the size of uncoated spherical gold nanoparticles in water from UV/vis spectra.The values in Tables S-1 and S-2 can be used to calculate the size of GNPs form UV/vis spectra. For particles having a diameter larger than 35 nm Table S-1 and Table S-2 can be used to determine the particle diameter d. For smaller particles the absorbance ratio of Table S-2 can be used but it should be noted that particle sizes can be obtained from Equation 12 with slightly improved precision if the initial gold concentration is known. For particle diameters smaller than 10 nm the values in Table S-2 should only be considered as an estimate since surface effects may get increasingly important in this size region.λspr/ nm d / nm λspr / nm d / nm λspr / nm d / nm 525.0 32 534.9 58 552.1 84 525.6 34 535.9 60 553.8 86 526.2 36 536.9 62 555.7 88 526.8 38 538.0 64 557.6 90 527.5 40 539.2 66 559.6 92 528.2 42 540.4 68 561.7 94 528.9 44 541.6 70 563.9 96 529.6 46 542.9 72 566.2 98 530.4 48 544.3 74 568.6 100 531.2 50 545.7 76 571.1 102 532.1 52 547.2 78 573.7 104 533.0 54 548.8 80 576.5 106 533.9 56 550.4 82 579.3 108Table S-1: Position of the surface plasmon resonance peak in dependence of the particle diameter calculated from Equation 10.A spr/A450 d / nm A spr/A450 d / nm A spr/A450 d / nm1.10 3 1.56 12 1.96 401.19 4 1.61 142.00 451.27 5 1.65 162.03 501.33 6 1.69 182.07 551.387 1.73 202.10 601.428 1.80 252.12 651.469 1.86 302.15 701.5010 1.92 352.17 75Table S-2: Ratio of the absorbance of GNPs at the surface plasma resonance peak (A spr) to the absorbance at 450 nm (A450) in dependence the particle diameter calculated from Equation 11 using the fit parameters to the experimental results.2. Tabular material for the determination the concentration of uncoated spherical gold nanoparticles in water from UV/vis spectra.The data of ε450(d ) in Table S-3 can be used to calculate the particle concentration c in mol per litre from the absorption A at 450 nm for a standard path length l of 1 cm according to:c = A 450/ε450The data have been experimentally verified in the d range from 5 – 100 nm (see Figure 8). For particle diameters smaller than 5 nm the values should only be considered as an estimate since surface effects may get increasingly important in this size region.d /nm ε450 / M -1cm -1 d / nm ε450 / M -1cm -1d / nm ε450 / M -1cm -12 4.25E+0535 3.21E+09 68 2.50E+103 1.49E+06 36 3.52E+09 69 2.61E+104 3.62E+06 37 3.84E+09 70 2.71E+105 7.20E+06 38 4.18E+09 71 2.82E+10 6 1.26E+07 39 4.54E+09 72 2.93E+10 7 2.03E+07 40 4.92E+09 73 3.05E+108 3.07E+07 41 5.32E+09 74 3.16E+10 9 4.43E+07 42 5.74E+09 75 3.28E+10 10 6.15E+07 43 6.18E+09 76 3.40E+10 11 8.27E+07 44 6.65E+09 77 3.52E+10 12 1.09E+08 45 7.13E+09 78 3.64E+10 13 1.39E+08 46 7.65E+09 79 3.77E+10 14 1.76E+08 47 8.18E+09 80 3.89E+10 15 2.18E+08 48 8.74E+09 81 4.02E+10 16 2.67E+08 49 9.32E+09 82 4.14E+10 17 3.24E+08 50 9.92E+09 83 4.27E+10 18 3.87E+08 51 1.06E+10 84 4.40E+10 19 4.60E+08 52 1.12E+10 85 4.53E+10 20 5.41E+08 53 1.19E+10 86 4.65E+10 21 6.31E+08 54 1.26E+10 87 4.78E+10 22 7.31E+08 55 1.33E+10 88 4.91E+10 23 8.42E+08 56 1.41E+10 89 5.04E+10 24 9.64E+08 57 1.48E+10 90 5.17E+10 25 1.10E+09 58 1.57E+10 91 5.30E+10 26 1.24E+09 59 1.65E+10 92 5.43E+10 27 1.40E+09 60 1.73E+10 93 5.56E+10 28 1.58E+09 61 1.82E+10 94 5.69E+10 29 1.76E+09 62 1.91E+10 95 5.82E+10 30 1.96E+09 63 2.00E+10 96 5.94E+10 31 2.18E+09 64 2.10E+10 97 6.07E+10 32 2.41E+09 65 2.19E+10 98 6.19E+10 33 2.66E+09 66 2.29E+10 99 6.31E+10 34 2.93E+0967 2.40E+10100 6.44E+10Table S-3: Molar decadic extinction coefficient (ε) at λ = 450 nm calculated from the fit (Equation 13) to the theoretical extinction efficiencies for gold nano particles in water with diameter d ranging from 2 to 100 nm.3. The FORTRAN 77 program ‘mie-mfp.f’ which was used to calculate Q ext(λ,d). PROGRAM MIE-MFPREAL A(1100), B(1100), C(1100)COMPLEX RFREL1,RFREL2CHARACTER*64 file_in, file_outC ***************************************************************C This program calculates the scattering efficiency (QSCA;col2),C the extinction efficiency (QEXT;col3) for a coated sphereC using Mie theory. The wavelength of the incident lightC is scanned between two values with a step-width.C The complex refractive index of the sphere as a functionC of the wavelength/nm in vacuum is read in from a separate file.C Linear interpolation is used to interpolate theseC experimentally determined data.C ***************************************************************C ***************************************************************C Input of parameters:WRITE(6,*) 'ENTER THE START WAVELENGT / NM:'READ(5,*) WAVEL1WRITE(6,*) 'ENTER END WAVELENGT / NM:'READ(5,*) WAVEL2WRITE(6,*) 'ENTER THE NUMBER OF VALUES TO BE CALCULATED:'READ(5,*) NUMVALWRITE(6,*) 'REFRACTIVE INDEX OF THE SURROUNDING MEDIUM:'READ(5,*) REFMEDWRITE(6,*) 'REAL PART REFRACTIVE INDEX OF THE COATING:'READ(5,*) REFRE2WRITE(6,*) 'IMMAG. PART OF THE REFR. INDEX OF THE COATING:'READ(5,*) REFIM2WRITE(6,*) 'SPHERE RADIUS / NM:'READ(5,*) RADCORWRITE(6,*) 'COATING RADIUS / NM:'READ(5,*) RADCOTWRITE(6,*) 'ENTER THE PLASMA FREQUENCY IN HZ/1E+14 (138. for Au):'READ(5,*) OMPWRITE(6,*) 'ENTER THE COLLISION FREQ. IN Hz/1E+14 (0.333 for Au):'READ(5,*) OM0WRITE(6,*) 'ENTER END FERMI VELOCITY IN cm/s (1.4E+8 for Au):'READ(5,*) FVWRITE(6,*) 'SPECIFY THE FILENAME OF THE CORE REFRACTIVE INDEX:'READ(5,'(A)') file_inWRITE(6,*) 'SPECIFY THE FILENAME OF THE OUTPUT FILE:'READ(5,'(A)') file_outC ***************************************************************pi=3.14159265TAU= (1/OM0)*1E-14FMPINF=FV*TAUC ***************************************************************C Output of parameters to file_out:OPEN(UNIT=11,FILE=file_out,STATUS='NEW')WRITE(11,*) 'WAV ','QSCA ','QEXT ','NSTOP 'C ***************************************************************C ***************************************************************C Data of REFRE1 (col2;B(K)) and REFIM1 (col3;C(K))are read fromC the input file into 1-dimensional arrays (A=WAVEL; B=n; C=k).C Note that the data-file must contain increasing values of theC wavelength in column 1 it also must contain a single number inC line 1, specifying the total Nr of Data lines.OPEN(UNIT=10,FILE=file_in,STATUS='OLD')READ(10,*) NDO 5 K=1,NREAD(10,*) A(K), B(K), C(K)5 CONTINUEC ***************************************************************C Calculating the wavelength step-width:DELTA = (WAVEL2 - WAVEL1)/(NUMVAL - 1)C Repeating the calculations:DO 100 I = 1,NUMVALWAVEL = WAVEL1 + (I-1)*DELTAC ***************************************************************C Linear interpolation of n and k from input file:IF(WAVEL.EQ.A(1)) THENK=1ELSEK=215 IF (A(K).LT.WAVEL) THENK=K+1GO TO 15END IFrn = B(K-1) + (WAVEL - A(K-1))/(A(K) - A(K-1))*(B(K) - B(K-1))rk = C(K-1) + (WAVEL - A(K-1))/(A(K) - A(K-1))*(C(K) - C(K-1))END IFC ***************************************************************CALL MFP (FV,WAVEL,RADCOR,OMP,OM0,rn,rk,rnr,rkr,OM0R)C This Subroutine corrects the bulk values of n and k for smallC particles taking into account the 'mean free path effect' onC the 'free' conduction electrons in the Drude model.REFRE1 = rnrREFIM1 = rkrTAUR=(1/OM0R)*1E-14FMPR=FV*TAURC Calculating relative size parameters for core (X) and coating (Y) X=2.*pi*RADCOR*REFMED/WAVELy=2.*pi*RADCOT*REFMED/WAVELC Calculating the complex relative refractive indices:RFREL1=CMPLX(REFRE1,REFIM1)/REFMEDRFREL2=CMPLX(REFRE2,REFIM2)/REFMEDCALL BHCOAT (X,Y,RFREL1,RFREL2,QEXT,QSCA,QBACK,NSTOP)C Recalibration of the scattering efficiencies QC with respect to RADCOR instead of RADCOTQEXT = QEXT*(RADCOT/RADCOR)*(RADCOT/RADCOR)QSCA = QSCA*(RADCOT/RADCOR)*(RADCOT/RADCOR)QBACK= QBACK*(RADCOT/RADCOR)*(RADCOT/RADCOR)WRITE (11,*) WAVEL,QSCA,QEXT,NSTOP100 CONTINUEWRITE(11,*) 'FMPINF: ',FMPINF ,'cm 'WRITE(11,*) 'FMPR: ',FMPR ,'cm 'WRITE(11,*) 'TAU: ',TAU ,'s 'WRITE(11,*) 'TAUR: ',TAUR ,'s 'WRITE(11,*) 'OMP: ',OMP ,'1E+14Hz 'WRITE(11,*) 'OM0: ',OM0 ,'1E+14Hz 'WRITE(11,*) 'FER-VEL: ',FV,'cm/s 'WRITE(11,*) 'REFMED: ',REFMEDWRITE(11,*) 'REFRE2: ',REFRE2WRITE(11,*) 'REFIM2: ',REFIM2WRITE(11,*) 'RADCOR: ',RADCORWRITE(11,*) 'RADCOT: ',RADCOTWRITE(11,*) 'FILEIN: ',file_inWRITE(11,*) 'FILEOUT: ',file_outSTOPENDSUBROUTINE BHCOAT (X,Y,RFREL1,RFREL2,QEXT,QSCA,QBACK,NSTOP)C *************************************************************** C The Subroutine BHCOAT was produced from the original FORTRANC code of Bohren and Huffman which can be found in the appendix C of their Book: Bohren, C. F.; Huffman, D. R.C Absorption and Scattering of Light by Small Particles;C Wiley Interscience: New York, 1983C *************************************************************** COMPLEX RFREL1,RFREL2,X1,X2,Y2,REFRELCOMPLEX D1X1,D0X1,D1X2,D0X2,D1Y2,D0Y2COMPLEX XI0Y,XI1Y,XIY,CHI0Y2,CHI1Y2,CHIY2,CHI0X2,CHI1X2,CHIX2COMPLEX CHIPX2,CHIPY2,ANCAP,BNCAP,DNBAR,GNBAR,AN,BN,CRACK,BRACK COMPLEX XBACK,AMESS1,AMESS2,AMESS3,AMESS4DEL=1.0E-8X1=RFREL1*XX2=RFREL2*XY2=RFREL2*YYSTOP = Y + 4.*Y**.3333 + 2.REFREL=RFREL2/RFREL1NSTOP = YSTOPD0X1=CCOS(X1)/CSIN(X1)D0X2=CCOS(X2)/CSIN(X2)D0Y2=CCOS(Y2)/CSIN(Y2)PSI0Y=COS(Y)PSI1Y=SIN(Y)CHI0Y=-SIN(Y)CHI1Y=COS(Y)XI0Y=CMPLX(PSI0Y,-CHI0Y)XI1Y=CMPLX(PSI1Y,-CHI1Y)CHI0Y2=-CSIN(Y2)CHI1Y2=CCOS(Y2)CHI0X2=-CSIN(X2)CHI1X2=CCOS(X2)QSCA=0.0QEXT=0.0XBACK=CMPLX(0.0,0.0)N=1IFLAG=0200 RN=NPSIY=(2.*RN-1.)*PSI1Y/Y-PSI0YCHIY=(2.*RN-1.)*CHI1Y/Y-CHI0YXIY=CMPLX(PSIY,-CHIY)D1Y2=1./(RN/Y2-D0Y2)-RN/Y2IF (IFLAG.EQ.1) GO TO 999D1X1=1./(RN/X1-D0X1)-RN/X1D1X2=1./(RN/X2-D0X2)-RN/X2CHIX2=(2.*RN-1.)*CHI1X2/X2-CHI0X2CHIY2=(2.*RN-1.)*CHI1Y2/Y2-CHI0Y2CHIPX2=CHI1X2-RN*CHIX2/X2CHIPY2=CHI1Y2-RN*CHIY2/Y2ANCAP=REFREL*D1X1-D1X2ANCAP=ANCAP/(REFREL*D1X1*CHIX2-CHIPX2)ANCAP=ANCAP/(CHIX2*D1X2-CHIPX2)BRACK=ANCAP*(CHIY2*D1Y2-CHIPY2)BNCAP=REFREL*D1X2-D1X1BNCAP=BNCAP/(REFREL*CHIPX2-D1X1*CHIX2)BNCAP=BNCAP/(CHIX2*D1X2-CHIPX2)CRACK=BNCAP*(CHIY2*D1Y2-CHIPY2)AMESS1=BRACK*CHIPY2AMESS2=BRACK*CHIY2AMESS3=CRACK*CHIPY2AMESS4=CRACK*CHIY2IF(CABS(AMESS1).GT.DEL*CABS(D1Y2)) GO TO 999IF(CABS(AMESS2).GT.DEL) GO TO 999IF(CABS(AMESS3).GT.DEL*CABS(D1Y2)) GO TO 999IF(CABS(AMESS4).GT.DEL) GO TO 999BRACK=CMPLX(0.0,0.0)CRACK=CMPLX(0.0,0.0)IFLAG=1999 DNBAR=D1Y2-BRACK*CHIPY2DNBAR=DNBAR/(1.-BRACK*CHIY2)GNBAR=D1Y2-CRACK*CHIPY2GNBAR=GNBAR/(1.-CRACK*CHIY2)AN=(DNBAR/RFREL2+RN/Y)*PSIY-PSI1YAN=AN/((DNBAR/RFREL2+RN/Y)*XIY-XI1Y)BN=(RFREL2*GNBAR+RN/Y)*PSIY-PSI1YBN=BN/((RFREL2*GNBAR+RN/Y)*XIY-XI1Y)QSCA=QSCA+(2.*RN+1.)*(CABS(AN)*CABS(AN)+CABS(BN)*CABS(BN))XBACK=XBACK+(2.*RN+1.)*(-1.)**N*(AN-BN)QEXT=QEXT+(2.*RN+1.)*(REAL(AN)+REAL(BN))PSI0Y=PSI1YPSI1Y=PSIYCHI0Y=CHI1YCHI1Y=CHIYXI1Y=CMPLX(PSI1Y,-CHI1Y)CHI0X2=CHI1X2CHI1X2=CHIX2CHI0Y2=CHI1Y2CHI1Y2=CHIY2D0X1=D1X1D0X2=D1X2D0Y2=D1Y2N=N+1IF(N-1-NSTOP) 200,300,300300 QSCA=(2./(Y*Y))*QSCAQEXT=(2./(Y*Y))*QEXTQBACK=XBACK*CONJG(XBACK)QBACK=(1./(Y*Y))*QBACKRETURNENDSUBROUTINE MFP (FV,WAVEL,RADCOR,OMP,OM0,rn,rk,rnr,rkr,OM0R)C *************************************************************** C This program corrects the bulk values of n and k for smallC particles taking into account the 'mean free path effect' onC the 'free' conduction electrons in the extended Drude model.C All calculations performed in cm-g-s units.C Plasma Frequency and collision frequency both internally devided C by 1E+14 to avoid overflowC *************************************************************** CL = 2.998E+10pi = 3.14159265C Calculate EPS1 and EPS2 from rn and rk:EPS1 = rn*rn - rk*rkEPS2 = 2.*rn*rkC Calculate OM and A1 and A2:OM = (2.*pi*CL/(WAVEL*1.E-7))/1.E+14A1 = 1.-(OMP*OMP/(OM*OM + OM0*OM0))A2 = OMP*OMP*OM0/(OM*(OM*OM + OM0*OM0))C Contribution of the bond electrons to n (B1) and k (B2):B1 = EPS1 - A1B2 = EPS2 - A2C Calculate R dependent OM0 (OM0R)OM0R = OM0 + (FV/(RADCOR*1.E-7))/1.E+14C Calculate R dependent contributions of the free electrons:A1R = 1.-(OMP*OMP/(OM*OM + OM0R*OM0R))A2R = OMP*OMP*OM0R/(OM*(OM*OM + OM0R*OM0R))C Calculate R dependent EPS (EPS1R and EPS2R)EPS1R = A1R + B1EPS2R = A2R + B2C Reconvert EPS1R and EPS2R back to n and k:rnr = SQRT((A1R + B1)/2. + SQRT((A1R/2.+B1/2.)*(A1R/2.+B1/2.)_+(A2R/2.+B2/2.)*(A2R/2.+B2/2.)))rkr = SQRT(-(A1R + B1)/2. + SQRT((A1R/2.+B1/2.)*(A1R/2.+B1/2.)_+(A2R/2.+B2/2.)*(A2R/2.+B2/2.)))C WRITE(6,*) 'rn= ',rnC WRITE(6,*) 'rnr= ',rnrC WRITE(6,*) 'OM0= ',OM0C WRITE(6,*) 'OM0R= ',OM0RC WRITE(6,*) 'OM= ',OMEND。