回归理想气体定压热容计算公式
- 格式:pdf
- 大小:194.39 KB
- 文档页数:5

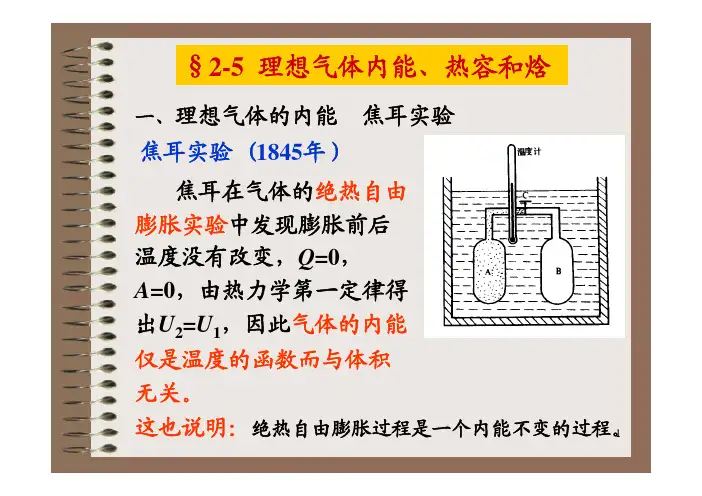



第一章热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律 热力学第一定律:ΔU =Q +W 。
三、基本关系式1、体积功的计算 δW = -p 外d V恒外压过程:W = -p 外ΔV定温可逆过程(理想气体):W =nRT 1221ln ln p p nRT V V = 2、热效应、焓:等容热:Q V =ΔU (封闭系统不作其他功)等压热:Q p =ΔH (封闭系统不作其他功)焓的定义:H =U +pV ; ΔH =ΔU +Δ(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容:热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂= 定压热容与定容热容的关系:nR C C =-V p热容与温度的关系:C p ,m =a +bT +cT 2四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p 外d V等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d pC V (㏑T 2-㏑T 1)=nR(㏑V 1-㏑V 2)(T 与V 的关系)C p (㏑T 2-㏑T 1)=nR(㏑P 2-㏑P 1) (T 与P 的关系)不可逆绝热过程:Q =0 ;利用C V (T 2-T 1)=-p 外(V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化 可逆相变化:ΔH =Q =n ΔH ; W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、实际气体节流膨胀:焦耳-汤姆逊系数:μJ-T (理想气体在定焓过程中温度不变,故其值为0;其为正值,则随p 降低气体T 降低;反之亦然)4、热化学标准摩尔生成焓:在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热(各种稳定单质在任意温度下的生成焓值为0) 标准摩尔燃烧焓:…………,单位物质的量的某物质被氧完全氧化时的反应焓第二章 热力学第二定律一、基本概念 自发过程与非自发过程二、热力学第二定律热力学第二定律的数学表达式(克劳修斯不等式)T Q dS δ≥ “=”可逆;“>”不可逆三、熵(0k 时任何纯物质的完美结晶丧子为0)1、熵的导出:卡若循环与卡诺定理(页522、熵的定义:T Q dS r δ=3、熵的物理意义:系统混乱度的量度。

气体热能的计算公式
热力学是研究能量转化和热力转化的一门学科,其中涉及到热能的计
算公式有气体内能、气体的焓、气体的熵等计算公式。
1.气体内能的计算公式:
气体内能是气体分子在气体系统中的平均动能,它与气体的温度有关。
气体内能的计算公式为:
E=(3/2)*n*R*T
其中,E为气体的内能,n为气体分子的摩尔数,R为气体常量,T为
气体的温度。
这个公式适用于理想气体。
2.气体的焓的计算公式:
气体的焓是气体的内能和对流能量的总和。
它表示的是气体的热能与
机械能的总和。
气体的焓的计算公式为:
H=E+PV
其中,H为气体的焓,E为气体的内能,P为气体的压强,V为气体的
体积。
对于理想气体,由理想气体状态方程PV=nRT,可以将气体的焓的计
算公式简化为:
H=E+nRT
3.气体的熵的计算公式:
气体的熵是气体的混乱程度的度量,它表示了气体微观粒子间运动的无序性。
气体的熵的计算公式为:
S = nCp * ln(T2/T1) - nR * ln(V2/V1)
其中,S为气体的熵,n为气体分子的摩尔数,Cp为气体的定压比热容,T1、T2为气体的初始温度和终止温度,V1、V2为气体的初始体积和终止体积。
对于理想气体,定压比热容Cp是一个常数,等于定容比热容Cv加上气体常量R,即Cp=Cv+R。
因此,气体的熵的计算公式可以简化为:S = nCv * ln(T2/T1) + nR * ln(V2/V1)
以上就是关于气体热能的计算公式的介绍。
在应用这些公式时,需要注意所使用的气体性质和热力学参数。

1. 理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物 (1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AVy Am ,A式中∑AA n 为混合气体总的物质的量。
Am,*V表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3) V V p p n n y ///B B B B *===式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =4. 阿马加分体积定律V RT n V /B B =*此式只适用于理想气体。
1. 热力学第一定律的数学表示式W Q U +=∆或 'amb δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 焓的定义式3. 焓变(1) )(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。

理想气体的温度和热力学过程理想气体是热力学中的一个重要概念,它具有许多特殊性质和物理行为。
在研究理想气体时,温度和热力学过程是不可或缺的两个方面。
本文将从理想气体的温度概念入手,介绍理想气体的温度计算方法,并深入探讨理想气体在不同热力学过程中的性质和特征。
一、理想气体的温度概念理想气体的温度是衡量气体分子热运动程度的物理量。
根据理想气体状态方程PV=nRT(其中P为压力,V为体积,n为气体的物质量,R为气体常数,T为温度),我们可以得到理想气体的温度计算公式为T=PV/(nR)。
在理想气体中,温度与气体分子的平均动能直接相关。
根据气体动理论,理想气体的温度与气体分子的平均动能成正比。
因此,温度可以作为理想气体分子运动状态的指标,反映了气体内部分子的热运动情况。
二、理想气体的热力学过程理想气体在热力学过程中常常呈现出不同的性质和特征。
下面将介绍几种常见的热力学过程。
1. 等体过程(等容过程)等体过程是指理想气体在体积恒定的条件下发生的热力学过程。
在等体过程中,由于体积不变,所以做功为零,根据理想气体的内能变化公式ΔU=CvΔT(其中ΔU为内能变化量,Cv为定容热容量,ΔT为温度变化量),可以得知等体过程中内能变化与温度变化成正比。
2. 等压过程等压过程是指理想气体在压力恒定的条件下发生的热力学过程。
在等压过程中,气体对外界做功,而内能仅与温度变化有关。
根据理想气体的内能变化公式ΔU=CpΔT(其中ΔU为内能变化量,Cp为定压热容量,ΔT为温度变化量),可以得知等压过程中内能变化与温度变化成正比。
3. 等温过程等温过程是指理想气体在温度恒定的条件下发生的热力学过程。
在等温过程中,根据理想气体状态方程PV=nRT,可以得知等温过程中压力和体积呈反比。
由此可知,在等温过程中气体对外界做的功与体积变化成反比。
4. 绝热过程绝热过程是指理想气体在没有与外界发生热量交换的条件下发生的热力学过程。
在绝热过程中,气体内部没有热量的传递,所以内能不发生变化。

H z设采输技术doi:10.3969/j.issn,1001-2206.2021.02.006理想气体比热容计算公式的对比研究苑伟民1$杨文川#,廖天昊$+,—歌%1•国家管网集团北海液化天然气有限责任公司,广西北65360002•中国石油工程建设有限公司西南分公司,四川成都6100413•国家管网西南管道公司,四川成都6100944.重庆科技学院石油与天然气工程学院,重庆401331摘要:在化工计算中,比热容的计算占有极其重要的地位,广泛应用于传热、精o和化学反应中。
实际气体的比热容通常采用其理想气体比热容和实际气体与其理想气体比热容的偏差之和来计算,因理想气体热容的计算实际气体比热容计算的。
理想气体热容公分析发现:理想气体热容的计算公分为两大类,一类以”的,API技中的公一类有其的,ISO20765-1中的公于一T计算公,文的计算,用的计算,文献中给出的适用有差通理想气体热容两类计算公的,HYSYS、ISO20765-1、API技中公的计算和适用关键词:理想气体;热力学性质;预测;比热容;API;HYSYS;ISO20765-1Comparative study on equations of ideal gas specific heat capacityYUAN Weimin1,YANG Wenchuan2,LIAO Tianhao3,MA Yige41.PipeChina Beihai Liquefied Natural Gas Co.,Ltd.,Beihai536000,China2.China Petroleum Engineering&Construction Corp.Southwest Company,Chengdu610041,China3.PipeChina Southwest Pipeline Co.,Ltd.,Chengdu610094,China4.School of Petroleum Engineering,Chongqing University of Science and Technology,Chongqing401331,ChinaAbstract:In the calculation of chemical engineering,the calculation of specific heat capacity occupies an extremely important position and is widely used in heat transfer,distillation and chemical reactions.The specific heat capacity of the real gas is usually calculated by the sum of the ideal gas specific heat capacity and the deviation between the specific heat capacities of real gas and idea gas.Therefore, the calculation accuracy of the ideal gas specific heat capacity will determine the accuracy of the real gas specific heat capacity calculation.After investigation and analysis of the specific heat capacity formulas of the ideal gas,it is found that:(1)The calculation formulas of the specific heat capacity of the ideal gas are divided into two categories,one type is a polynomial with temperature as a variable,the typical representative is the formula in the API technical data manual;another type is a polynomial with a hyperbolic function or other functions,and the typical representative is the formula in ISO20765-1;(2)For the same calculation formula,the calculation coefficients of different documents are different,or even if the same calculation coefficients are applied,the application scope given in the literature also varies.Through the introduction of two typical formulas of the ideal gas specific heat capacity,the calculation accuracy and applicable scope of the formulas in the industry software HYSYS,ISO20765-1,and API technical data book are discussed. Keywords:ideal gas;thermal properties;prediction;specific heat capacity;API;HYSYS;ISO20765-1理想气体的比热容本身只是温度函数,但函数的形式目前在理论上尚无法求岀,一般均为根据实验数据归纳的经验公式,如国内外文献中对理想气体比热容的估算均采用由测试数据通过回归得到的多项式,形式有所差别。


第二章 热力学第一定律主要公式及使用条件1. 热力学第一定律的数学表示式W Q U +=∆或 'amb δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2.焓的定义式3. 焓变(1) )(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
(2) 2,m 1d p H nC T ∆=⎰ 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4.热力学能(又称内能)变 此式适用于理想气体单纯pVT 变化的一切过程。
5. 恒容热和恒压热V Q U =∆ (d 0,'0)V W ==p Q H =∆ (d 0,'0)p W ==6. 热容的定义式(1)定压热容和定容热容pV U H +=2,m 1d V U nC T ∆=⎰δ/d (/)p p p C Q T H T ==∂∂δ/d (/)V V V C Q T U T ==∂∂(2)摩尔定压热容和摩尔定容热容,m m /(/)p p p C C n H T ==∂∂,m m /(/)V V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3)质量定压热容(比定压热容)式中m 和M 分别为物质的质量和摩尔质量。
(4) ,m ,m p V C C R -=此式只适用于理想气体。
(5)摩尔定压热容与温度的关系23,m p C a bT cT dT =+++式中a , b , c 及d 对指定气体皆为常数。
(6)平均摩尔定压热容21,m ,m 21d /()Tp p T C T T T C =-⎰7. 摩尔蒸发焓与温度的关系21vap m 2vap m 1vap ,m ()()d T p T H T H T C T ∆=∆+∆⎰ 或 vap m vap ,m (/)p p H T C ∂∆∂=∆式中 vap ,m p C ∆ = ,m p C (g) —,m p C (l),上式适用于恒压蒸发过程。
1.理想气体状态方程式nRTRT M m pV ==)/(或RTn V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2.气体混合物(1)组成摩尔分数y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AVy A m,A 式中∑AA n 为混合气体总的物质的量。
Am,*V表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2)摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M 式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3) VV p p n n y ///B B B B *===式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3.道尔顿定律p B = y B p ,∑=BBp p 上式适用于任意气体。
对于理想气体VRT n p /B B =4.阿马加分体积定律VRT n V /B B =*此式只适用于理想气体。
1.热力学第一定律的数学表示式WQ U +=∆或'amb δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2.焓的定义式3.焓变(1))(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
第一章 化学热力学基础 公式总结 1.体积功 We = -Pe △V2.热力学第一定律的数学表达式 △U = Q + W 3.n mol 理想气体的定温膨胀过程。
定温可逆时:Wmax=-Wmin=4.焓定义式 H = U + PV在封闭体系中,W ′= 0,体系发生一定容过程 Qv = △U在封闭体系中,W ′= 0,体系发生一定压过程 Qp = H2 – H1 = △H5.摩尔热容 Cm ( J ·K —1·mol —1 ):定容热容 CV(适用条件 :封闭体系、无相变、无化学变化、 W ′=0 定容过程适用对象 : 任意的气体、液体、固体物质 )定压热容 Cp⎰=∆21,T T m p dTnC H (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 的定压过程适用对象 : 任意的气体、液体、固体物质 )单原子理想气体: Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体: Cv,m = 2。
5R , Cp,m = 3.5R 多原子理想气体: Cv,m = 3R , Cp ,m = 4RCp ,m = Cv ,m + R6。
理想气体热力学过程ΔU 、ΔH 、Q 、W 和ΔS 的总结7。
定义:△fHm θ(kJ ·mol —1)-- 标准摩尔生成焓△H —焓变; △rHm —反应的摩尔焓变 △rHm θ-298K 时反应的标准摩尔焓变;△fHm θ(B)—298K 时物质B 的标准摩尔生成焓; △cHm θ(B ) —298K 时物质B 的标准摩尔燃烧焓。
8.热效应的计算1221ln ln P PnRT V V nRT =nCC m =⎰=∆21,T T m V dTnC U由物质的标准摩尔生成焓计算反应的标准摩尔焓变 △rH θm = ∑νB △fH θm ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变 △rH θm = -∑νB △cH θm ,B 9.Kirchhoff (基尔霍夫) 方程△rHm (T2) = △rHm (T1) +如果 ΔCp 为常数,则 △rHm (T2) = △rHm (T1) + △Cp ( T2 - T1)10。
三原子摩尔定压热容-回复三原子摩尔定压热容是指在恒定压力下,物质1摩尔晶体或分子结构中的三个原子之间的运动自由度引起的热容变化。
在这篇文章中,我们将逐步回答关于三原子摩尔定压热容的问题,并阐述其在化学与物理领域的重要性。
首先,我们需要理解什么是热容。
热容是指物质在单位温度变化下吸收或释放的热量。
在恒定压力下,热容可以衡量物质在热力学过程中对温度变化的响应能力。
然后,我们来了解一下为什么三原子摩尔定压热容具有独特性质。
一个三原子分子结构,如二氧化碳(CO2),由一个碳原子和两个氧原子组成。
每个原子都可以在空间中自由运动,并且它们之间有限制的相互作用。
这些自由度的存在导致分子中的能量分布变得更加复杂,相对于双原子分子或单原子气体,三原子分子具有更高的熵(无序性)和更高的热容。
下一步,我们将介绍三原子摩尔定压热容的计算方法。
根据热力学理论,三原子分子结构的热容可以通过以下公式计算得到:Cv = 12.5R其中Cv是定容热容,R是理想气体常数(8.314 J/(mol·K))。
这个公式表明,三原子摩尔定容热容比双原子分子的热容大15倍。
因此,当我们考虑三原子分子的热容时,需要考虑到更多的能级和运动自由度。
接下来,我们将讨论一些实际应用中三原子摩尔定压热容的例子。
这个概念在化学工程中具有重要意义,特别是在燃烧和反应动力学的研究中。
例如,在火箭发动机的燃烧过程中,燃烧产物中的多原子分子的热容对推进剂的燃烧效率和输出能量有直接影响。
了解和精确估计三原子分子的热容对于优化火箭设计和燃烧控制非常重要。
此外,三原子摩尔定压热容也在材料科学和热力学领域发挥重要作用。
例如,在研究具有三原子分子结构的晶体或固体材料的热力学性质时,我们需要考虑热容的变化。
这对于确定材料的热传导性、稳定性和热膨胀系数等参数至关重要。
最后,我们需要提及一点,尽管三原子摩尔定压热容是一个重要的研究领域,但它也有一些局限性。
这个模型假设了理想的三原子分子结构,并没有考虑到分子之间的相互作用、非理想条件和动力学效应。