高三化学原子晶体针对性训练
- 格式:doc
- 大小:36.00 KB
- 文档页数:3

共价键 原子晶体 每课一练(苏教版选修3)夯基达标1下列分子的电子式书写正确的是( )解析:A 项中正确写法为,B 项应为,C 项应为,只有D 项为正确选项。
答案:D2下列说法中正确的是( )A 分子中键能越大,键越长,则分子越稳定B 失电子难的原子获得电子的能力一定强C 在化学反应中,该元素由化合态变为游离态,使元素被还原D 电子层结构相同的不同离子,其半径随核电荷数增多而减小解析:A 在分子中键能越大,键长应越短,分子才越稳定;B :He 难失电子也难得电子;C :化学反应中,某元素由化合态变为游离态,可能被氧化也可能被还原,如S 2-S (被氧化),Cu 2Cu (被还原)。
答案:D3下列物质的熔沸点高低顺序正确的是( )A 金刚石>晶体硅>二氧化硅>碳化硅 >CBr 4>CC 4>CH 4 >H 2O >O 2>N 2 D 金刚石>生铁>钝铁>钠解析:A 项中同属原子晶体,而熔沸点高低主要看共价键强弱;显然对键能而言,晶体硅<碳化硅;B 选项同为组成结构相似的物质,熔沸点高低看相对分子质量的大小;C 项,不同晶体型熔沸点一般为:原子晶体>离子晶体>分子晶体;D 项,生铁为合金,熔点低于纯铁。
答案:BC4下列化合物中,含有离子键和非极性共价键的是( ) 2 C 解析:此题要理解离子键和非极性共价键的形成元素,离子键的形成元素是活泼金属元素和活泼非金属元素。
非极性键的形成是同种非金属元素之间。
答案:B5下列物质在溶于水和熔化时,破坏的作用力完全相同的是( ) A 干冰 D 冰醋酸 解析:物质的晶体在水中溶解时,某些离子键和共价键被水分子作用断开,生成相应的离子,而晶体在熔化时,只有原子晶体内的共价键可以被破坏,存在于离子晶体、分子晶体内的共价键不能破坏,如NaHSO 4在水中电离出Na 、H 、-24SO ,而在熔化时电离出Na 和-4HSO 。
答案:B—O 之间的键长、键能的数据为:其中、的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w >>>。

分子晶体针对性训练一、选择题1. 下列物质在变化过程中,只需克服分子间作用力的是A.食盐溶解B.铁的熔化C. 干冰升华D.氯化铵的“升华”( )2. 下列化学式能真实表示物质分子组成的是( )A.NaOHB.S0 3C.CsClD.NaCl3. 最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是 ( )A.C 60 是一种新型的化合物B.C 60 和石墨都是碳的同素异形体C.C 60 中虽然没有离子键,但固体为离子晶体D.C 60 相对分子质量为 7204. 当 S03晶体熔化或气化时,下述各项中发生变化的是(A.分子内化学键B.分子间距离C. 分子构型D.分子间作用力5.IA 族元素的原子与最外层有7 个电子的原子结合,可以形成)( )A.离子晶体B.分子晶体C.离子晶体,分子晶体都不可能形成D.无法确定6.支持固态氨是分子晶体的事实是A.氮原子不能形成阳离子B.铵离子不能单独存在C.常温下,氨是气态物质D.氨极易溶于水7. 下列有关共价化合物的说法:①具有较低的熔、沸点②不是电解质体④都是由分子构成⑤液态时不导电,其中一定正确的是A.①③④B.②⑤C. ①②③④⑤D.⑤③固态时是分子晶8.下列分子晶体:①HCl② HBr③ HI ④ CO ⑤ N2 ⑥ H2熔沸点由高到低的顺序是( )A.①②③④⑤⑥B.③②①⑤④⑥C. ③②①④⑤⑥D,⑥⑤④③②①9. 下列性质适合于分子晶体的是( )A.熔点 1 070 ℃,易溶于水,水溶液导电B.熔点 10.31 ℃,液态不导电、水溶液能导电C.能溶于 CS2、熔点 112.8 ℃,沸点 444.6 ℃D. 熔点 97.81 ℃,质软、导电、密度3 0.97 g / cm二、填空题10.有两组关于物质熔点的数据分析以上数据,回答:I 组物质NaCl KCl RbCl CsCl熔点II组物质SiCl 4GeCl4SnCl4PbCl4熔点(1)有什么规律可循 ______________________________________(2)造成这些规律的主要原因是__________________________________________11.已知白磷是由 P4分子形成的分子晶体,每个 P4分子是正四面体结构。
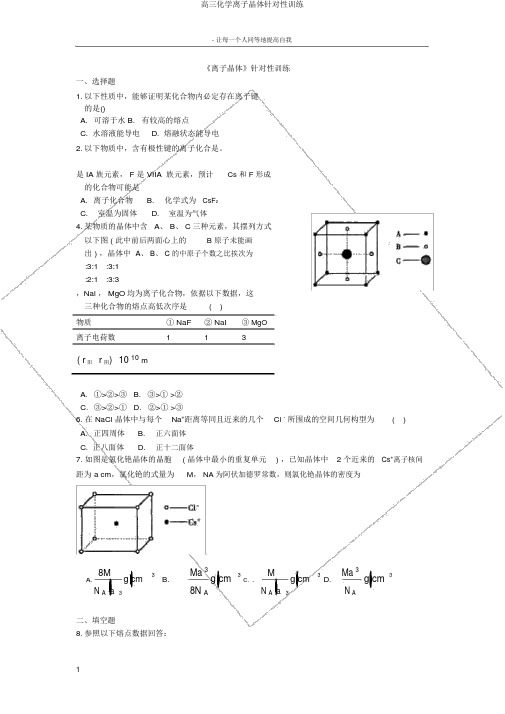
《离子晶体》针对性训练一、选择题1.以下性质中,能够证明某化合物内必定存在离子键的是()A.可溶于水B. 有较高的熔点C. 水溶液能导电D. 熔融状态能导电2.以下物质中,含有极性键的离子化合是。
是 IA 族元素, F 是 VIIA 族元素,预计Cs 和 F 形成的化合物可能是A.离子化合物B.化学式为CsF2C. 室温为固体D.室温为气体4.某物质的晶体中含 A、 B、 C三种元素,其摆列方式以下图 ( 此中前后两面心上的 B 原子未能画出 ) ,晶体中A、 B、 C 的中原子个数之比挨次为:3:1 :3:1:2:1 :3:3,Nal , MgO均为离子化合物,依据以下数据,这三种化合物的熔点高低次序是( )物质① NaF② NaI③ MgO离子电荷数113( r阳r阴)10 10mA.①>②>③B. ③>① >②C.③>②>①D. ②>① >③6. 在 NaCl 晶体中与每个Na+距离等同且近来的几个Cl -所围成的空间几何构型为( )A.正四周体B.正六面体C. 正八面体D.正十二面体7. 如图是氯化铯晶体的晶胞( 晶体中最小的重复单元) ,已知晶体中 2 个近来的Cs+离子核间距为 a cm,氯化铯的式量为M, NA为阿伏加德罗常数,则氯化铯晶体的密度为8Mg cm3 B.Ma 3g cm3M g cm3D.Ma 3g cm3A.38N AC. .3N AN A a N A a二、填空题8.参照以下熔点数据回答:物质NaF NaCl NaBr NaI熔点℃995801755651物质NaCl KCl RbCl CsCl熔点℃801776715646钠的卤化物从 NaF到 NaI 及碱金属的氯化物从NaCl 到 CsCl 的熔点渐渐 ____________这与__________相关。
随 __________增大 __________减小,故熔点 __________ 渐渐。

2013届高考化学专题3 第三单元共价键原子晶体知能演练轻松闯关苏教版选修31.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( ) A.①③②B.②③①C.③①②D.②①③解析:选A。
由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点由微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近似地看作是成键原子的半径之和,由于硅的原子半径大于碳原子,所以键的强弱顺序为C—C>C—Si>Si—Si,熔点由高到低的顺序为金刚石>碳化硅>晶体硅。
2.H2S分子中两个共价键的夹角接近90°,不.能用来解释的是( )A.共价键的饱和性B.H2S分子中S存在孤对电子C.共价键的方向性D.S原子中p轨道的形状解析:选A。
S原子的价电子构型是3s23p4,有2个未成对电子,并且分布在相互垂直的3p x 和3p y轨道中,当与2个H原子配对成键时,形成的两个共价键间夹角应接近90°,这体现了共价键的方向性是由轨道的伸展方向决定的。
3.COCl2分子的结构式为,COCl2分子内含有( )A.4个σ键B.2个σ键、2个π键C.2个σ键、1个π键D.3个σ键、1个π键解析:选D。
C和Cl之间为σ键,C和O之间为一个σ键、一个π键。
4.已知N2(g)+O2(g)2NO(g)为吸热反应,ΔH=180 kJ·mol-1,其中N≡N键、O O键的键能分别为946 kJ·mol-1、498 kJ·mol-1,则N—O键的键能为( )A.1264 kJ·mol-1B.632 kJ·mol-1C.316 kJ·mol-1D.1624 kJ·mol-1解析:选B。
180 kJ·mol-1=946 kJ·mol-1+498 k J·mol-1-2E N—O,所以E N—O=632 kJ·mol -1。

高三化学原子结构针对性训练一、基本概念针对性训练[知识点1]原子结构(中子数、质子数、电子数、质量数)1.质量数为37 的原子,应该有()A.18质子,19中子,19电子B.18质子,20个中子,18个电子C.19个质子,18个中子,20个电子D.18个质子,19个中于,18个电子2.原计划实现全球卫星通讯需发射77颗卫星,这与铱(h)元素的原子核外电子数恰相等,因此称为“铱星计划”。
已知铱的一种同位素是19177Ir,则其核内的中子数是()A.77 B.114 C.191 D.2683.1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说。
原子293118X的中子数与电子数之差为()A.0 B.57 C.118 D.1754.136C—NMB(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子()A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子C.质量数为13,原子序数为6,核内有7个质子D.质量数为13,原子序数为6,核内有7个中子5.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该新元素的下列叙述正确的是()A.其原子核内中子数和质子数都是112B.其原子核内中子数为165,核外电子数为112C.其原子质量是12C原子质量的277倍D.其原子质量与12C原子质量之比277∶12[知识点2]核外电子排布6.氢原子的电子云图中,离原子核较近的区域小黑点较密它表示()A.该区域电子较多B.该区域电子出现的机会较大C.电子只有该区域运动速度快D.电子在该区域运动速度快,7..和氖原子电子层结构相同的微粒是()A.Na+B.C1-C.D.Ar8.下列元素中,原子的次外层电子数等于其它各层电子数之和的是()A.Mg B.S C.O D.Ar9.某原子核外M层有3个电子,那么其L层()A.2 B.8 C.18 D.3210.某元素原子的最外层电子数是次外层的a倍(a>1的整数),则该原子核内的质子数是()A.2a B.a+2 C.2a+10 D.2a+211.若a A m+与b B n-核外电子排列相同,下列关系正确的是()A.b =a-n+m B.b=a-n-m C.a=b+n+m D.a=b+n-m二、学科内综合训练12.某电子层n,当它为最外电子层时,容纳的最多电子数与n-1层相同,当它为次外电子层时,其电子数比n+1层最多能多10个,则此电子层应是()A.K层B.L层C.M层D.N层13.化学变化中,组成原子的粒子,可能发生改变的是()A.核外电子数 B.中子数C.质子数D.原子数14.1996年2月9日欧洲一科学小组,由6630Zn和20882Pb两原子经核聚合并,放出一定数目的中子而制得227112X原子,则两原子在核聚合过程中放出的中子数目是()A.47 B.115 C.142 D.16215.核内中子数为N的R2+离子,质量数为A,则n克它的氧化物中所含质子的物质的量是()A.n/(A+16)×(A-N+8)mol B.n/(A+16)×(A-N+10)molC.(A-N+2)mol D.n/A×(A-N+6)mol16.在离子化合物AB中,A离子和B离子的电子层结构不同,从原子的最外层电子数看A比B少4,而次层电子数A比B多6,则AB是()A.MgS B.KCl C.MgO D.CaO17.某元素的单质为双原子分子,其质量数分别为2n-2,2n,2n+2三种,当n为整数时,以下各值中,肯定不是该元素原子的质量数的是()A.n-2 B.n-1 C.n D.n+l18.今有A.B两种原子,A原子的M层比B原子的M层少三个电子,B原子的L层电子数恰为A原子L层电子数的二倍,则A.B各为()A.碳原子、铍原子B.碳原子、铝原子C.硅原子、钠原子D.氯原子、钠原子19.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子的3倍,该元素的原子结构示意图是_________________。

(时间:30分钟)考查点一原子晶体及其物理特性1.熔化时,必须破坏非极性共价键的是( )。
A.冰B.金刚石C.铁D.二氧化硅解析熔化时必须破坏共价键的是原子晶体,非极性共价键常存在于非金属单质中。
尽管二氧化硅也是原子晶体,但Si—O共价键是极性键。
答案 B2.氮化硅是一种新合成的超硬、耐磨、耐高温的材料。
下列对氮化硅的叙述中,正确的是( )。
A.氮化硅是分子晶体B.氮化硅是原子晶体C.氮化硅是离子晶体D.氮化硅化学式为Si4N3解析从构成元素上看,氮化硅应该是共价化合物,共价化合物形成的晶体有两种可能——分子晶体和原子晶体,再由超硬、耐磨、耐高温等特点考虑,其应该属于原子晶体。
从两种元素的常见价态看,氮化硅的化学式应为Si3N4。
答案 B考查点二原子晶体的结构特征3.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角是( )。
A.6个120° B.5个108°C.4个109.5° D.6个109.5°答案 D考查点三原子晶体熔点高低、硬度大小的比较方法4.下表是某些原子晶体的熔点和硬度原子晶体 金刚石 氮化硼 碳化硅 石英 硅 锗 熔点/℃ 3 900 3 000 2 700 1 710 1 410 1 211 硬度109.59.5 7 6.5 6.0 分析表中的数据,判断下列叙述正确的是( )。
①构成原子晶体的原子种类越多,晶体的熔点越高 ②构成原子晶体的原子 间的共价键键能越大,晶体的熔点越高 ③构成原子晶体的原子的半径越大, 晶体的硬度越大 ④构成原子晶体的原子的半径越小,晶体的硬度越大 A .①②B .③④C .①③D .②④解析 原子晶体的熔点和硬度与构成原子晶体的原子间的共价键键能有关, 而原子间的共价键键能与原子半径的大小有关。
答案 D5.通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。
2019-2020年高中化学 3.3共价键原子晶体练习苏教版选修3一、选择题1.(xx·烟台高二检测)下列晶体中属于原子晶体的是( )A.干冰B.食盐C.胆矾D.晶体硅【解析】选D。
常见的原子晶体中属于非金属单质的有金刚石、晶体硅、晶体硼等,属于非金属化合物的有二氧化硅、碳化硅、氮化硅等。
2.下列说法中不正确的是( )A.双键、叁键都有π键B.成键原子间原子轨道重叠越多,共价键越牢固C.因每个原子未成对电子数是一定的,故配对原子个数也一定D.所有原子轨道在空间都有自己的方向性【解析】选D。
s—sσ键无论s轨道从哪个方向重叠都相同,因此这种共价键没有方向性。
【易错提醒】(1)碳碳叁键和碳碳双键的键能不是碳碳单键键能的3倍和2倍,原因是这些键的类型不完全相同。
(2)键长约等于成键两原子的半径之和,实际上,由于轨道的重叠,前者比后者略短一些。
3.对σ键的认识不正确的是( )A.s-sσ键与s-pσ键的对称性相同B.σ键不属于共价键,是另一种化学键C.若分子中含有共价键,则至少含有一个σ键D.含有π键的化合物与只含σ键的化合物的化学性质不同【解析】选B。
因s轨道为球形对称,因此s-sσ键与s-pσ键的对称性相同,A正确;σ键是共价键的一种,B错;若分子中含有共价键,则至少有一个σ键,C正确;形成π键时,一般会形成双键或叁键,因此与只含有σ键的化合物的化学性质不同,D正确。
【方法规律】σ键、π键判断方法共价单键是σ键,共价双键中有一个是σ键,另一个是π键,共价叁键中有一个是σ键,另两个是π键,如CH2CH2中的碳碳双键,一个是σ键,一个是π键,CH≡CH中的碳碳叁键,一个是σ键,两个是π键。
【补偿训练】下列说法正确的是( )A.非金属元素之间只能形成共价键,而不能形成离子键B.共价键的方向性决定了原子形成分子时相互结合的数量关系C.烯烃比烷烃的化学性质活泼是由于烷烃中的σ键比烯烃中的σ键稳定D.乙醇分子中不存在π键【解析】选D。
高中化学选修3练习:第三章第二节第2课时原子晶体知识点一原子晶体及结构特点的考察1.[2021·湖北武汉模拟]以下有关晶体的说法中,不正确的选项是()A.晶体中一定存在化学键B.依据晶胞的组成就可推知晶体的组成C.分子晶体在固态和熔融态下均不导电D.原子晶体中只存在共价键,不能够存在其他类型的化学键2.[2021·云南曲靖一中月考] C3N4晶体能够具有比金刚石还大的硬度,且原子间均以单键结合,以下说法正确的选项是()A.C3N4晶体中C—N共价键的键长比金刚石中的C—C共价键的键长要长B.C3N4晶体与SiO2晶体类型分歧,二者都有较高的熔沸点C.C3N4晶体中每个C原子衔接3个N原子,每个N原子衔接4个C原子D.C3N4晶体中除了有共价键外还有范德华力3.二氧化硅晶体是空间平面网状结构,如图L3-2-7所示。
以下关于二氧化硅晶体的说法中不正确的选项是()图L3-2-7A.1 mol SiO2晶体中含2 mol Si—O键B.晶体中Si、O原子个数比为1∶2C.晶体中Si、O原子最外电子层都满足8电子动摇结构D.晶体中最小环上的原子数为12知识点二原子晶体性质的考察4.美国«迷信»杂志曾报道:在40 GPa的高压下,用激光加热到1800 K,人们成功制得了原子晶体CO2,以下对该物质的推断一定不正确的选项是()A.该原子晶体中含有极性键B.该原子晶体易升华,可用作制冷资料C.该原子晶体有很高的熔、沸点D.该原子晶体硬度大,可用作耐磨资料5.碳化硅(SiC)晶体有相似金刚石的结构,其中碳原子和硅原子的位置是交替的。
它与晶体硅和金刚石相比拟,正确的选项是()A.熔点从高到低的顺序是碳化硅>金刚石>晶体硅B.熔点从高到低的顺序是金刚石>晶体硅>碳化硅C.三种晶体中的结构单元都是正四面体结构D.三种晶体都是原子晶体且均为电的绝缘体6.依据下表中给出的有关数据,判别以下说法中错误的选项是()A.SiCl4B.晶体硼是原子晶体C.AlCl3是分子晶体,加热能升华D.金刚石中的C—C键比晶体硅中的Si—Si键弱7.依据以下性质判别,属于原子晶体的物质是()A.熔点2700 ℃,导电性好,延展性强B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和无机溶剂C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电8.以下晶体性质的比拟正确的选项是()A.熔点:晶体硅>碳化硅>金刚石B.沸点:NH3>H2O>HFC.硬度:白磷>冰>二氧化硅D.熔点:SiI4>SiBr4>SiCl49.[2021·河北邢台联考]以下说法中,正确的选项是()A.冰消融时,分子中H—O键发作断裂B.原子晶体中,共价键越强,熔点越高C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高D.分子晶体中,分子间作用力越大,该物质越动摇10.下表是某些原子晶体的熔点和硬度。
原子晶体针对性训练一、选择题1.下列晶体中不属于原子晶体的是 ( )A.干冰B.金刚砂C.金刚石D.水晶2.在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上,碳原子数是 ( )A.2个B.3个C.4个D.6个3.下列各物质中,按熔点由低到高排列正确的是( )A.02、I2、HgB.C02、KCl、Si02C.Na、K、RbD.SiC、NaCl、S024.下列各晶体中任一个原子都被相邻的4个原子所包围;似共价键正四面体结构,并向空间伸展成网状结构的是 ( )A.甲烷B.石墨C.晶体硅D.水晶5.在x mol石英晶体中,含有Si-O键数是 ( )A.x molB.2x mo}C.3 x molD.4x mol6.固体熔化时,必须破坏非极性共价键的是 ( )A.冰B.晶体硅C.溴D.二氧化硅7.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六圆环完全占有的碳原子数是( )A.10个B.18个C.24个D.14个二、填空题8.石英晶体的平面示意图如图所示,实际上是立体网状结构,其中硅,氧原子个数比为____________9.SiO44-离子结构用周Si OOOO表示,在二聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________ 10.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。
工业上曾普遍采用高纯硅与纯氮在1 300℃反应获得。
(1)氮化硅晶体属于__________晶体。
(2)已知氮化硅的晶体结构中,原子间以单键相连,且N 原子和N 原子,Si 原子和S 原子不直接相连,同时每个原子都满足8电子稳定结构。
请写出氮化硅的化学式__________(3)现用SiCl4和凡在H ,气氛保护下,加强热发生反应,可得较高纯度的氮化硅。
反应的化学方程式为__________________________________________________11.短周期元素K 、Y 、Z(1)x 元素的单质分子式是_______,若x 核内中子数和质子数相等,x 单质的摩尔质量为_______,单质是_______晶体。
第3节原子晶体与分子晶体第1课时原子晶体学习目标 1.掌握原子晶体的概念、性质特征以及原子晶体空间结构特点。
2.知道金刚石、二氧化硅等原子晶体结构与性质的关系。
一、原子晶体1.概念相邻原子间以________结合而成的具有空间____________结构的晶体。
2.结构特点(1)由于共价键的____________与____________,每个中心原子周围排列的原子数目是________的。
(2)由于所有原子间均以__________相结合,所以晶体中不存在单个________。
3.物理性质(1)原子晶体由于各原子均以强的__________相结合,因此一般熔点很高,硬度________。
(2)结构相似的原子晶体,原子半径越小,键长__________,键能越大,晶体的熔点________。
二、典型的原子晶体通常情况下__________、____________、__________、________等都属于原子晶体。
1.水晶是由Si和O组成的空间立体网状的________晶体,一个硅原子与____个氧原子形成____个共价键,每个氧原子与____个硅原子形成____个共价键,从而形成以______________为骨架的结构,且只存在________键。
二氧化硅晶体中硅和氧原子个数比为________,不存在分子,可以把整个晶体看成巨型分子。
2.在金刚石晶体中,每个碳原子周围排列的碳原子只能有____个,这是由共价键的________性和________性决定的,且形成以碳原子为中心的____________结构。
正是因为中心原子周围排列的原子的数目是有限的,所以这种比较松散排列的结构与金属晶体和离子晶体中的____________排列有很大的不同。
1.下列物质中属于原子晶体的化合物是()A.水晶B.晶体硅C.金刚石D.干冰2.下列物质的熔、沸点高低顺序中,正确的是()A.金刚石>晶体硅>二氧化硅>碳化硅B.Al<Mg<Na<KC.MgO>H2O>O2>N2D.金刚石>生铁>纯铁>钠3.下列有关原子晶体的叙述中,正确的是()A.原子晶体中只存在非极性共价键B.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键C.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体D.原子晶体的熔点一定比金属晶体的高4.根据下列性质判断,属于原子晶体的物质是()A.熔点2700℃,导电性好,延展性强B.无色晶体,熔点3550℃,不导电,质硬,难溶于水和有机溶剂C.无色晶体,能溶于水,质硬而脆,熔点为800℃,熔化时能导电D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电5.2008年9月25日,“神舟”七号太空飞船被“长征2号”F型火箭送入太空。
原子晶体针对性训练
一、选择题
1.下列晶体中不属于原子晶体的是 ( )
A.干冰
B.金刚砂
C.金刚石
D.水晶
2.在金刚石的网状结构中,含有共价键形成的碳原子
环,其中最小的环上,碳原子数是 ( )
A.2个
B.3个
C.4个
D.6个
3.下列各物质中,按熔点由低到高排列正确的是( )
A.02、I2、Hg
B.C02、KCl、Si02
C.Na、K、Rb
D.SiC、NaCl、S02
4.下列各晶体中任一个原子都被相邻的4个原子所包围;似共价键正四面体结构,并向空间伸展成网状结构的是 ( )
A.甲烷
B.石墨
C.晶体硅
D.水晶
5.在x mol石英晶体中,含有Si-O键数是 ( )
A.x mol
B.2x mo}
C.3 x mol
D.4x mol
6.固体熔化时,必须破坏非极性共价键的是 ( )
A.冰
B.晶体硅
C.溴
D.二氧化硅
7.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳
原子相结合,如图是其晶体结构的俯视图,则图中7个六圆环完全占
有的碳原子数是( )
A.10个
B.18个
C.24个
D.14个
二、填空题
8.石英晶体的平面示意图如图所示,实际上是立体网
状结构,其中硅,氧原子个数比为____________
9.SiO44-离子结构用周
Si O
O
O
O
表示,在二聚
硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________ 10.
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。
工业上曾普遍采
用高纯硅与纯氮在1 300℃反应获得。
(1)氮化硅晶体属于__________晶体。
(2)已知氮化硅的晶体结构中,原子间以单键相连,且N 原子和N 原子,Si 原子和S 原子不直接相连,同时每个原子都满足8电子稳定结构。
请写出氮化硅的化学式__________
(3)现用SiCl4和凡在H ,气氛保护下,加强热发生反应,可得较高纯度的氮化硅。
反应的化学方程式为__________________________________________________
11.短周期元素K 、Y 、Z
(1)x 元素的单质分子式是_______,若x 核内中子数和质子数相等,x 单质的摩尔质量为_______,单质是_______晶体。
(2)自然界中存在一种含Y 的天然矿物名称是:电子式为_______,属于_______晶体。
(4)z 单质的晶体类型属于_______,Z 的氢化物和最高价氧化物的浓溶液反应的化学方程式为____________________________ 12.有A 、B 、C 三种晶体,分别由C 、H 、Na
、Cl 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如下图所示
(1)晶体的化学式分别为:A_______ B_______ C_______
(2)晶体的类型分别为:A_______ B_______C_______
(3)晶体中粒子间的作用分别为:A _______ B_______ C_______
第3课时练习答案
一、选择题
1.A
2.D
3.B
4.C
5.D
6.B
7.D
二、填空题
8.1∶2
9. Si Si O
O O O O O
O
10.(1)原子 (2)S 3N 4
(3)3SiCl 4+2N 2+6H
Si3N4+12HCl
11.
(1)He 4g ·mol -1 分于
(2)萤石
(3)分子晶体 H2S+H2S04(浓)=S↓+ S02↑+2H20 12.(1)A NaCl B C C HCl
(2)A 离子晶体 B 原于晶体 C 分子晶体
(3)A 离子键 B共价键 C 分子间作用力。