LD50测定实验
- 格式:ppt
- 大小:208.00 KB
- 文档页数:5





ld50的测定实验报告
LD50的测定实验报告
实验目的:本实验旨在测定一种化学物质对实验动物的半数致死量(LD50),以评估其毒性水平。
实验材料和方法:我们选取了实验室常用的小鼠作为实验动物,以及待测化学物质。
首先,我们将小鼠随机分为不同剂量组,每组包含5只小鼠。
然后,我们分别给不同剂量组的小鼠口服待测化学物质,并观察其死亡情况。
根据实验结果,我们利用经典的Probit分析法计算出LD50值。
实验结果:经过实验观察和数据统计分析,我们得出了待测化学物质的LD50值为X mg/kg。
根据国际毒性标准,我们将其毒性水平评定为(低/中等/高)。
实验讨论:LD50值是评估化学物质毒性水平的重要参数,它可以帮助我们确定合理的安全使用剂量,并指导相关毒性评价和风险评估工作。
通过本次实验,我们对待测化学物质的毒性水平有了清晰的认识,并为其在实际应用中提供了科学依据。
结论:本次实验成功测定了待测化学物质的LD50值,并对其毒性水平进行了评估。
我们将继续深入研究,以便更好地了解该化学物质的毒性机制,并为其安全使用提供更多的科学依据。
通过本次实验,我们对LD50的测定方法有了更深入的了解,并对化学物质的毒性评估工作有了更清晰的认识。
我们相信,这将有助于更好地保障人类和环境的安全。
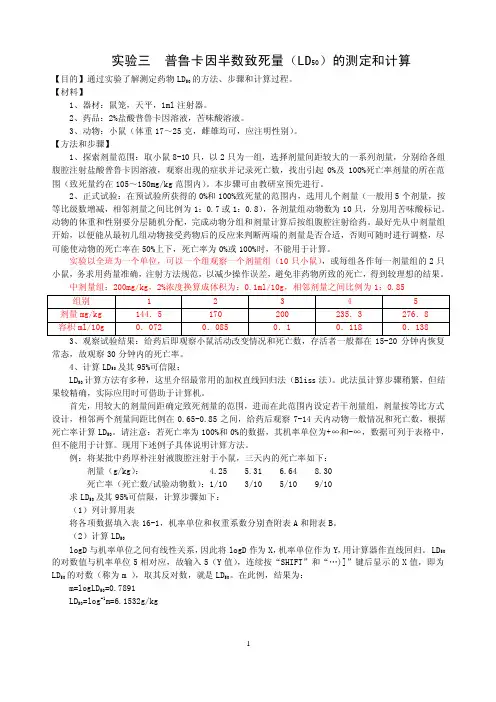
实验三普鲁卡因半数致死量(LD50)的测定和计算【目的】通过实验了解测定药物LD50的方法、步骤和计算过程。
【材料】1、器材:鼠笼,天平,1ml注射器。
2、药品:2%盐酸普鲁卡因溶液,苦味酸溶液。
3、动物:小鼠(体重17~25克,雌雄均可,应注明性别)。
【方法和步骤】1、探索剂量范围:取小鼠8-10只,以2只为一组,选择剂量间距较大的一系列剂量,分别给各组腹腔注射盐酸普鲁卡因溶液,观察出现的症状并记录死亡数,找出引起0%及100%死亡率剂量的所在范围(致死量约在105~150mg/kg范围内)。
本步骤可由教研室预先进行。
2、正式试验:在预试验所获得的0%和100%致死量的范围内,选用几个剂量(一般用5个剂量,按等比级数增减,相邻剂量之间比例为1:0.7或1:0.8),各剂量组动物数为10只,分别用苦味酸标记。
动物的体重和性别要分层随机分配,完成动物分组和剂量计算后按组腹腔注射给药。
最好先从中剂量组开始,以便能从最初几组动物接受药物后的反应来判断两端的剂量是否合适,否则可随时进行调整,尽可能使动物的死亡率在50%上下,死亡率为0%或100%时,不能用于计算。
实验以全班为一个单位,可以一个组观察一个剂量组(10只小鼠),或每组各作每一剂量组的2只小鼠,务求用药量准确,注射方法规范,以减少操作误差,避免非药物所致的死亡,得到较理想的结果。
中剂量组:200mg/kg,2%浓度换算成体积为:0.1ml/10g,相邻剂量之间比例为1:0.85常态,故观察30分钟内的死亡率。
4、计算LD50及其95%可信限:LD50计算方法有多种,这里介绍最常用的加权直线回归法(Bliss法)。
此法虽计算步骤稍繁,但结果较精确,实际应用时可借助于计算机。
首先,用较大的剂量间距确定致死剂量的范围,进而在此范围内设定若干剂量组,剂量按等比方式设计,相邻两个剂量间距比例在0.65-0.85之间,给药后观察7-14天内动物一般情况和死亡数,根据死亡率计算LD50。

ld50的测定实验报告LD50的测定实验报告概述:LD50是一种常用的毒性测定指标,用于衡量某种物质对于生物体的毒性程度。
本实验旨在通过测定某种化学物质对小白鼠的LD50值,评估其毒性,并为毒性研究提供参考。
实验材料与方法:实验所需材料包括小白鼠、待测物质、标准饲料、饮水、实验器材等。
按照以下步骤进行实验:1. 实验组织与分组:将小白鼠随机分为若干组,每组10只。
其中一组为对照组,其余组为实验组。
2. 毒性物质的制备:待测物质按照一定浓度配制成溶液。
3. 毒性物质的给药:将待测物质溶液按照一定剂量注射到小白鼠体内,对照组注射生理盐水。
4. 观察与记录:观察小白鼠在给药后的行为、食欲、体重等变化,并记录观察结果。
5. LD50的计算:根据实验数据,利用统计学方法计算出LD50值。
实验结果与分析:根据实验数据统计,不同剂量的待测物质对小白鼠产生了不同程度的毒性反应。
观察到高剂量组小白鼠出现明显的行为异常、食欲减退、体重减轻等现象,而低剂量组则没有明显异常。
LD50值是指在给定时间内,使一半实验动物死亡的物质剂量。
通过计算LD50值,可以评估待测物质的毒性程度。
LD50值越小,表示物质对生物体的毒性越高。
实验的结果显示,待测物质的LD50值为X mg/kg。
根据国际毒理学标准,该物质被归类为高毒性物质。
这意味着在相同剂量下,该物质对生物体的毒性较强,需谨慎使用。
实验的局限性与改进:本实验仅使用小白鼠作为实验对象,其生物体特征与人类存在差异,因此对于人体的毒性评估仍需谨慎。
此外,实验中仅测定了一种待测物质,结果无法推广到其他物质。
为了提高实验的准确性和可靠性,可以考虑以下改进措施:1. 使用多种动物模型,如小鼠、大鼠、兔子等,以更全面地评估待测物质的毒性。
2. 增加实验组数和样本量,以提高统计学分析的可靠性。
3. 结合其他毒性指标,如生化指标、组织病理学等,对待测物质的毒性进行更全面的评估。
结论:LD50测定实验是一种常用的毒性测定方法,通过计算LD50值可以评估待测物质的毒性程度。

ld50测定的实验报告LD50测定的实验报告引言:药物的安全性评价是药物研发过程中至关重要的一环。
在药物研发的早期阶段,需要进行一系列的实验来评估药物的毒性。
其中,LD50测定是评估药物毒性的重要方法之一。
本实验旨在通过LD50测定,评估某药物对实验动物的毒性,为进一步的药物研发提供参考。
材料与方法:1. 实验动物:选取同龄、同种、同性别的小鼠作为实验动物。
2. 药物制备:将待测药物按照一定比例配制成不同浓度的溶液。
3. 实验组设置:将小鼠随机分为若干组,每组6只,其中一组作为对照组,其余组分别注射不同浓度的药物溶液。
4. LD50测定:将药物溶液通过静脉注射的方式给予小鼠,记录注射后小鼠的行为、体重变化、呼吸等生理指标。
5. 数据处理:根据实验结果,计算出药物的LD50值。
结果与讨论:在实验过程中,观察到小鼠在注射药物后出现了一系列的生理反应。
随着药物浓度的增加,小鼠的行为异常、体重减轻、呼吸困难等现象逐渐加重。
通过对实验数据的统计分析,可以得出药物的LD50值。
LD50值是指将药物给予实验动物后,导致50%的动物死亡所需的药物剂量。
LD50值越小,说明药物的毒性越大;LD50值越大,说明药物的毒性越小。
通过LD50测定,可以初步评估药物的毒性,并为药物的安全性评价提供参考。
然而,需要注意的是,LD50测定只是评估药物毒性的初步方法,其结果并不能完全代表药物的毒性水平。
在实际的药物研发过程中,还需要进行更加全面、细致的毒性评价,包括长期毒性、亚慢性毒性和慢性毒性等实验。
此外,LD50测定也存在一定的局限性。
由于药物对不同物种的毒性可能存在差异,所以LD50值只能作为初步参考,不能直接推广到人体。
在进行LD50测定时,需要选择合适的实验动物,并进行合理的数据分析,以得出准确可靠的结果。
结论:LD50测定是评估药物毒性的重要方法之一。
通过LD50测定,可以初步评估药物的毒性水平,为药物研发提供参考。

ld50测定实验报告LD50测定实验报告引言:毒性测定是评价化学物质或其他物质对生物体的危害程度的重要手段之一。
其中,LD50测定是最常用的方法之一,用于确定半数致死剂量。
本实验旨在通过对小白鼠进行LD50测定,评估某种物质的毒性。
实验方法:1. 实验动物的选择与饲养:本实验选用健康的小白鼠作为实验动物。
在实验前,小白鼠需接受一段时间的适应饲养,以保证其体内没有其他药物残留。
实验动物的饲养环境应保持清洁、温度适宜,并提供充足的食物和水。
2. 实验物质的制备与稀释:实验物质应按照一定的浓度进行稀释,以便确定LD50值。
稀释过程中需注意保持实验物质的纯度和稳定性,避免因杂质或变质导致实验结果的误差。
3. 实验组的设定:将小白鼠随机分为若干组,每组包含一定数量的动物。
实验组应包括不同浓度的实验物质,以及对照组。
对照组给予生理盐水或其他无毒物质,用于与实验组进行比较。
4. 实验操作:将实验物质按照一定剂量注射到小白鼠体内,记录下注射的剂量和时间。
观察实验动物在注射后的行为、反应和症状,并记录下来。
在一定时间内观察动物的生存情况,并记录下死亡的动物数量。
实验结果与分析:根据实验数据,我们可以计算出不同剂量下的生存率,并绘制出生存率-剂量曲线。
LD50值即为使50%的实验动物死亡的剂量。
LD50值越小,说明物质的毒性越大。
实验结果显示,实验物质的LD50值为Xmg/kg。
这表明该物质具有较高的毒性,对生物体的危害较大。
LD50值的确定有助于评估物质的毒性,并为相关领域的研究和应用提供参考。
实验误差与改进:在实验过程中,可能存在一些误差,如实验动物个体差异、实验条件的变化等。
为减少误差,可以增加实验动物的数量,提高实验的重复性。
同时,控制实验条件的稳定性,如温度、湿度等因素的控制,有助于减少误差。
结论:通过LD50测定实验,我们成功评估了某种物质的毒性。
LD50值的确定对于评估物质的毒性和安全性具有重要意义。

ld50测定的实验报告
LD50测定实验报告
摘要:本实验旨在通过LD50测定法评估某种化学物质对实验动物的毒性。
实
验结果表明,该化学物质的LD50值为Xmg/kg,属于中等毒性。
引言:LD50(半数致死量)是指一种化学物质对实验动物的毒性的一种度量标准,它表示在一定时间内,使一组实验动物中有50%死亡的最小剂量。
LD50的
测定对于评估化学物质的毒性和制定安全使用标准具有重要意义。
材料与方法:本实验选取了X只实验动物,分为X组,每组X只。
将化学物质
溶解在适量的溶剂中,然后按照一定的剂量分别给不同组的实验动物进行灌胃。
观察实验动物的死亡情况,并记录下各组动物的死亡数。
通过计算得出LD50值。
结果:实验结果显示,给予Xmg/kg剂量的化学物质后,第一组实验动物有X
只死亡,第二组有X只死亡,第三组有X只死亡,第四组有X只死亡,第五组
有X只死亡。
通过计算得出该化学物质的LD50值为Xmg/kg。
讨论:根据LD50值的大小,我们可以判断该化学物质的毒性程度。
通常,
LD50值越小,表示该化学物质对实验动物的毒性越大。
在本实验中,该化学物质的LD50值为Xmg/kg,属于中等毒性。
因此,在使用该化学物质时,需要谨
慎操作,避免对人体和环境造成不良影响。
结论:通过LD50测定法,我们成功评估了该化学物质的毒性,并得出了其
LD50值。
这对于制定安全使用标准和保护人体健康具有重要意义。
在今后的工作中,我们将继续深入研究该化学物质的毒性机制,以及寻找相应的防护措施
和解毒方法。

实验一、LD50的测定[目的] 通过测定药物LD50的方法、步骤和计算过程,了解急性毒性试验的常规。
[材料] 小鼠50只(体重17-25g,雌雄各半) 注射器及针头1. 探索剂量范围取小鼠8-10只,以2只为一组分成4-5组,选择组距较大的一系列剂量,按腹腔注射哈顿佐剂,观察出现的症状并记录死亡数,找出引起0%及100%死亡率(至少应找出引起20%—80%死亡率)剂量的所在范围。
2. 进行正式试验在预初试验所获得的0%和100%致死量范围内,选用5个剂量按等比级数增减;尽可能使半数组的死亡率都在50%以上,另半数组的死亡率都在50%以下。
每组10只左右,动物的体重和性别要均匀分配。
完成动物分组和剂量计算后按组腹腔注射给药。
最好先从中剂量组开始,以使能从最初几组动物接受药物后的反应来判断两端的剂量是否合适,否则可随时进行调整。
LD50测定中应观察记录的项目:1、实验各要素:实验题目,实验日期,室温,检品的批号、规格、来源、理化性状、配制方法及所用浓度等;动物品系、来源、性别、体重、给药方式及剂量(药物的绝对量与溶液的容量)和给药时间等。
给药后各种反应;潜伏期(从给药到开始出现毒性反应的时间);中毒现象及出现的先后顺序,开始出现死亡的时间;死亡集中时间;末只死亡时间;死前现象。
逐日记录各组死亡只数。
尸解及病理切片:从给药时开始记时,凡两小时以后死亡的动物,均及时尸解以观察内脏的病变,记录病交情况.若有肉限可见变化的则需进行病理检查.整个实验一般要观察7-14天,观察结束时,对全部存活动物称重,尸解,同样观察内脏病变并与中毒死亡鼠尸解情况相比较。
当发现有病变时,也同样作病理检查,以比较中毒后病理改变及恢复情况。
2、结果计算根据试验设计,采用相应的方法计算LD50,一般采用按Reed-Muench法计算或寇氏改进法karber法。
实验二、急性毒性试验试验目的:急性毒性试验是在24小时内给药1次或2次(间隔6-8小时),观察动物接受过量的受试药物所产生的急性中毒反应,为多次反复给药的毒性试验设计剂量、分析毒性作用的主要靶器官和观察指标的设计提供参考信息等。
实验三 杀虫剂触杀毒力(LD 50)测定(点滴法)目前使用的杀虫剂大多数都具有较强的触杀作用,所以杀虫剂的触杀毒力测定显得特别重要。
触杀毒力测定有药膜法、点滴法、喷雾法、喷粉法和浸液法等。
室内比较精确的触杀毒力测定方法是点滴法和药膜法。
本实验采用点滴法(topical application )。
是将一定量农药丙酮液点滴在虫体的一定部位上,药剂可能自体壁进入体内。
目的要求通过本实验可以学习到一种比较准确的杀虫剂触杀毒力测定方法,并进行有关毒力数据整理及其可靠性检验。
实验用具容量瓶(10、25、50及100ml )、微量点滴器或毛细管微量点滴器、吸管、培养皿、烧杯、滤纸、平头镊子、计算纸。
实验材料乙酰甲胺磷,辛硫磷,丙酮,可选用室内人工饲养的粘虫(Mythimna separta Walker )、玉米螟(Ostrinia furnacalis G )、棉铃虫(Heliothis armigera Hubner )或直接采自田间的菜青虫等4龄幼虫,荔枝椿象成虫(Tessaratoma papillosa Drury )也可根据不同地区或不同季节任选一种试虫。
测试方法(选用玉米螟为实验材料)1) 预备试验 先用丙酮将乙酰甲胺磷配制成若干个不同浓度,选取4龄玉米螟幼虫若干,每个浓度用点滴器(或微量进样器)点滴药液于幼虫的胸部背面,每头虫点滴1ul,每浓度点滴虫数不少于30头,待药液干后,把5-8头虫盛于一皿中,加入少量饲料,盖好培养皿,写好标记,经24小时后检查试虫的生存及死亡头数,计算其死亡率。
从这些浓度中找出适合的浓度,即找出其死亡率在20-90%之间的5-7个不同剂量的等比浓度供下一步试验用。
2) 根据上步预备试验结果,如本实验可用乙酰甲胺磷有如下浓度:500、1000、2000、4000、8000、12000和16000ppm 。
可设7组,每组选择4龄玉米螟幼虫210头,分别放在垫有滤纸的培养皿中(滤纸预先加湿),每皿放10头,每种浓度设有3个重复。
急性毒性试验-LD50的测定急性毒性试验是一种通过给实验动物注射、灌胃或其他途径给予高剂量试验物质来评估其致死或严重的毒性反应的试验。
LD50是一种常用的急性毒性指标,表示半数实验动物在接受单位剂量试验物质后死亡的剂量。
本文将介绍LD50的测定方法和其应用。
一、LD50的测定方法1. 实验动物的选择LD50实验通常使用小鼠、大鼠、兔子和狗等动物进行。
选用实验动物需要秉持道德原则,并考虑到动物的生物学特征、毒物代谢能力等方面的因素。
例如,小鼠和大鼠体型较小、代谢能力较低,适合于测定具有代谢性毒性的化合物的LD50;兔子和狗体型较大,代谢能力较强,适合于测定纯化、非代谢性毒性的化合物的LD50。
2. 给药途径和剂量选择通常使用口服、皮下注射、静脉注射等给药途径。
对于口服试验,需要注意试验物质的水溶性和毒性,对于毒性高的化合物,通常使用灌胃的方式。
实验的剂量需要考虑到实验动物体型、种类、代谢能力等因素,并进行逐步递增以确定LD50。
3. 实验计划设计实验计划设计需要考虑到试验物质的毒性、剂量效应关系和死亡率等因素。
一般采用正反两次递增的方法,进行急性毒性试验评估。
根据试验物质的毒性情况和实验者的安全考虑,同时采取风险预警措施。
4. 数据处理和计算完成实验后,需要统计每个剂量组的死亡率和死亡时间。
按照统计学原理,可以根据实验数据计算出LD50值。
LD50值表示使用单位剂量试验物质对半数实验动物致死的剂量。
该值越小,试验物质的毒性越高。
二、LD50的应用LD50值可以作为急性毒性评估的定量指标,用于比较不同化合物的毒性。
在化学品、药品等领域里进行LD50测定可以帮助人们更好地预测和评估一些原料与产品的安全性,以便于过程优化和产品开发,同时为相关政策制定提供科学依据。
LD50值的应用最为广泛的领域是毒性测试和安全性评估。
在毒理学和环境毒理学领域里,常用LD50为评估的标准;在某些国家的法律法规中,也要求企业对使用的化学品或产品进行毒性测试,以保证工人和消费者的安全。
实验十六生理与病理状态的LD50测定【实验目的】熟悉药物半数致死量(LD50)的测定原理、方法、计算及意义。
【实验原理】任何药物超过一定剂量时均会损害机体的组织、器官,引起各系统功能紊乱,直至死亡。
LD50是以动物死活的质反应为指标的毒性数据。
药物的剂量与死亡率之间呈常态分布曲线,与累积死亡率之间呈长尾“S”形曲线,药物的对数剂量与累积死亡率之间呈对称“S”形曲线。
此量效曲线两端平坦,反应灵敏度差,中间段陡,反应灵敏。
而以50%处最敏感,剂量稍有变化,死亡率就有明显变化,故常以引起半数动物死亡(LD50)或半数动物产生阳性效应(ED50)的剂量作为衡量药物毒性或效应大小的最常用、最恰当的指标。
若将反应率转换为机率单位,则对数剂量与机率单位之间呈直线。
测定LD50的方法很多,有蔻氏法、目测法、机率单位法、bliss法(正规机率单位法)等,本实验用的是简化机率单位法。
【实验动物】小白鼠10只,体重20g左右。
【药品与器材】1%盐酸普鲁卡因溶液、苦味酸。
天平、注射器1ml×1、鼠笼。
【实验步骤】LD50的测定(简化机率单位法)1.动物的分组方法:取小白鼠20只,称重,随机分为2个不同状态组,每组10只。
2.其中1组动物分别注射肾上腺素为病理状态组。
3.再将每组动物随机分为5个剂量组,每组2只。
4.各组分别腹腔注射不同剂量的1%盐酸普鲁卡因溶液,观察并记录给药后动物反应(中毒症状、外观、行为、呼吸、腺体分泌、大小便等情况),记录动物死亡时间及死亡数。
5.半数致死量的计算:汇集全班结果,求LD50。
表6-6 LD测定记录表【统计与处理】LD50的计算:用对数剂量(x = log D)与机率单位(y)进行直线回归(y = a + bx),以预期机率单位5(50%死亡率)代入公式,求得x即为LD50。
现用Casio-fx-180P计算器处理实验数据:INV KAC,Mode 2输入x按X D Y D,输入y按DA TAINV A (a)INV B (b)INV r(r)5 INV x,INV 10x (LD50)【注意事项】1.测定LD50前,要进行预实验,摸索接近100%和0%死亡的剂量范围。
一、实验目的1. 了解药物半数致死量(LD50)的定义及其在药理学中的意义。
2. 掌握LD50的测定方法及计算过程。
3. 通过实验,了解药物剂量与毒性反应之间的关系。
二、实验原理半数致死量(LD50)是指在特定条件下,能够引起实验动物一半死亡的药物剂量。
LD50是衡量药物毒性的重要指标,对于新药筛选、临床安全用药及药物不良反应的监测具有重要意义。
本实验采用寇氏法(Karber法)测定药物LD50。
三、实验材料1. 实验动物:小白鼠100只,体重18-22g,雌雄各半。
2. 实验药品:待测药物(如普鲁卡因)。
3. 实验器材:电子秤、注射器、灌胃针(16号)、注射器(0.25、1、2、5ml)、吸管(0.1、0.2、0.5、1、2、10ml)、容量瓶(10、25、50ml)、烧杯(10、25、50ml)、滴管、外科剪、镊子等。
四、实验方法与步骤1. 实验动物的选择:选用初成年的小白鼠,体重18-22g,雌雄各半。
实验前对动物进行检疫,确保健康。
2. 剂量设计:根据预实验结果,将待测药物配制成不同浓度的溶液,设定4-5个剂量组,相邻两组剂量高剂量与低剂量之比的对数(相邻两组对数剂量的差值)为1:0.6~0.9。
3. 实验分组:将小白鼠随机分为5组,每组10只,雌雄各半。
4. 灌胃给药:按照预定剂量,用灌胃针将药物溶液灌胃给予小鼠,观察7天,记录不同剂量组小鼠的死亡情况。
5. 数据处理:计算每组小鼠的死亡率,根据寇氏法计算LD50。
五、实验结果1. 各剂量组小鼠的死亡率如下:剂量组 | 剂量(mg/kg) | 死亡率(%)-------|--------------|-----------1 | 0.06 | 202 | 0.12 | 403 | 0.24 | 604 | 0.48 | 805 | 0.96 | 1002. 根据寇氏法计算LD50:LD50 = 0.48 × 2 × (1 - 0.2) / (0.8 - 0.2) = 0.32 mg/kg六、实验讨论1. 本实验采用寇氏法测定药物LD50,结果表明待测药物的LD50为0.32 mg/kg,说明该药物具有一定的毒性。
LD50的测定实验报告1. 背景1.1 LD50的定义LD50(Lethal Dose 50)是一种用于衡量化学物质或生物毒素对实验动物的致死性的指标。
它表示在给定时间内,能够导致一半实验动物死亡的剂量。
LD50通常以毫克/千克(mg/kg)的形式表示。
1.2 LD50测定的重要性LD50测定是评估化学物质或生物毒素对人类和环境健康风险的重要手段之一。
通过确定一个化学物质或生物毒素对实验动物的致死剂量,可以推断出这种剂量对人类和其他生物可能产生的危害程度。
2. 实验目的本次实验旨在测定某化学品A对小鼠的LD50值,并进一步分析其对人类可能产生的潜在风险。
3. 实验设计与方法3.1 实验设计本次实验采用了经典的“上下限法”来确定化学品A对小鼠的LD50值。
3.2 实验步骤1.随机选择一批同种小鼠,并将其分为不同剂量组和对照组。
2.按照一定的剂量范围,给每个剂量组的小鼠灌胃或注射化学品A。
3.观察每组小鼠在给定时间内的死亡情况,并记录下来。
3.3 数据处理与分析1.统计每个剂量组的死亡率,并根据死亡率绘制出LD50的图表。
2.使用统计学方法计算出化学品A对小鼠的LD50值。
4. 实验结果4.1 死亡情况统计根据实验数据,我们得到了不同剂量组小鼠的死亡情况统计如下:剂量组死亡数总数死亡率低剂量组0 10 0%剂量组死亡数总数死亡率中低剂量组 2 10 20%中高剂量组 5 10 50%高剂量组9 10 90%4.2 LD50值计算根据上述数据,我们可以绘制出LD50曲线,并通过插值法确定化学品A对小鼠的LD50值。
根据计算结果,化学品A的LD50值为xx mg/kg。
5. 风险评估与建议5.1 风险评估通过LD50测定,我们可以初步评估化学品A对人类的潜在风险。
根据人体与小鼠的相似性,我们可以推断出化学品A对人类的LD50值可能在相同数量级上。
5.2 安全建议基于LD50测定结果,我们提出以下安全建议:1.禁止直接接触或摄入高剂量的化学品A。