醋酸地塞米松片含量均匀度的检查讲义
- 格式:doc
- 大小:33.50 KB
- 文档页数:3

医药用级醋酸地塞米松的含量测定方法
醋酸地塞米松是一种常用的抗炎药物,广泛应用于医药领域。
为了确保其质量和安全性,需要对醋酸地塞米松的含量进行准确的测定。
下面介绍一种常用的医药用级醋酸地塞米松含量测定方法。
一般来说,醋酸地塞米松的含量测定方法可以分为化学法和物理法两种。
其中,化学法主要包括高效液相色谱法(HPLC)、紫外分光光度
法和比色法等。
物理法则是通过测量醋酸地塞米松样品的吸收光谱或荧光光谱来确定其含量。
在HPLC法中,首先需要准备好合适的溶剂体系和色谱柱。
常用的溶
剂体系为甲醇-水混合溶剂,并在一定温度下进行梯度洗脱。
然后,
将待测样品与内标品一起注入HPLC系统进行分析。
通过与外标品的
峰面积或峰高进行比较,可以计算出醋酸地塞米松的含量。
在紫外分光光度法中,根据醋酸地塞米松在特定波长下的吸收特性,可以通过测量样品的吸收光谱来计算其含量。
在实际操作中,需要选择合适的波长,并根据标准曲线确定吸光度与浓度之间的关系。
比色法是另一种常用的测定方法,其基本原理是利用醋酸地塞米松与某种试剂发生化学反应,生成有色产物,通过测定产物的吸光度来计算醋酸地塞米松的含量。
常用的试剂有二氨基苯和重酒石酸等。
总之,医药用级醋酸地塞米松的含量测定方法多种多样,每种方法都有其优缺点和适用范围。
选择合适的方法需要考虑到样品特性、仪器设备条件和分析要求等因素。
通过准确测定醋酸地塞米松的含量,可以确保药物的质量和疗效,为医药领域的临床应用提供可靠的依据。

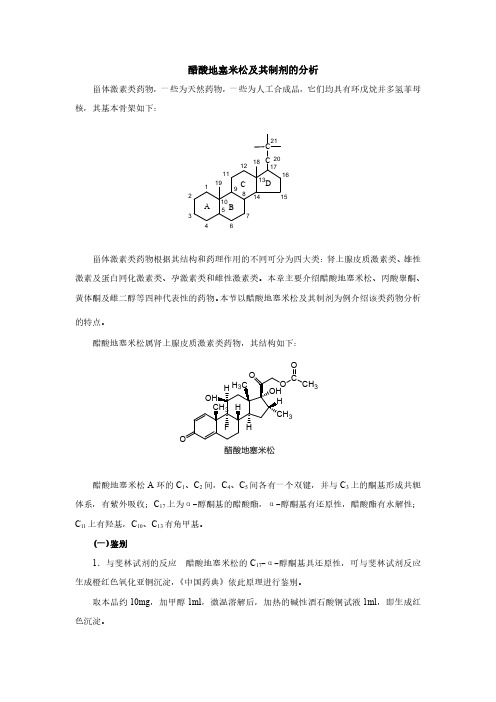
药物分析醋酸地塞米松片含量均匀度紫外测定波长偏离原因考察王世刚!安徽省蚌埠市药品检验所"蚌埠233000#摘要目的寻找醋酸地塞米松片含量均匀度测定时紫外波长偏离的原因方法用紫外分光光度法测定含量均匀度测定液的最大吸收波长值对超出药典规定范围的测定液用高效液相色谱法分离观察有无杂质出现色谱柱为E lit-test ODS柱240mm X4.6mm流动相甲醇-水7030检测波长240n m同时用离心法考察辅料对波长偏离的影响结果主药中含有的杂质和辅料使醋酸地塞米松片含量均匀度紫外测定波长偏离结论用~PLC测定醋酸地塞米松片含量均匀度可避开波长偏离的干扰使结果准确关键词含量均匀度高效液相色谱法醋酸地塞米松Tex p l orati on about t he reason of UV maxi mu m wavelen g t h aberrati on f ort he deter m i nati on of dexa m et hasone acet ate t ablets unif or m it y of contentWANG Shi-G an gBen g bu M unici P al i nstit ute O f Dr u g COntrOl Ben g bu233000ABSTRACT A I M In search of t he reason of UV m aXi mu m Wavel en g t h f or t he deter m i nati on of deXa m et hasone acetate tabl ets unif or m it y of content.M ETHODS For one t hi n g t he UV Wavel en g t h m aXi mu m of t he detected sol uti on Was i ndicated.t hen t he detected sol uti on be y ond t he ran g e of t he p har m aco p oei a Was se p arated on a E lit-test ODS col u mn240mm X4.6mm t o obser ve a pp earance of i m p urit y or not t he mobil e p hase Was co m p osed of m et hanol-Water7030.The o p erati on Was carri ed out at240 n m M ean While t he i nfl uence of t he p har m aceutical additi ves Was consi dered t o be t he ot her f act or of t he aberrati on b y centrif u g a-ti on.RESULTS The i m p urit y i n t he m ai n dr u g and t he p har m aceutical additi ves m ake t he aberrati on t o g et her.CONCLUS I ON The deter m i nati on of deXa m et hasone acetate tabl ets unif or m it y of content b y~PLC can avoi d t he i nfl uence f r o m UV m aXi mun Wavelen g t h aberrati on t o m ake accurate result.KEY WOR DS unif or m it y of content~PLC deXa m et hasone acetate醋酸地塞米松为孕甾类激素临床使用的片剂规格较小中国药典2000年版要求测定其含量均匀度但有的厂家含量均匀度测定时最大紫外吸收波长偏离药典规定的范围使测定无法正常进行本文利用紫外分光光度法1和高效液相色谱法2对市售的4个厂家的醋酸地塞米松的含量均匀度进行测定和比较为合理评价该药和用高效液相色谱法测定该制剂的含量均匀度提供依据l试药与试剂醋酸地塞米松片规格0.75m g A厂批号9803306 B厂批号990424C厂批号20000706D厂批号020611醋酸地塞米松对照品中国药品生物制品检定所批号122-9202甲醇为色谱纯水为重蒸水乙醇宜兴第二化学试剂厂批号20020401其它试剂为分析纯2测定条件色谱条件E lit-test柱240mm X4.6mm十八烷基硅胶键合相流动相甲醇-水7030检测波长240mm进样量101l灵敏度0.1AUFS SP4290积分仪SP8810泵SP 100检测器柱温室温流速1.0m l m i n-1紫外光谱条件狭缝1.0n m扫描速度中速3含量均匀度最大紫外吸收波长测定3.l测定方法取1片置乳钵中研细加乙醇适量研磨并用乙醇40m l分次移至50m l量瓶中置50\60C水浴中保温10m i n并持续振摇使溶解放冷加乙醇至刻度摇匀滤过取续滤液在240n m处寻找最大吸收波长同时与含量测定3项下最大紫外吸收波长比较结果见表1表l含量均匀度最大紫外吸收位置厂家批号含量均匀度n m含量测定n mA9803306235239B990424234240C20000706233241D020*********3.2结果从上述测定结果可看出4个批号的醋酸地塞米松片的含量均匀度测定时其最大紫外吸收波长均超过240 2n m但含量测定时的最大紫外吸收波长在规定范围内4含量均匀度测定液高效液相色谱分离4.l色谱分离方法取本品1片置乳钵中研细用乙醇适量研磨加乙醇40m l分次转移至50m l量瓶中置50\60C 水浴中保温10m i n并持续振摇使醋酸地塞米松溶解放冷至室温加乙醇稀释至刻度摇匀取滤液在上述色谱条件测定另取地塞米松对照品稀释至15m g L-1的溶液同法测定观察有无杂质峰出现图1并与3.1项下的含量均匀度最802安徽医药Anhui M e dic al and Phar m ace utic al J Ournal2003Jun$7!3#图l 高效液相色谱分离含量均匀度测定液的色谱图样品A ;样品B ;样品C ;样品D ;醋酸地塞米松对照品E ;峰1:醋酸地塞米松;峰2:杂质大紫外吸收波长偏离情况比较 见表2表2含量均匀度测定液的高效液相色谱分离结果厂家批号含量均匀度测定时最大吸收波长/n m色谱分离结果A 9803306235分出杂质B 990424234分出杂质C 20000706233分出杂质D020611233未分出杂质4.2结果从色谱分离来看含量均匀度测定液紫外最大吸收超出(240 2>n m 的品种 其色谱有的分出杂质来 有的未分出杂质来 5离心对含量均匀度最大紫外吸收波长的影响5.l 方法取3.1项下的测定液在离心机上离心后测最大紫外吸收波长 结果见表3表3含量均匀度离心后的最大紫外吸收情况(15m g .L -1>厂家批号离心前/n m离心后/n mA 9803306235235B 890424234235C 20000706233233D0206112332395.2结果从表2 3可看出液相色谱未分离出杂质的含量均匀度测定液 离心后再测 则最大紫外吸收波长在药典规定范围内 但用3.1项下分离出杂质的含量均匀度测定液 离心后再测 其最大吸收波长仍超出药典规定范围 6讨论6.l 主药中杂质对含量均匀度最大紫外吸收波长的影响凡含量均匀度测定时最大紫外吸收偏离药典规定的样品 一种情况是主药纯度较差 使样品紫外最大吸收峰位移或图谱形状发生了改变 也无法准确测定吸收值;现行中国药典规定的紫外分光光度法测定该药含量均匀度已不能准确反映该药的质量 建议使用高效液相色谱法进行含量均匀度的测定 6.2离心分离对含量均匀度最大紫外吸收波长的影响样品中的辅料在乙醇中能形成肉眼看不见的混悬液 使含量均匀度最大紫外吸收波长改变 影响含量均匀度的准确测定 但离心后再测定可避开影响 含量均匀度的最大紫外吸收偏离的原因是由于含量均匀度测定时要取1片在溶剂中研磨 使辅料变的很细而发生穿滤引起;含量测定取20片在干燥状态研细 辅料不会被研的很细 穿滤较少发生 所以 通常见不到由于穿滤引起的含量测定最大紫外吸收峰位移参考文献1中国药典.2000.二部 附录272B riti sh Phar m aco p oei a .1988:9293中国药典.2000.二部:1019.902.安徽医药Anhui M e dic al and Phar m ace utic al J Ournal 2003Jun !7"3#醋酸地塞米松片含量均匀度紫外测定波长偏离原因考察作者:王世刚作者单位:安徽省蚌埠市药品检验所,蚌埠,233000刊名:安徽医药英文刊名:ANHUI MEDICAL AND PHARMACEUTICAL JOURNAL年,卷(期):2003,7(3)1.中国药典二部 20002.查看详情 19883.中华人民共和国药典(二部) 20001.卜生高.何选林RP-HPLC法测定醋酸地塞米松片的含量[期刊论文]-中国药事2004,18(8)2.吕长淮.LU Chang-huai紫外分光光度法测定醋酸地塞米松片溶出度[期刊论文]-安徽医药2005,9(6)3.张志涛辅料对醋酸地塞米松片含量均匀度测定的影响[期刊论文]-淮海医药2004,22(3)4.徐序廑淀粉对醋酸地塞米松片的含量测定及含量均匀度测定结果差异的影响[期刊论文]-中国药事1999,13(3)5.姚楠醋酸地塞米松片质量分析与思考[期刊论文]-江苏药学与临床研究2002,10(1)6.钟勇.来海中对醋酸地塞米松片生产工艺的探讨[会议论文]-20007.高培平.苑振亭.李志强西尼地平片含量及含量均匀度测定[期刊论文]-中国医院药学杂志2006,26(2)8.高胜钢偏振光谱仪器技术研究[期刊论文]-红外2003(4)9.殷海青光度分析中工作曲线偏离朗伯-比尔定律的原因[期刊论文]-青海师专学报(教育科学版)2004,24(5)本文链接:/Periodical_ahyy200303034.aspx。

HPLC法测定醋酸地塞米松片含量高雅珍【摘要】本文采用高校液相测定了醋酸地塞米松片中醋酸地塞米松的含量,固定相为:安捷伦C18(4.6mm×250mm,5um),甲醇-四氢呋喃-0.075mol/L醋酸钠缓冲液(pH4.5)(30:10:60)为流动相,检测波长为240nm,流速1.0ml·min-1,柱温:30℃。
醋酸地塞米松在2~30μg·ml-1范围内呈良好的线性关系。
醋酸地塞米松的平均回收率为99.3%,RSD为0.82%(n=6);此方法简便、准确、重现性好,可用于醋酸地塞米松片中醋酸地塞米松的含量测定。
【期刊名称】《黑龙江科技信息》【年(卷),期】2012(000)031【总页数】1页(P85-85)【关键词】醋酸地塞米松片;醋酸地塞米松;含量【作者】高雅珍【作者单位】哈药集团制药总厂,黑龙江哈尔滨150000【正文语种】中文【中图分类】TS207.5醋酸地塞米松是肾上腺皮质激素药具有抗炎、抗过敏等作用。
醋酸地塞米松片主要用于结缔组织病、皮炎等过敏性疾病、恶性淋巴瘤等。
测定醋酸地塞米松的方法主要有紫外分光光度法和高校液相法,本实验采用高校液相法进行测定。
1 仪器与试药BL10-250C双频加热型超声波清洗器(天津市恒奥科技发展有限公司);P230高效液相色谱仪(大连依利特分析仪器有限公司);分析天平(常州市衡正电子仪器有限公司);SHB-III型台式循环水式多用真空泵(郑州长城科工贸有限公司;HH-601超级恒温水浴(江苏金坛市亿通电子有限公司);751GD紫外可见分光光度计(上海天普分析仪器有限公司)。
醋酸地塞米松对照品由中国药品生物制品检定所提供。
乙腈(南京恒泽化工有限公司)、甲醇(南京恒泽化工有限公司)、四氢呋喃(南京恒泽化工有限公司)、醋酸钠(南京恒泽化工有限公司),水为蒸馏水。
2 含量测定2.1 色谱条件依据查阅文献及考查的结果[1-3],确定色谱条件如下。


含量均匀度检查法1简述1.1本法适用于含量均匀度检查。
1.2在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg 或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6含量均匀度的限度应符合各品种项下的规定。
2仪器与用具按正文中该品种项下的规定。
3试药与试液按正文中该品种项下的规定。
4操作方法4.1供试品初试10片(个),复试20片(个)。
4.2除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5注意事项5.1供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6记录与计算6.1应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X,_ I °(Xi X)2求其均值X和标准差S(S ■. i 1〔)以及标示量与均值之差的绝对值A(A 100 X )。
醋酸地塞米松片含量均匀度紫外测定波长偏离原因考察王世刚
【期刊名称】《安徽医药》
【年(卷),期】2003(007)003
【摘要】目的寻找醋酸地塞米松片含量均匀度测定时紫外波长偏离的原因.方法用紫外分光光度法测定含量均匀度测定液的最大吸收波长值,对超出药典规定范围的测定液用高效液相色谱法分离,观察有无杂质出现.色谱柱为Elit-test ODS柱(240 mm×4.6 mm),流动相:甲醇-水(70∶30),检测波长240 nm.同时用离心法考察辅料对波长偏离的影响.结果主药中含有的杂质和辅料使醋酸地塞米松片含量均匀度紫外测定波长偏离.结论用HPLC测定醋酸地塞米松片含量均匀度可避开波长偏离的干扰,使结果准确.
【总页数】2页(P208-209)
【作者】王世刚
【作者单位】安徽省蚌埠市药品检验所,蚌埠,233000
【正文语种】中文
【中图分类】R927
【相关文献】
1.紫外分光光度法测定醋酸地塞米松片溶出度 [J], 吕长淮
2.紫外双波长测定法测定甲磺酸溴隐亭片的含量均匀度 [J], 曾海虹;邱涵;张君倩;洪志玲
3.对氯霉素片、醋酸泼尼松片、醋酸地塞米松片增加紫外光谱鉴别的商榷 [J], 周华
4.高效液相色谱法测定醋酸地塞米松片的含量均匀度 [J], 付小六
5.辅料对醋酸地塞米松片含量均匀度测定的影响 [J], 张志涛
因版权原因,仅展示原文概要,查看原文内容请购买。
含量均匀度检查法第1页共4页第二版批准李忠华初审吴雅凝起草李鑫含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项含量均匀度检查法第2页共4页第二版批准李忠华初审吴雅凝起草李鑫5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X ,求其均值X 和标准差)1)((12n X x S S ni i以及标示量与均值之差的绝对值)100(X AA 。
醋酸地塞米松片含量均匀度的检查醋酸地塞米松片(Dexamethasone Acetate Tablets)属肾上腺皮质激素类药,具有抗炎、抗免疫、抗病毒、抗休克作用。
临床使用的片剂规格较小,中国药典2005年版要求测定其含量均匀度。
含量均匀度——是指小剂量或单位剂量的固体制剂、半固体制剂和非均相液体制剂等每片(个)含量符合标示量的程度。
《中国药典》规定,片剂,胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg或主药含量小于每片(个)重量5%者;其他制剂中每个标示量小于2mg 或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效浓度与毒副反应浓度比较接近的品种或混合工艺较困难的品种,每片(个)标示量不大于25mg者,也应检查均匀度。
本实验采用紫外分光光度(UV)法检查醋酸地塞米松片含量均匀度。
仪器与试剂试剂和药品:醋酸地塞米松片(规格0.75mg)浙江仙琚制药股份有限公司;95%乙醇,注明来源;仪器:紫外可见分光光度计(型号),注明来源;85-2数显恒温磁力搅拌器,杭州仪表电机有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;地塞米松含量均匀度测定最大紫外吸收波长测定取本品1 片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液用TU-1810紫外可见分光光度计,在波长200nm~400nm下,扫描测定最大波长。
方法验证1)重复性检验方法:取醋酸地塞米松片5片,分别按以下方法测定吸光值。
取本品1 片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液,用紫外分光光度法,在240nm的波长处测定吸收度。
醋酸地塞米松片含量均匀度的检查
醋酸地塞米松片(Dexamethasone Acetate Tablets)属肾上腺皮质激素类药,具有抗炎、抗免疫、抗病毒、抗休克作用。
临床使用的片剂规格较小,中国药典2005年版要求测定其含量均匀度。
含量均匀度——是指小剂量或单位剂量的固体制剂、半固体制剂和非均相液体制剂等每片(个)含量符合标示量的程度。
《中国药典》规定,片剂,胶囊剂或注射用无菌粉末,每片(个)标示量不大于10mg或主药含量小于每片(个)重量5%者;其他制剂中每个标示量小于2mg 或主药含量小于每个重量2%者;以及透皮贴剂,均应检查含量均匀度。
对于药物的有效浓度与毒副反应浓度比较接近的品种或混合工艺较困难的品种,每片(个)标示量不大于25mg者,也应检查均匀度。
本实验采用紫外分光光度(UV)法检查醋酸地塞米松片含量均匀度。
仪器与试剂
试剂和药品:醋酸地塞米松片(规格0.75mg)浙江仙琚制药股份有限公司;95%乙醇,注明来源;
仪器:紫外可见分光光度计(型号),注明来源;85-2数显恒温磁力搅拌器,杭州仪表电机有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;
地塞米松含量均匀度测定
最大紫外吸收波长测定
取本品1 片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液用TU-1810紫外可见分光光度计,在波长200nm~400nm下,扫描测定最大波长。
方法验证
1)重复性检验方法:取醋酸地塞米松片5片,分别按以下方法测定吸光值。
取本品1 片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液,用紫外分光光度法,在240nm的波长处测定吸收度。
2)精密度检验方法:取醋酸地塞米松片1片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液,用紫外分光光度法,在240nm的波长处测定吸收度。
测定方法重复测定5次吸光度。
3)稳定性检验方法:取醋酸地塞米松片1片,置乳钵中,研细,加乙醇适量,研磨,并用乙醇40ml分次转移至50ml量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液,用紫外分光光度法,在室温下放置1min,20min,30min,1h,在240nm的波长处分别测定吸光度。
醋酸地塞米松片含量均匀度测定
<<中国药典>>含量均匀度的检查方法为:除另有规定外,取供试品10片(个),按照个药品项下规定的方法,分别测定每片(个)以标示量为100的相对含量X,求其均值X和标准差S以及表示量与均值之差得绝对值A(A=|100-X|);如A+1.8S≤15.0;则供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)进行复试。
根据初复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差得绝对值A;如A+1.45S≤15.0,则供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
标示量=(实测量/标示量)*100%
测定方法:取醋酸地塞米松片10片,按以下方法测定。
取本品1 片,置乳钵中,研细,加乙醇适量,研磨,并用 乙醇40ml 分次转移至50ml 量瓶中,置50~60℃的水浴中保温10分钟,并时时振摇使醋酸地塞米松溶解,放冷至室温,加乙醇稀释至刻度,摇匀,滤过,取续滤液照分光光度法,在240nm 的波长处
测定吸收度,按C 24H 31FO 6的吸收系数(%11cm E )为357计算含量,应符合规定。
按以上方法测定,每片含量的计算公式如下:
E A ⨯⨯⨯=
10010%1cm 1350/mg 片)每片含量(。