实验7-稀溶液的依数性
- 格式:ppt
- 大小:1.21 MB
- 文档页数:13



溶液的依数性溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关系,与溶质本性无关。
依数性分别用拉乌尔定律、沸点升高、凝固点降低和渗透压公式定量描述。
溶液的依数性所谓“依数性”顾名思义是依赖于数量的性质。
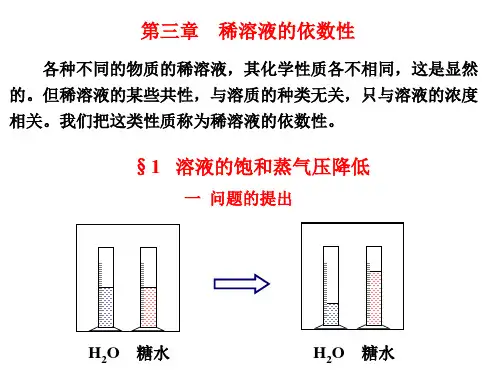
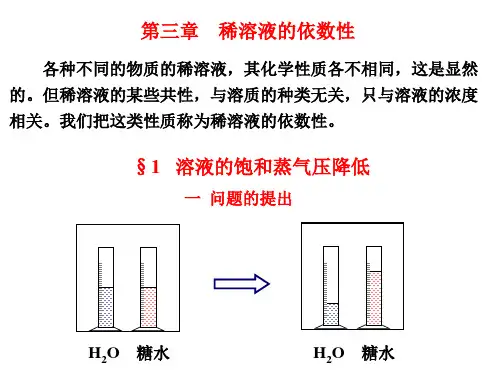
稀溶液中溶剂的蒸气压下降、凝固点降低、沸点升高及渗透压等的数值均与稀溶液中所含溶质的数量有关,这些性质都称为稀溶液的依数性。
1.蒸气压下降对二组分稀溶液,溶剂的蒸气压下降已如式(2-67)所述Δp=p*A-pA=p*AxB即Δp的数值正比溶质的数量—溶质的摩尔分数xB,比例系数即为纯A的饱和蒸气压p*A。
2.凝固点(析出固态纯溶剂时)降低稀溶液当冷却到凝固点时析出的可能是纯溶剂,也可能是溶剂和溶质一起析出。
当只析出纯溶剂时,即与固态纯溶剂成平衡的稀溶液的凝固点Tf比相同压力下纯溶剂的凝固点T*f 低,实验结果表明,凝固点降低的数值与稀溶液中所含溶质的数量成正比,比例系数kf叫凝固点下降系数它与溶剂性质有关而与溶质性质无关。
详细推导3.沸点升高沸点是液体或溶液的蒸气压p等于外压pex时的温度。
若溶质不挥发,则溶液的蒸气压等于溶剂的蒸气压p=pA,对稀溶液pA=p*AxA,pA<p*A,所以在p—T图上稀溶液的蒸气压曲线在纯溶剂蒸气压曲线之下,由图可知,在外压pex时,溶液的沸点Tb必大于纯溶剂羝液的沸点Tb必大于纯溶剂的沸点T*b,即沸点升高。
实验结果表明,含不挥发性溶质的稀溶液的沸点升高亦可用热力学方法推出,kb叫沸点升高系数。
它与溶剂的性质有关,而与溶质性质无关。
4.渗透压若在U形管中用一种半透膜把某一稀溶液和溶剂隔开,这种膜允许溶剂但不允许溶质透过。
实验结果表明,大量溶剂将透过膜进入溶液,使溶液的液面不断上升,直到两液面达到相当大的高度差时才能达到平衡。
要使两液面不发生高度差,可在溶液液面上施加额外的压力,假定在一定温度下,当溶液的液面上施加压力为∏时,两液面可持久保持同样水平,即达到渗透平衡,这个∏值叫溶液的渗透压。

稀溶液的依数性:当溶质溶解在溶剂中形成溶液后,溶液的蒸气压下降,沸点升高,凝固点降低及产生渗透压等性质,只与溶质中粒子的数目有关,而与溶质的本性无关。
由于这类性质的变化,只适用于稀溶液,故称之为稀溶液的依数性。
人工降雨:①根据开尔文公式RTlnPr/P0=2rVm/R’,最初生成的雨滴半径很小,所以其蒸气压很高,此时对平面液体过饱和度达4的水蒸气,对极小的水滴仍未达饱和,所以这个新的液构很难凝聚出来。
②而空气中的灰尘常会作为凝聚中心促使雨滴形成,若在这种水蒸气过饱和度已超过4的云层中,用火箭或撒入干冰提供凝聚中心,使凝聚水滴的曲率半径增大。
由laplace方程,Ps=2Y/R’,其相应的饱和蒸气压变小,蒸汽会还原凝结成冰。
暴沸:①通常在液态有机物中,溶解的空气很少,在蒸馏过程中,液体中形成的蒸汽泡内壁是一个凹液面。
②根据开尔文公式RTlnPr/P0=2rVm/R’可知,凹面上的R’越小,小蒸汽泡内的蒸气压就越低,所以在相同温度下,小蒸汽泡的蒸气压比平面液体的P0低很多;此时液体内部产生气泡所承受的压力P’1=P大气+P平面+Ps,所以当T超过正常沸点时,液体内部的小蒸汽泡无法形成,溶液无法沸腾。
③继续加热,直至小气泡开始形成,气泡一旦形成后便不断变大。
由laplace公式,Ps=2Y/R’,随着R’增大,Ps下降,而P静在气泡上升阶段中不断下降,此时Ti>T正常,故此很容易产生暴沸现象。
盐碱地农作物枯死:①农作物的生长需要水分,然而盐碱地中盐碱浓度大,此时化学势UA 较低,农作物的中心浓度较盐碱地低,其化学式势UB>UA。
②由UB>UA,土地中的渗透压>农作物中的渗透压,农作物中的水分通过细胞壁渗透到土壤中,导致细胞枯萎。
分解电压:电解质在电极上分解生成电解产物所需施加的最小电压。
析出电压:当外加电压等于分解电压时两极的电极电位,是开始析出物质时所必须的最小析出电位。
电极极化的意义:电极上有电流通过时,就会有净反应发生,表明电极失去了原有的平衡状态,电极电位将偏离平衡电位。


稀溶液的依数性凝固点是物质的液相和固相建立平衡的温度。
达到凝固点时,液、固两相的蒸气压必定相等,否则两相不能共存。
(纯水的凝固点为273.16 K(0.009 9℃),这时水和冰的蒸气压均为610.6 Pa(4.58 mm Hg))。
溶液凝固点是指从溶液中开始析出溶剂晶体时的温度。
这时体系是由溶液(液相)溶剂(固相)和溶剂(气相)所组成。
(对于水溶液,溶剂固相即纯冰。
由于溶液蒸气压下降,当273.16 K时,冰的蒸气压仍为610.6 Pa,而溶液蒸气压必然低于610.6 Pa,这样,溶液和冰就不能共存,只有在273.15 K以下的某个温度时,溶液蒸气压才能和冰的蒸气压相等,这时的温度才是溶液的凝固点。
这段话可以用图2-5-2表示)溶液的凝固点总是比纯溶剂的低的现象称为凝固点下降。
(溶液浓度越大,蒸气压下降越多,凝固点下降也越多。
在同一溶液中,随着溶剂不断结晶析出,溶液浓度将不断增大,凝固点也将不断下降。
)溶液凝固点下降是由于溶液蒸气压下降引起的。
对于稀溶液,既然蒸气压下降Dp和溶液的质量摩尔浓度mB成正比,这类溶液的凝固点下降也应和质量摩尔浓度有联系。
Raoult根据依数性指出:对于难挥发非电解质的稀溶液,凝固点下降ΔTf和溶液质量摩尔浓度成正比,即:ΔTf=Tf°-Tf=KfmB式中:Tf为溶液的凝固点;Tf°为纯溶剂的凝固点;Kf为溶剂的凝固点下降常数,Kf由溶剂的本性决定而与溶质的种类无关。
凝固点降低的应用1.生活方面:将食盐和冰混合,可以使温度降低到251 K。
氯化钙与冰混合,可以使温度降低到218 K。
(体系温度降低的原因是:当食盐或氯化钙与冰接触时,在食盐或氯化钙的表面形成极浓的盐溶液,而这些浓盐溶液的蒸气压比冰的蒸气压低得多,冰则以升华或熔化的形式进入盐溶液。
进行上述过程都要吸收大量的热,从而使体系的温度降低。
)冬天在室外施工,建筑工人在砂浆中加入食盐或氯化钙;汽车驾驶员在散热水箱中加入乙二醇等等,也是利用这一原理,防止砂浆和散热水箱结冰。


稀溶液的依数性难挥发的非电解质稀溶液的性质(稀溶液的蒸气压下降、沸点上升、凝固点下降和溶液的渗透压)跟溶入一定量溶剂中溶质的物质的量成正比,而跟溶质的本性无关。
这种性质叫做稀溶液的依数性。
稀溶液的这些性质仅仅依赖于溶质的粒子数目的多少,而跟溶质的本性无关。
在一定温度下,稀难挥发的非电解质稀溶液的性质(稀溶液的蒸气压下降、沸点上升、凝固点下降和溶液的渗透压)跟溶入一定量溶剂中溶质的物质的量成正比,而跟溶质的本性无关。
这种性质叫做稀溶液的依数性。
稀溶液的这些性质仅仅依赖于溶质的粒子数目的多少,而跟溶质的本性无关。
在一定温度下,稀溶液的蒸气压下降是跟溶入这溶剂中溶质的物质的量分数成正比,而跟溶入溶质的性质无关。
它的数学表达式是p0(剂)-p=△p=p0(剂)·X(质)。
其中p0(剂)是纯溶剂的蒸气压,p是溶液的蒸气压,△p是溶液蒸气压下降,X(质)是溶质的物质的量占溶液物质的量的分数。
溶有难挥发非电解质的稀溶液的沸点升高度数跟溶液的质量摩尔浓度成正比。
它的数学表达式是沸点上升常数(只跟溶剂有关),m b是溶液的质量摩尔浓度。
溶有难挥发非电解质的稀溶液的凝固点下降度数跟溶液的质量摩尔浓度成正比。
其数学表达式是△t f=K f·m B。
式中△t f 是凝固点下降度数(纯溶剂凝固点和溶液凝固点的差),K f是溶剂的凝固点下降常数(只跟溶剂有关),m B是溶液的质量摩尔浓度。
稀溶液的渗透压跟溶液的浓度、绝对温度成正比,而跟溶质的本性无关。
它的数学表示式是πV=nRT。
式中π是溶液的渗透压,V是溶液的体积,R是通用气体常数,T是热力学温度,n是溶液中溶入溶质的物质的量。
稀溶液的依数性有广泛的应用,例如,由测定物质的冰点下降和沸点上升来推断物质的分子量,由测定渗透压推断蛋白质、血红素等大分子物质的分子量,利用凝固点下降制作防冻剂和致冷剂,在生物和医学上制作等渗溶液(0.9%的生理盐水)。

实验7 凝固点降低法测定摩尔质量实验目的1.用凝固点降低法测定萘的摩尔质量2.学会用步冷曲线对溶液凝固点进行校正3.通过本实验加深对稀溶液依数性的认识实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆= 即310B f f Am M K T m =∆ 式中: f K ——溶剂的凝固点降低常数(单位为1K kg mol -);M ——溶质的摩尔质量(单位为1g mol -)。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表。
表2-7-1 常用溶剂的f K 值 kg mol1.853 5.12 6.94 实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图2-7-1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
实验7 凝固点降低法测定摩尔质量姓名:贾曌学号:2008011920 班级:化82班 同组实验者姓名:张辇实验日期: 2011年3月10日 提交报告日期:2008年3月15日 指导老师:江寅1引言1.1实验目的1.1.1用凝固点降低法测定萘的摩尔质量 1.1.2学会用步冷曲线对溶液凝固点进行校正 1.1.3通过本实验加深对稀溶液依数性的认识1.2实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××Bf f Am T K M m ∆= 即310Bff Am M K T m =∆ 式中: f K ——溶剂的凝固点降低常数(单位为1K kg mol -); M ——溶质的摩尔质量(单位为1g mol -)。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
K值见下表。
常用溶剂的fK值表1 常用溶剂的f2-7-1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。