2.气体溶解度 (1)含义:气体在一定温度时溶于1体积水里达到饱和状 态时的气体体积,常记为1∶x。 (2)影响因素:温度和压强,温度升高溶解度减小,压强 增大溶解度增大。
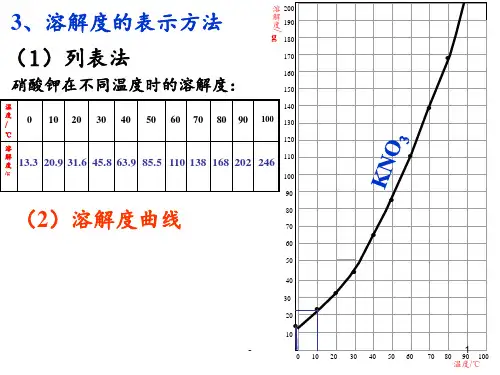
3.溶解度与结晶方法: (1)对于大多数固体物质,溶解度随温度升高而增大,如 KNO3,应采取蒸发浓缩、冷却结晶、过滤的方法结晶。 (2)对于溶解度随温度变化不大的固体物质,如NaCl,应 采取蒸发结晶的方法结晶。
(3)将t2 ℃时a、b、c三种物质的饱和溶液降温至 t1 ℃,溶质的质量分数由大到小的顺序是________。 (4)t2 ℃时,将150 g a的饱和溶液稀释成质量分数为 20%的溶液需加水________g。
【解析】(1)a的溶解度随着温度的升高而增大,c的溶 解度随着温度的升高而减小,因此若使a、c的饱和溶液 同时析出晶体,方法是蒸发溶剂。 (2)气体的溶解度随温度的变化规律与c相似。
答案:(1)蒸发溶剂 (2)c (3)b>a>c (4)100
【加固训练】 1.20 ℃时,NaCl溶解于水的实验数据如下表所示:
实验序号
① ② ③
水的质量/g
10 10 10
加入的NaCl 质量 2 3 4
未溶的NaCl 质量/g 0 0 0.4
下列叙述正确的是 ( ) A.实验①所得的溶液为饱和溶液 B.实验②所得的溶液为饱和溶液 C.20 ℃时NaCl的溶解度为30 g D.实验①所得溶液的溶质质量分数为16.7%
有关物质的溶解度如图所示。向“滤液3”中加入适量
KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却 到__________(填标号)得到的K2Cr2O7固体产品最 多。
a.80 ℃ b.60 ℃ c.40 ℃ d.10 ℃ 步骤⑤的反应类型是______________。