第七章_化学反应动力学基础1
- 格式:ppt
- 大小:7.13 MB
- 文档页数:45




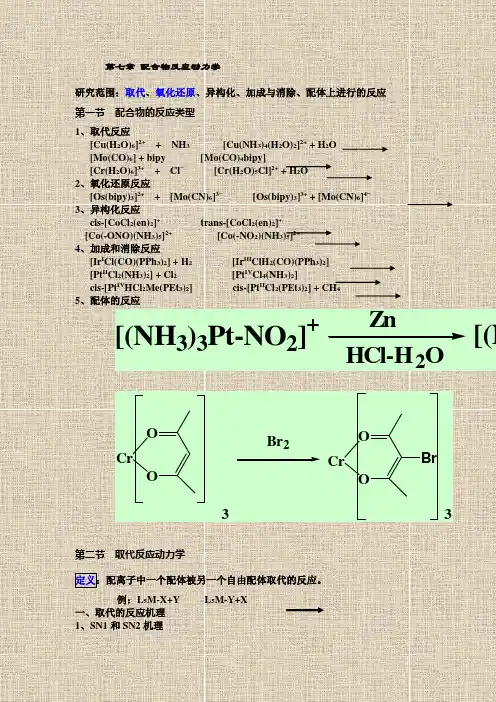
第七章配合物反应动力学研究范围:取代、氧化还原、异构化、加成与消除、配体上进行的反应第一节配合物的反应类型1、取代反应[Cu(H2O)6]2++ NH3 [Cu(NH3)4(H2O)2]2+ + H2O[Mo(CO)6] + bipy [Mo(CO)4bipy][Cr(H2O)6]3++ Cl−[Cr(H2O)5Cl]2+ + H2O2、氧化还原反应[Os(bipy)3]2++ [Mo(CN)6]3−[Os(bipy)3]3+ + [Mo(CN)6]4−3、异构化反应cis-[CoCl2(en)2]+trans-[CoCl2(en)2]+[Co(-ONO)(NH3)5]2+[Co(-NO2)(NH3)5]2+4、加成和消除反应[Ir I Cl(CO)(PPh3)2] + H2[Ir III ClH2(CO)(PPh3)2][Pt II Cl2(NH3)2] + Cl2[Pt IV Cl4(NH3)2]cis-[Pt IV HCl2Me(PEt3)2] cis-[Pt II Cl2(PEt3)2] + CH45、配体的反应ZnHCl-H2O [(NH3)3Pt-NO2]+[(NCrOOCrOOBrBr233第二节取代反应动力学定义:配离子中一个配体被另一个自由配体取代的反应。
例:L5M-X+Y L5M-Y+X一、取代的反应机理1、SN1和SN2机理(1)离解机理(SN1机理)慢a.L5M-X = L5M + X(配位数下降6 5)b.L5M + Y = L5M-Y速率方程:d[L5M-Y]/dt = k[L5M-X]速率与Y浓度无关,是对[L5M-X]的一级反应。
(2)缔合机理(SN2机理)慢a、L5M-X + Y = L5MXY(配位数升高6 7)b、L5MXY = L5M-Y + Xd[L5M-Y]/dt = k[L5M-X][Y]属于二级反应。
* SN1和SN2是两种极限情況。
二.活性与惰性配合物及理论解释1、活性与惰性配合物1)定义:配体可被快速取代的配合物,称为活性配合物;配体取代缓慢的配合物,称为惰性配合物划分标准:配合物与反应试剂(浓度均为0.1M)在25℃时反应,t1/2>1min,称为惰性配合物;t1/2<1min,称为活性配合物。

第七章化学反应动力学一.基本要求1.掌握化学动力学中的一些基本概念,如速率的定义、反应级数、速率系数、基元反应、质量作用定律和反应机理等。
2.掌握具有简单级数反应的共同特点,特别是一级反应和a = b的二级反应的特点。
学会利用实验数据判断反应的级数,能熟练地利用速率方程计算速率系数和半衰期等。
3.了解温度对反应速率的影响,掌握Arrhenius经验式的4种表达形式,学会运用Arrhenius经验式计算反应的活化能。
4.掌握典型的对峙、平行、连续和链反应等复杂反应的特点,学会用合理的近似方法(速控步法、稳态近似和平衡假设),从反应机理推导速率方程。
学会从表观速率系数获得表观活化能与基元反应活化能之间的关系。
5.了解碰撞理论和过渡态理论的基本内容,会利用两个理论来计算一些简单反应的速率系数,掌握活化能与阈能之间的关系。
了解碰撞理论和过渡态理论的优缺点。
6.了解催化反应中的一些基本概念,了解酶催化反应的特点和催化剂之所以能改变反应速率的本质。
7.了解光化学反应的基本定律、光化学平衡与热化学平衡的区别,了解光敏剂、量子产率和化学发光等光化反应的一些基本概念。
二.把握学习要点的建议化学动力学的基本原理与热力学不同,它没有以定律的形式出现,而是表现为一种经验规律,反应的速率方程要靠实验来测定。
又由于测定的实验条件限制,同一个反应用不同的方法测定,可能会得到不同的速率方程,所以使得反应速率方程有许多不同的形式,使动力学的处理变得比较复杂。
反应级数是用幂函数型的动力学方程的指数和来表示的。
由于动力学方程既有幂函数型,又有非幂函数型,所以对于幂函数型的动力学方程,反应级数可能有整数(包括正数、负数和零)、分数(包括正分数和负分数)或小数之分。
对于非幂函数型的动力学方程,就无法用简单的数字来表现其级数。
对于初学者,要求能掌握具有简单级数的反应,主要是一级反应、a = b的二级反应和零级反应的动力学处理方法及其特点。

第七章化学动力学主要内容1.化学动力学的任务和目的2.化学反应速率的定义3.化学反应的速率方程4.具有简单级数的反应5.几种典型的复杂反应6.温度对反应速率的影响7.链反应 重点1.重点掌握化学反应速率、反应速率常数及反应级数的概念2.重点掌握一级和二级反应的速率方程及其应用3.重点掌握复杂反应的特征,了解处理对行反应、平行反应和连串反应的动力学方法。
4.重点理解阿罗尼乌斯方程的意义并会应用。
明确活化能及指前因子的定义 难点1.通过实验建立速率方程的方法2.稳态近似法、平衡近似法及控制步骤的概念及其运用3.复杂反应的特征及其有关计算 教学方式1.采用CAI 课件与黑板讲授相结合的教学方式。
2.合理运用问题教学或项目教学的教学方法。
教学过程第7.1节化学动力学研究的内容和方法热力学讨论了化学反应的方向和限度,从而解决了化学反应的可能性问题,但实践经验告诉我们,在热力学上判断极有可能发生的化学反应,实际上却不一定发生。
例如合成氨的反应,223()3()2()N g H g NH g ,在298.15K 时,按热力学的结论,在标准状态下此反应是可以自发进行的,然而人们却无法在常温常压下合成氨。
但这并不说明热力学的讨论是错误泊,实际上豆科植物就能在常温常压下合成氨,只是目前还不能按工业化的方式实现,这说明化学反应还存在一个可行性的问题。
因此,要全面了解化学反应的问题,就必须了解化学变化的反应途径----反应机理,必须引入时间变量。
研究化学反应的速率和各种影响反应速率的因素,这就是化学动力学要讨论的主要内容。
一、化学热力学的研究对象和局限性:研究化学变化的方向、能达到的最大限度以及外界条件对平衡的影响。
化学热力学只能预测反应的可能性,但无法预料反应能否发生?反应的速率如何?反应的机理如何?例如:热力学只能判断这两个反应都能发生,但如何使它发生,热力学无法回答。
二、化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及温度、压力、催化剂、溶剂和光照等外界因素对反应速率的影响,把热力学的反应可能性变为现实性。


第七章化学动力学主要内容1. 化学动力学的任务和目的2. 化学反应速率的定义3. 化学反应的速率方程4. 具有简单级数的反应5. 几种典型的复杂反应6. 温度对反应速率的影响7. 链反应重点1. 重点掌握化学反应速率、反应速率常数及反应级数的概念2. 重点掌握一级和二级反应的速率方程及其应用3. 重点掌握复杂反应的特征,了解处理对行反应、平行反应和连串反应的动力学方法。
4. 重点理解阿罗尼乌斯方程的意义并会应用。
明确活化能及指前因子的定义难点1. 通过实验建立速率方程的方法2. 稳态近似法、平衡近似法及控制步骤的概念及其运用3. 复杂反应的特征及其有关计算教学方式1. 采用CAI课件与黑板讲授相结合的教学方式。
2. 合理运用问题教学或项目教学的教学方法。
教学过程第7.1节 化学动力学研究的内容和方法热力学讨论了化学反应的方向和限度,从而解决了化学反应的可能性问题,但实践经验告诉我们,在热力学上判断极有可能发生的化学反应,实际上却不一定发生。
例如合成氨的反应,223()3()2()N g H g NH g + ,在298.15K 时,按热力学的结论,在标准状态下此反应是可以自发进行的,然而人们却无法在常温常压下合成氨。
但这并不说明热力学的讨论是错误泊,实际上豆科植物就能在常温常压下合成氨,只是目前还不能按工业化的方式实现,这说明化学反应还存在一个可行性的问题。
因此,要全面了解化学反应的问题,就必须了解化学变化的反应途径----反应机理,必须引入时间变量。
研究化学反应的速率和各种影响反应速率的因素,这就是化学动力学要讨论的主要内容。
一、化学热力学的研究对象和局限性:研究化学变化的方向、能达到的最大限度以及外界条件对平衡的影响。
化学热力学只能预测反应的可能性,但无法预料反应能否发生?反应的速率如何?反应的机理如何?例如:热力学只能判断这两个反应都能发生,但如何使它发生,热力学无法回答。
二、化学动力学的研究对象化学动力学研究化学反应的速率和反应的机理以及温度、压力、催化剂、溶剂和光照等外界因素对反应速率的影响,把热力学的反应可能性变为现实性。

第七章 基元化学反应动力学习题及答案1. N 2O 5在25℃时分解反应的半衰期为5.7h, 且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应 111216.07.56932.06932.021-===h t kt k y1)11ln(=- h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-=即完成90%所需时间为18.9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1 =5.4×1011exp(-122 474 J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101 325 Pa ,问多长时间后,丙烯酮的分压可达54 kPa ?解:k /S -1=5.4×1011exp[-122474/8.314×(150+273)]=4.055×10-4据题意:kt p p t=0lnt 410005.454000101325101325ln-⨯=-t =1877S3. 双分子反应2A(g)−→−k B(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出 (1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol-1, 573K时的最大反应速率为多少? 解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t, t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.4. 450℃时实验测定气相反应3A + B→2C的速率数据如下;实验初压 / Pa 初速率-dpB/ dt / (Pa/h)PA,0 PB,01. 100 1.00 0.0100 2. 200 1.00 0.0400 3. 400 0.50 0.0800(1)若反应的速率方程为r = kPA x PBy,求x、y及k。
● §1化学反应速率●§1.1化学反应速率表示法当一个化学反应开始后,反应物的数量(或浓度)不断减少,产物的数量(或浓度)不断增加。
化学反应的速率可以用单位体积单位时间反应进度 的变化来表示。
(在考虑计量系数后,也可以用单位体积单位时间反应物的物质的量减少或产物的物质的量增加来表示。
)如果化学反应以如下计量式来表示:(假设没有副反应)0=∑BB B ν 或 cC +dD —→eE +fFr =V 1dt d ξ=B V ν1dtdn B(=-Vc 1dt dn C =Ve 1dt dn E ……)注意:1、如果化学反应有副反应时,就会出现困难,所得到的数据结果是有差异的。
2、用物质的量来表示反应速率时,通常是否除于计量系数会使得的数据结果有成倍数的差异。
所以在查看化学动力学数据时,需要注意速率表示方式。
因为物质的量是广度性质,而物质的量浓度是强度性质,所以物质的量浓度更适于用来表示化学反应速率。
(B n =V B C )r =V 1dt d ξ=B V ν1dt dn B =B V ν1dt dVC B =B ν1dt dC B+BB VC νdt dV对于等容反应,dV =0r =B ν1dtdC B这个式子适用于大多数的溶液反应和固定容器的气体反应如果化学反应是在固体界面上进行的气—固相间或液—固相间反应,则化学反应速率可以用单位固体界面上(或单位固体体积、或单位固体质量)单位时间反应进度的变化来表示。
r =A 1dt d ξ=B A ν1dt dn B或 r =V 1dt d ξ=B V ν1dtdn B或 r =m 1dt d ξ=B m ν1dtdn B化学反应速率的大小会受到温度T 、压力p 、浓度B C 、介质、光、催化剂、……等各种强度性质的影响,由于反应速率表示式中就含有浓度因素,因此现在首先讨论物质浓度对反应速率的影响。
● §1.2物质浓度对化学反应速率的影响 ●§1.2.1化学反应速率方程式如果除了物质浓度以外其他影响化学反应速率的强度性质都保持不变,就可以将反应速率表示成物质浓度的函数关系:r =B ν1dtdC B=f (C B )从后一个等式中,变量只有物质浓度C B 和时间t ,微分方程积分后得到物质浓度C B 与时间t 的函数关系C B =F (t)这两个式子都称为化学反应的速率方程式或动力学方程式,有时细分为动力学微分方程式和动力学积分方程式。
第十一章 化学动力学§化学反应的反应速率及速率方程1.反应速率的定义非依时计量学反应: 若某反应不存在中间物,或虽有中间物,但其浓度甚微可忽略不计,则此类反应将在整个反应过程中符合一定的计量式。
那么,这类反应就称为非依时计量学反应 某反应的化学计量式:B B0B ν=∑对非依时计量学反应,反应进度ξ定义为:B B d d /n ξν=转化速率为:B B d /d (1/)(d /d )t n t ξξν==& 反应速率为:B B /(1/)(d /d )r V V n t ξν==& 即用单位时间单位体积内化学反应的反应进度来定义反应速率。
对非依时计量学反应,此定义与用来表示速率的物质B 的选择无关,与化学计量式的写法有关。
对于恒容反应,反应速率可表示为:B B (1/)(d /d )r c t ν= 对任何反应: E F G H e f g h +=+G E F Hd d d d 1111d d d d c c c c re tf tg th t=-=-==2.基元反应 定义:如果一个化学反应,反应物分子在碰撞中相互作用直接转化为生成物分子,这种反应称为基元反应。
基元反应为组成一切化学反应的基本单元。
例如:2222C +M =2C +M C +H =HC +H H +C =HC +C 2C +M =C +Mg g化学反应方程,除非特别注明,一般都属于化学计量方程,而不代表基元反应。
反应机理:反应机理又称为反应历程。
在总反应中,连续或同时发生的所有基元反应称为反应机理,在有些情况下,反应机理还要给出所经历的每一步的立体化学结构图。
3. 基元反应的速率方程--质量作用定律、反应分子数(1)反应分子数:基元反应方程式中各反应物分子个数之和,称为反应分子数。
(2)质量作用定律:对于基元反应,反应速率与反应物浓度的幂乘积成正比。
幂指数就是基元反应方程中各反应物的系数。
这就是质量作用定律,它只适用于基元反应。