碳族元素学习笔记——无机化学
- 格式:doc
- 大小:595.50 KB
- 文档页数:8

碳族元素预习笔记一、碳族元素通性1、原子结构性质⑴相似性:•外层电子构型:ns²np²气态氢化物的通式:RH4最高价氧化物对应的水化物通式为H2RO3或R(OH)4⑵递变性•+2价化合物主要氧化态稳定性:由上至下逐渐增强+4价化合物主要氧化态稳定性:由上至下逐渐减弱但铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。
•熔沸点降低(锡和铅反常),单质密度逐渐增大•金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致)•最高价氧化物对应水化物的酸性减弱(最高价氧化物对应的酸举个例子解释:碳酸H2CO3。
(HO)2-CO连接一个氧原子,氧原子强吸电子作用导致碳原子电子云密度下降,对应的碳原子同样要从羟基上边多取电子,那么最终结果就是羟基氧原子再把和氢原子公用的电子对拉向自己。
那么此时氢原子是缺电子的,就会很容易电离。
氢原子越缺电子越容易电离;那么对应的中心原子越吸电子,氢原子就越缺电子。
所以从上到下,元素原子电负性减弱,吸电子能力减弱,自然氢离子电离能力减弱,酸性减弱。
)•氢化物的稳定性减弱•第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子)特殊:锡<铅•熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体)二、元素的成键特性⒈碳:①共价键(sp:CO sp²:乙烯 sp³:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧可形成多种有机化合物。
②以碳酸盐的形式存在于自然界中2.硅:①硅氧四面体形式存在(石英,硅酸盐矿)②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4)②共价键(+4氧化态,SnO、PbO2)二、碳及其化合物1.单质(三种同素异形体)①金刚石:结构:sp³杂化,原子晶体,五个碳原子构成正四面体性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透明,不导电,化学惰性,但800°C以上与空气反应成CO2②石墨:结构:sp²杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π键层与层之间靠分子见作用力结合在一起。




碳族元素1.复习重点1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价; 2.碳族元素的性质及其递变规律; 3.碳和硅的性质、用途。
碳1.C在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。
①燃烧反应②与某些氧化物的反应:C +CO 22CO ;C +2CuO CO 2↑+2Cu ;C +H 2O CO +H 2O (CO 、H 2的混合气体叫水煤气); 2C+SiO 2Si+2CO↑③与氧化性酸反应:C +2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O ; C +4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O2.CO不溶于水,有毒(CO 和血红蛋白结合,使血红蛋白无法和O 2结合,而使细胞缺氧引起中毒),但由于CO 无色无味因此具有更大的危险性。
①可燃性①还原性:CO+CuO −→−∆CO 2+Cu ,CO+H 2O(g)CO 2+H 2O3.CO 2直线型(O =C =O )非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。
固态CO 2俗称干冰,能升华,常用于人工降雨。
实验室制法:CaCO 3+2HCl =CaCl 2+CO 2↑+H 2O 。
①酸性氧化物一—酸酐Ca(OH)2+CO 2=CaCO 3↓+H 2O(用于检验CO 2)①氧化性:CO 2+C −−→−高温2CO ;2Mg +CO 2−−→−点燃2MgO +C4.碳酸盐①溶解性:Ca(HCO 3)2>CaCO 3;Na 2CO 3>NaHCO 3。
①热稳定性:Na 2CO 3>CaCO 3;碱金属正盐>碱金属酸式盐: Na 2CO 3>NaHCO 3。
③相互转化:碳酸正盐碳酸酸式盐(除杂用)硅1.晶体硅的物理性质灰黑色、有金属光泽、硬而脆的固体。
它的结构类似于金刚石,熔点和沸点都很高,硬度也很大。
它的导电性介于导体和绝缘体之间,是良好的半导体材料。
2、硅的化学性质1.在常温下,硅的化学性质不活泼。
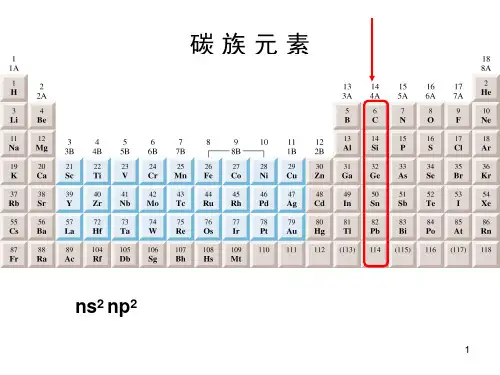

碳族元素自习笔记一、碳族元素的通性1.原子结构及其性质(22np ns ) 性质碳硅锗锡铅原子半径/pm 77113 122 141 147 第一电离能/ (kJ/mol) 1086.4 786.5 762.2 708.6 715.5 电子亲和能(kJ/mol) -122.5 -199.6 -155.8 -120.6 -101.3 电负性2.551.90/1.82.01/1.81.96/1.82.33/1.9碳族元素中,碳硅是非金属,硅锗金属性和非金属性均不强,称为准金属元素。
锡铅是金属元素。
熔沸点较高。
酸性介质中,Co 易发生歧化反应生成C 和2CO ;Si 易发生歧化反应生成4SiH 和2SiO ;+2Ge易发生歧化反应生成Ge 和2GeO ;碱性介质中,-2HCO 易发生歧化反应生成C 和-23CO ;Si 易发生歧化反应生成4SiH 和-23SiO 。
二、成键特征C :C 与H 、O 、Cl 等非金属原子形成共价化合物,键能大,稳定性高,C 、H 、O 形成数百万种的有机化合物,其中C 的氧化数从+4到-4。
以碳酸盐的形式存在于自然界中。
Si :①以硅氧四面体的形式存在,如石英和硅酸盐矿。
②Si —Si 和Si —H 键能小于C —C 和C —H,Si 、H 、O 也可形成共价化合物,但是数量有限。
Sn 和Pb :①以+2氧化态的形式存在于离子化合物中,如:2SnCl 、SnO 、23)(NO Pb 、PbO 。
②以+4氧化态的形式存在于共价化合物和少数;离子型化合物中,如:4SnCl 、2PbO 、2SnO 等。
其中以+4氧化态的铅,由于惰性电子对效应,具有强氧化性。
三、元素在自然界中的分布碳在自然界中主要以煤、石油、天然气动植物有机物存在,无机物矿藏中主要有石灰石(碳酸钙)、大理石(碳酸钙)、白云石33MgCO CaCO ?、菱镁矿3MgCO 等,空气中存在约0.03%的二氧化碳。
碳主要有C 12、C C 1413,三种同位素。

碳族元素知识点总结碳族元素的化学性质碳族元素的化学性质主要表现为它们的共价化合物。
由于这些元素外层电子结构的相似性,它们通常都具有4个价电子。
因此,这些元素可以形成类似的共价键结构,比如碳的四价、硅的四价等。
碳族元素共有6个电子,其中4个价电子。
另外2个电子则位于轨道的内层能级。
碳族元素形成的共价化合物具有一些共同的特点。
首先,它们的共价化合物通常是非极性分子,具有较强的共价键而不具有明显的电性差异。
其次,这些元素形成的化合物多为四配位结构,如CH4、SiH4、GeH4等。
此外,由于这些元素的大部分化合物都是非金属,因此它们的氧化状态多为正的。
碳族元素的物理性质碳族元素的物理性质也有很多共同之处。
首先,这些元素在常温下大多呈非金属性质,如碳为固体,硅为固体,锗为固体,锡为固液混合体,铅为液体。
此外,碳族元素的硬度逐渐增加,从碳的较硬的金刚石到锡、铅的较软的性质。
另外,碳族元素的密度也逐渐增加,从碳的2.26g/cm³到铅的11.34g/cm³。
此外,这些元素的熔点和沸点也随着原子序数的增加而增加,硅的熔点为1414℃,铅的熔点为327.5℃。
碳族元素的地球化学意义碳族元素具有重要的地球化学意义。
首先,碳族元素在地壳中广泛分布,如硅占地壳质量的27%。
其次,碳族元素在地球的物质循环中起着重要作用,如碳的存在形式有石墨、石英、石英等。
此外,碳族元素还是地壳中一些矿物的主要成分,如石英、硅铁矿等。
除了在地壳中的分布之外,碳族元素还在地球的化学演化中发挥重要作用。
如碳的生物地球化学循环和碳酸盐的形成等。
此外,碳族元素还在地球的构造和动力地质学过程中发挥着重要作用。
碳族元素的应用碳族元素在工业上有着重要的应用。
首先,碳族元素大多可以形成不同种类的化合物,这些化合物具有重要的工业用途。
比如碳的金刚石和石墨在工业上有着广泛的应用,锡在锡制品和合金中有重要的应用。
其次,这些元素的化合物也在冶金和材料领域有着广泛的应用。

非金属及其化合物第一节碳族元素一、C6号元素,,常见的单质有金刚石、石墨、C60等。
①.金刚石,无色透明晶体,属原子晶体,是天然物质中硬度最大的物质,其熔沸点也很高,不导电。
晶体中每个碳原子和相邻的4个碳原子形成碳碳单键,键角均为109度28分,晶体中最小的环为六元环,碳碳键的总数为碳原子总数的2倍。
②.石墨,灰黑色固体,属混合型晶体或过渡型晶体,兼有原子晶体、分子晶体和金属晶体的性质。
硬度较小但熔沸点很高,熔点比金刚石还高,导电性好,晶体为层状结构,层间靠分子间作用力结合,层内每个碳原子和相邻3个碳原子形成单键,键角为120度,碳原子数、碳碳键数、6元环数之比为2︰3︰1,每个碳原子还有一个自由电子,因此石墨晶体还有金属晶体的导电性。
③.C60,俗称足球烯,是富勒烯中的一种,名称中有烯,但不属于烃。
分子晶体,室温下是紫红色固体,硬度小,熔沸点低,可溶于苯等溶剂,不导电,但用途之一是制超导体。
分子内每个碳原子通过单键或双键和另外3个碳原子结合,整个分子由12个五边形和20个六边形构成,形状似足球。
分子中共有碳碳单键60个,碳碳双键30个。
④碳的单质中还有一些不太纯净的无定形碳,如木炭、焦炭、活性炭等。
2.碳的几种同素导形体的物理性质差别很大,但其化学性质相似,往往不加以区分,均以C表示。
碳的化学性质主要表现为稳定性和还原性,常温时较稳定,加热时表现还原性:①2C+O2(不足) 2CO,C+O2(足量) CO2,2;△②C+2H2SO 4(浓)△CO2↑+ 2SO2↑+2H2O,C+4HNO3(浓)△CO2↑+ 4NO2↑+2H2O;③2CuO+C△2Cu+ CO2,SiO2+2C Si+ 2CO。
有时碳也能表现氧化性,如Si+C SiC,或发生歧化反应,如CaO+3C CaC2+CO↑。
3.金刚石用于钻探、切割、激光发生器、做装饰品等;石墨用于电极材料、高温润滑剂等;C60用于超导等新材料的研发方面。


高中化学碳族元素的知识点总结碳族元素是周期表中的第14族,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和麦家(Ja)。
碳族元素具有一些共同的性质和特征,下面将对碳族元素的知识点进行总结。
1.原子结构:碳族元素的原子结构特点是外层电子壳的电子数量为4个。
每个碳族元素的原子内核都有与其电子数相等的质子数,电荷中和,具有相应的原子序数。
电子层的排布为[2,8,4],其中两个内层电子属于填充内层,而最外层电子属于价电子。
2.定位和周期性:碳族元素位于第2周期,是元素周期表中的第14组。
它们具有相似的化学性质,因为它们有相同数量的价电子,并且在化学反应中容易失去或获得4个电子。
3.物理性质:碳族元素的物理性质有一定的规律性。
随着原子序数的增加,原子半径逐渐增加,原子核对外层电子的束缚减弱,电子云容易发生形变。
此外,碳族元素的密度、熔点和沸点也随着原子序数的增加而递增。
4.化学性质:碳族元素的化学性质主要由它们的外层电子配置所决定,其中最外层电子的数量为4个。
碳族元素常发生+4价和-4价两种价态。
在化合物中,它们通常与其他元素形成共价键或离子键。
5.碳的性质:以碳为代表的碳族元素是生命中的基础元素,生物分子的骨架和结构都以碳为主要构成部分。
碳的共有4个价电子,因此形成氧化态及共价化合物较为常见。
碳的同素异形体分子和同系物在化学反应中具有独特的性质和活性。
6.半金属元素:碳族元素中的硅,被认为是一种半金属元素。
硅的特点是中等电负性、半导体特性和热稳定性较好。
硅在电子学和材料科学领域有广泛的应用,如制备半导体器件和太阳能电池。
7.其他碳族元素:除碳和硅外,锡、铅和麥家也是碳族元素。
锡和铅是广泛使用的金属,它们常用于制备合金。
麦家是放射性元素,具有高毒性和放射性衰变的特点。
8.化合物和应用:碳族元素形成的化合物具有多样性和广泛的应用。
例如,碳形成的化合物包括有机化合物(有机化学的基础)、无机化合物(如碳酸盐)和碳化物(如硅碳化物)。
第十三章碳族元素一、碳单质及其化合物1.碳单质(1)碳的同素异形体碳有金刚石、石墨和C60等同素异性体。
无定形炭(如木炭)本质上都是纯度不等的石墨微晶。
金刚石的外观是无色透明的固体,为原子晶体,每个碳原子都以sp3杂化轨道和其他四个原子形成共价键,形成一种网状的巨形分子,再由于C—C键的键能相当高,使得金刚石的硬度非常大,分子中没有自由电子,不导电;在工业上可用于刀具来切割金属及制造高档装饰品。
石墨是碳的另一种固体单质,石墨很软,呈灰黑色,密度较金刚石小,熔点比金刚石低。
碳原子的p x轨道互相平行,均垂直于分子平面,在层内形成共价键。
有离域π电子,所以石墨导电。
由于层间的分子间作用力小。
易滑动,所以石墨有润滑性。
20世纪80年代中期,人类发现了第三种晶体形态——碳原子簇,在这类碳原子簇中C60的稳定性最好,60个碳原子构成近似球形的32面体,称为足球烯。
(2)碳单质的还原性碳单质最重要的化学性质就是它的还原性,涉及的反应有2.碳的含氧化合物(1)一氧化碳CO是无色、无臭的气体,不助然,但能自燃,在水中溶解度很小,CO的毒性很大,与血液中的血红蛋白结合,使其失去载氧能力。
CO的主要性质是加合性和还原性。
生成少量的黑色金属钯,可以利用此反应检出CO。
(2)二氧化碳CO2是无色、无臭、不能燃烧的气体。
高度冷却下,CO2凝结为白色雪状固体,压紧成块状的CO2固体称为“干冰”,常用作制冷剂,CO2是直线型分子。
CO2可制造干冰灭火器,但不能扑灭燃烧的Mg,原因是CO2与Ca(OH)2或Ba(OH)2溶液反应,被用来鉴定CO2或除去气体中的CO2。
(3)碳酸和碳酸盐所有碳酸氢盐溶于水。
正盐中只有铵盐、铊盐和碱金属的盐溶于水。
其他金属的碳酸盐都是难溶的,对于这些盐来说,它们的酸式盐要比正盐的溶解度来的大。
碳酸盐具有热不稳定性,其受热分解的难易程度与阳离子的极化作用有关,热稳定性顺序为M2CO3>MHCO3>H2CO3二、硅单质及其化合物1.单质硅(2)硅酸和硅酸盐硅酸的形式很多,可以用通式xSiO2·H2O表示。
无机化学龚孟濂碳族元素《无机化学:龚孟濂碳族元素》第一章概述1.1 龚孟濂碳族元素的研究背景龚孟濂碳族是一组精细而复杂的元素,其中包括大环状碳环状结构,大碳环结构,小碳环结构,二环状碳结构,三环状碳结构等。
它们是一种稳定的分子结构,有机化学研究者已经裂变发现他们之间的化学关系,其中新元素的化学特性在近年来迅速增长。
因此,龚孟濂碳族元素的研究非常重要,可以为有机化学和环境化学提供重要的基础理论和实验数据。
1.2 龚孟濂碳族元素的化学特性在化学反应中,龚孟濂碳族元素的行为类似于普通碳族元素,但具有更高的反应性。
这一特点使它们成为重要的有机合成原料和生物活性化合物的有效原料。
龚孟濂碳族元素也具有分子量较低的特性,这使得它们更易于在更小的分子量中构建功能结构。
另外,龚孟濂碳族元素的大环状碳环结构具有较低的共价能。
因此,它们具有很好的溶解性,可以用作药物载体,疗法介质和血液中的抗体和细胞组分的分子胆固醇类抑制剂等。
第二章龚孟濂碳族元素的分子结构及其变化2.1 龚孟濂碳族元素的分子结构龚孟濂碳族中的大环状碳环结构是主要的结构类型。
它们通常有一到三个碳原子组成,且上下两个碳原子间的连接纽带有可能呈现稳定的半环形状。
在加入其他元素的情况下,将可能引起碳链上出现新的碳原子和其他元素,从而使碳链的形状发生变化。
2.2 龚孟濂碳族元素的反应性龚孟濂碳族元素具有很高的化学反应性,在反应过程中可以迅速形成复杂的有机化合物。
其反应性可以进一步催化其他物质的交联,形成新的抗原或受体分子。
在有机合成过程中,龚孟濂碳族元素可以在反应中起到非常重要的作用,从而增强有机合成的效率和活性。
13.1碳及其化合物1、单质(1)金刚石金刚石(俗称钻石)为原子晶体,每个碳原子均以sp3杂化状态与相邻的四个碳原子结合成键,形成正四面体构型、空间网状结构的原子型晶体。
其熔沸点高,硬度大(所有物质中硬度最大,莫氏硬度为10),难溶于溶剂,不导电,化学性质不活泼。
几乎对所有化学试剂显惰性,但在空气中加热800℃以上燃烧CO2。
(莫氏硬度:又名莫斯硬度,表示矿物硬度的一种标准。
1812年由德国矿物学家莫斯(Frederich Mohs)首先提出。
应用划痕法将棱锥形金刚钻针刻划所试矿物的表面而发生划痕,用测得的划痕的深度分十级来表示硬度:滑石1(硬度最小),石膏2,方解石3,萤石4,磷灰石5,正长石6,石英7,黄玉8,刚玉9,金刚石10,硬度值并非绝对硬度值,而是按硬度的顺序表示的值。
)金刚石有各种颜色,从无色到黑色都有,以无色的为特佳。
它们可以是透明的,也可以是半透明或不透明。
多数金刚石大多带些黄色。
金刚石的折射率非常高,色散性能也很强,这就是金刚石为什么会反射出五彩缤纷闪光的原因。
金刚石在X射线照射下会发出蓝绿色荧光。
1977年12月21日,在山东省临沭县常林大队,女社员魏振芳发现1颗重158.786克拉的优质巨钻----中国最大的金刚石,全透明,色淡黄,可称金刚石的“中国之最”。
被命名为“常林钻石”.(约鸡蛋黄大小,右图)。
世界上最大的工业用金刚石和宝石级金刚石均产于巴西,都超过3100克拉(1克拉=200毫克)。
现在人造金刚石已经广泛用于生产和生活中,虽然造出大颗粒的金刚石还很困难(所以大颗粒的天然金刚石仍然价值连城),但是已经可以制成了金刚石的薄膜、金刚石小晶体。
常林钻石用途:金刚石是自然界中最坚硬的物质,因此也就具有了许多重要的工业用途,如精细研磨材料、高硬切割工具、各类钻头、拉丝模。
还被作为很多精密仪器的部件。
关于人造金刚石:直接法人造金刚石或利用瞬时静态超高压高温技术,或动态超高压高温技术,或两者的混合技术,使石墨等碳质原料从固态或熔融态直接转变成金刚石,这种方法得到的金刚石是微米尺寸的多晶粉末。
1、碳的含氧化合物(1)CO:分子轨道表示式(σs1)2(σ*s1)2(σs2)2(σ*s2)2(πyp2)2(πzp2)2(σxp2)2①CO是一种无色无味的气体,不与水作用,属于中性氧化物。
CO可与血液中的血红素结合生成羰基化合物,使血液失去运送氧的功能,因此CO对动物是有剧毒的。
②性质:a、还原性CO可以还原溶液中的PdCl2,将CO通入PdCl2溶液立即生成黑色沉淀CO+ PdCl2+ H2O CO2+2HCl+Pd↓此反应十分灵敏,常用于CO的定性检验。
CO为冶金工业上的重要还原剂。
它在高温下可以使许多金属氧化物还原,用于金属工业制备。
例:Fe2O3 + 3CO = 2Fe + 3CO2b、配合性CO作为一种配体,能与许多过渡金属结合生成羰基配合物,如Fe(CO)5、Ni(CO)4、Co2(CO)8等,这些羰基配合物的生成、分离、加热分解是分解制备这些高纯金属的方法之一。
Fe+5CO[ Fe(CO)5]羰基配合物一般是剧毒的。
CO与CuCl的酸性溶液的反应进行得很完全,可以用来定量吸收CO:CO+CuCl+2 H2O Cu(CO)Cl·2 H2O③制备:a、工业制备:高温下炭与水蒸气的反应,或炭的不完全燃烧高温C+ H2O(g)H2+CO2C+O22COb、实验室制备:用浓硫酸使甲酸脱水制得少量CO浓H2SO4HCOOH CO↑+ H2O将草酸晶体与浓硫酸共热,将生成的混合气体通过固体NaOH,吸收掉CO2和少量的水汽得到纯净的CO:H2C2O4CO2↑+CO↑+ H2O(2) CO2①常温常压下无色无味气体,无毒,但大量的CO2可令人窒息。
空气中CO2体积分数为0.03%,人呼出的气体中CO2的体积分数约为4%。
微溶于水(1∶1),常温下饱和CO2溶液浓度为0.03-0.04 mol·dm-3。
CO2在5.2atm、-56.6℃时冷凝为雪花状的固体,称为干冰。
干冰易升华,常用作制冷剂。
第13章碳族元素来自山东大学2010级化基某同学一、本章要点难点(1)碳的单质(2)碳的氧化物与含氧酸盐(3)分子筛(4)锡、铅的化合物二、章节设置介绍13.1碳族元素概述13.2碳及其化合物13.3硅及其化合物13.4锗锡铅及其化合物三、本章学习目的1、明确物质结构部分知识在本章中的运用,熟练掌握相关元素知识2、能够运用所学知识解释生活生产中的现象写在前面——小结与心得:1.通过这次备课笔记中的制作,切身体会到在因特网上和教材浩如烟海的资料中仔细寻找、查证的困难与艰辛,为弄懂一个小的知识点,也需要翻好几本参考书、搜索多次网页才可能找到一个合适的解释;体会到自然科学领域的严谨的同时,也对“真理”有了新的理解。
2.关于章节设置及每节内容设置,我的想法是首先应由单质到简单化合物再到复杂化合物,研究其相似性的同时兼顾差异的存在;对某一具体元素,应分别研究其原子结构及成键特性、单质结构及性质、各种常用化合物及性质;在对某种物质进行学习时,要果断选择对生产生活有重要影响的方面仔细理解记忆,对生僻的知识善于省略,而同时又要求当需要相关知识时能迅速查到并结合以前所学知识加以运用。
3.关于在备课笔记中融入自己的想法,我的理解是既包含对本章的整体把握,又有对每一节、每一知识点的细节安排,在这个过程中通过对来自各个不同来源的知识加以整合处理而形成一套自己的体系,便可以说已经有部分自己的看法。
虽然目前为止,对现象产生一个完全属于自己的解释还是有一定困难的,但我相信随着学习的不断升入,对各种方法原理的运用定会更加成熟,从而可以对部分现象有自己的看法。
4.学得越多,进而发现自己不懂得越多,所以,一定要努力学习好各方面知识,不仅仅是本专业知识,其他通用能力也是需要掌握的。
13.1碳族元素概述碳族元素(Carbon group)指的是元素周期表ⅣA族的所有元素,包括碳(carbon,C)、硅(silicon,Si)、锗(germanium,Ge)、锡(tin,Sn)、铅(lead,Pb)五种。
碳族元素预习笔记一、碳族元素通性1、原子结构性质⑴相似性:•外层电子构型:ns²np²气态氢化物的通式:RH4最高价氧化物对应的水化物通式为H2RO3或R(OH)4⑵递变性•+2价化合物主要氧化态稳定性:由上至下逐渐增强+4价化合物主要氧化态稳定性:由上至下逐渐减弱但铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。
•熔沸点降低(锡和铅反常),单质密度逐渐增大•金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致)•最高价氧化物对应水化物的酸性减弱(最高价氧化物对应的酸举个例子解释:碳酸H2CO3。
(HO)2-CO连接一个氧原子,氧原子强吸电子作用导致碳原子电子云密度下降,对应的碳原子同样要从羟基上边多取电子,那么最终结果就是羟基氧原子再把和氢原子公用的电子对拉向自己。
那么此时氢原子是缺电子的,就会很容易电离。
氢原子越缺电子越容易电离;那么对应的中心原子越吸电子,氢原子就越缺电子。
所以从上到下,元素原子电负性减弱,吸电子能力减弱,自然氢离子电离能力减弱,酸性减弱。
)•氢化物的稳定性减弱•第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子)特殊:锡<铅•熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体)二、元素的成键特性⒈碳:①共价键(sp:CO sp²:乙烯 sp³:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧可形成多种有机化合物。
②以碳酸盐的形式存在于自然界中2.硅:①硅氧四面体形式存在(石英,硅酸盐矿)②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4)②共价键(+4氧化态,SnO、PbO2)二、碳及其化合物1.单质(三种同素异形体)①金刚石:结构:sp³杂化,原子晶体,五个碳原子构成正四面体性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透明,不导电,化学惰性,但800°C以上与空气反应成CO2②石墨:结构:sp²杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π键层与层之间靠分子见作用力结合在一起。
性质: 灰黑色,硬度小,熔沸点低于金刚石;化学惰性,500°C可被空气氧化成CO2,也可被浓热HClO4氧化成CO27C+4HClO4=2H2O+2Cl2↑+7CO2↑良好导电性(因为每个碳原子均为sp2杂化,并贡献剩余一个p轨道上的电子形成大π键,π电子可以自由移动)润滑剂(同一层晶面上碳原子间通过共价键结合,层与层之间以分子间作用力结合,由于层与层之间的作用力很小,故很容易在层间发生相对滑动。
因为这些结构上的特点,导致它的强度、硬度很低,可以起到很好的减磨作用)③足球烯(主要介绍C60):结构:C原子形成12个五元环和20个六元环,每个C与3个C形成3个σ键,还有一个π6060的大π键。
应用:嵌入过渡金属元素(特别是稀土元素)合成高温超导材料2.、碳的氧化物(1)CO①物性:无色无味气体,中性氧化物,有剧毒(CO可与血液中的血红素结合生成羰基化合物)②化性:还原性a.CO通入PdCl2溶液可立即生成黑色沉淀,可用于CO的定性检验。
CO+PdCl2+H2O==CO2↑+2HCl+Pd↓(此反应常用于CO的定性检验)b.冶金工业上CO是重要的还原剂FeO+CO=Pd+CO2(加热) 加合性a.与Fe、Ni、Co等过渡金属合成羰基化合物,分离,加热分解是制备高纯度金属的方法③制备:工业 C+H2O=H2+CO(加热)实验室 HCOOH=CO↑+H2O(浓硫酸)CO的分子轨道能级,形状和电子分布⑵CO2 ①物性:无色无味气体,固体称为干冰,可溶于水,饱和溶液浓度在0.03~0.04mol/dm-3不助燃(灭火)②化性:CO2+2Mg=2MgO+C(不能扑灭染着的镁)③鉴定:CO2+Ca(OH)2=CaCO3↓+H2O④制备:工业 CaCO3=CaO+CO2↑(加热)实验室 CaCO3+2HCl=CaCl2+CO2↑+H2O3.碳酸及其盐⑴碳酸:CO2的水溶液,弱酸(CO2在水中主要以水合分子形式存在,只有极少部分生成H2CO3,碳酸为中强酸,水合二氧化碳与碳酸浓度比约为600,PH~4)⑵碳酸盐①难溶的正盐酸式盐溶解度较大,易溶的正盐酸式盐溶解度较小。
NaHCO3比Na2CO3难溶。
(HCO3—离子在它们的晶体中通过氢键结合成链使可溶性的碳酸氢盐的溶解度小于正盐的。
)②阳离子的计划性和变形性越大,碳酸盐热稳定性越低;正盐比酸式盐稳定。
Na2CO3>MgCO3>Al2(CO3)3 BeCO3<MgCO3<CaCO3<SrCO3<BaCO3正盐比酸式盐稳定(是因为H+是正电荷、小半径的离子,电荷密度集中,H+的反极化作用削弱了C—O键,使得HCO3-不稳定。
比如NaHCO3热稳定性差,而Na2CO3热稳定性好)③碳酸盐均易水解三、硅及其化合物1.单质(无定形态,晶体)①物性:熔沸点高,硬而脆,灰色,金属外貌②化性 a.常温下溶于碱液:Si+2OH-+H2O=SiO32-+2H2↑Si+4OH-=SiO44-+2H2↑b.与金属和非金属反应:2Mg+Si=Mg2SiSi+Cl2=SiCl4(400°C)Si+O2= SiO2Si+C=SiC (2000°C)3Si+2N2=Si3N4(1000°C)Si+2S =SiS2(高温)2Mg+Si=Mg2Sic.硅遇氧化性酸发生钝化,可溶于HF-HNO3的混合酸中:3Si+4HNO3+18HF=3H2SiF6+4NO+8H2O硅与氢氟酸:Si+4HF=SiF4+2H2↑d.高温下与水蒸气反应:Si(s)+3H2O(g)=H2SiO3(s)+2H2(g)(加热)③制备(粗硅) SiO2+2C=Si+2CO↑(加热)SiCl4+2Zn=Si+2ZnCl2(加热)SiO2+CaC2=Si+Ca+2COSiH4=Si+2H2(加热)2.二氧化硅——二氧化硅不与水反应,即与水接触不生成硅酸,但人为规定二氧化硅为硅酸的酸酐①结构:Si与O以四面体形式连接在一起,形成原子晶体②物性:溶沸点高(SiO₂中Si—O键的键能很高),无色,难溶于酸(氢氟酸及热浓磷酸除外)③化性:能溶于热碱 SiO2+2NaOH=Na2SiO3+H2O能溶于氢氟酸 SiO2+6HF=H2SiF6+2H2O(玻璃容器不能盛放浓碱溶液和氢氟酸;S i O O O O盛碱的试剂瓶不能用玻璃塞而用橡胶塞的原因,可以用橡皮塞存放)在高温下,二氧化硅能被碳、镁、铝还原:SiO ₂+2C=Si+2CO↑若c 过量,则发生反应:Si+C= SiC (金刚砂)(高温)注:SiO ₂是表示组成的最简式,仅是表示二氧化硅晶体中硅和氧的原子个数之比3.硅酸及其盐⑴硅酸(正硅酸 H 4SiO 4;焦硅酸 H 6SiO 7;偏硅酸 H 2SiO 3;二偏硅酸 H 2SiO 5)性质:二元弱酸,溶解性小,PH≥14时,主要以SiO32-形式存在;PH 在11~13.5之间,主要以Si2O52-存在;PH<11缩合成较大同多酸根离子;PH 再低时,以硅酸凝胶析出;PH=5.8,胶凝速率最快。
⑵硅酸盐①溶解性:除碱金属硅酸盐可溶外,其它皆难溶。
常用的为可溶盐为Na 2SiO 3水溶液,又称为水玻 璃、泡花碱。
长期贮放NaOH 、Na 2CO 3的瓶子不用玻璃塞,而用橡胶塞。
②硅酸盐的水解:SiO 32-水解呈碱性,若在其中加入NH 4+ 或通入CO 2则会发生完全水解:SiO 32- + 2NH 4+ + 2H 2O → H 2SiO 3↓ + 2NH 3·H 2OSiO 32- +2CO 2+2H 2O==H 2SiO 3+2HCO 3ˉ用途:Na2SiO3常做黏合剂,黏合瓦楞纸,洗涤剂添加物③常见硅酸盐组成结构结构:a.单聚硅酸根 单个的硅氧四面体,Si:O=1:4正硅酸根 SiO 44-b. 二聚硅酸根 两个硅氧四面体通过共用一个氧原子连结起来,Si:O=1:3.5焦硅酸根 Si 2O 76-c.链聚硅酸根 许多硅氧四面体连结成无限长的链,相邻两个硅氧四面体共用1个氧原子。
阴离子硅酸根链之间分布着带正电的金属离子,靠静电引力使链结合在一起,这类硅酸盐具有纤维状结构,如石棉[Si n O 3n+1](2n+2)-d.片状聚硅酸根 每一个硅氧四面体通过共用3个氧原子分别与邻近3个硅氧四面体连结,形成片层状结构,片层之间靠金属离子的静电引力结合在一起,如云母e.网络状聚硅酸根 硅氧四面休间通过共用 4 个氧原子而组成各种三维网络结构。
如果在某个硅氧四面体中有铝原子代替了硅原子,形成的铝硅酸根网络骨架中就带了负电荷,因此在骨架的空隙中必须有平衡骨架负电荷的阳离子存在。
如用作催化剂或催化剂载体的沸石分子筛f.分子筛——人工合成铝硅酸盐 自然界中存在的某些硅酸盐和铝硅酸盐具有笼形三维结构,可以有选择地吸附一定大小的分子,称为沸石分子筛。
优点:分子筛的选择性远远高于活性炭等吸附剂 四、锗、锡、铅及其化合物1.单质⑴锗①物性:半金属,结构与金刚石相同,有灰白色金属光泽,熔点1210k,硬度较大②化性(还原性):常温下不与氧反应,高温下被氧化;不与稀盐酸,稀硫酸反应,能被浓硫酸和浓硝酸氧化(GeO2.nH2O):Ge+2H2SO4+(n-2)H2O==Geo2·nH2O+2SO2↑Ge+4HNO3+(n-2)H2O==nGe2·nH2O+4NO2↑碱性溶液中能被氧化成锗酸盐:Ge+2OH- +H2O ==GeO32- +2H2↑③制备:含锗矿石→GeCl4→精馏提纯→GeO2→还原→Ge(超纯锗用区域熔融法制备,制造半导体的超纯锗纯度高达99.99999% )GeS2+3O2==GeO2+2SO2GeO2+4HCl==GeCl4+2H2OGeCl4+4H2O==GeO2+4HCl上面2步重复进行GeO2(纯)+2H2==Ge+2H2O碱溶液与锗的作用很弱,但与熔融的碱在空气中,能使锗迅速溶解⑵锡①物性:银白色金属,硬度低,熔点505k,表面有一层保护膜,在空气中和水中都能稳定存在同素异形体:灰锡←286K→白锡←434K→脆锡(α型) (β型)(γ型)金刚石型立方晶系四方晶系正交晶系合金:a.马口铁(Fe-Sn):制作水桶、烟筒等b.青铜(Cu-Sn)c.焊锡(Pb-Sn)②化性灰锡(α锡)<286K→白锡(β锡)>434K→脆锡,低温下锡的自行毁坏,称为锡疫Sn+O2=SnO2Sn+2X2=SnX4 (X=Cl,Br)Sn+2HCl=SnCl2+H2↑3Sn+8HNO3(稀)=3Sn(NO3)2+2NO↑+4H2O(与冷的极稀硝酸反应)Sn+4HNO3(浓)=H2SnO3+4NO2↑+H2O(与浓硝酸反应)Sn+2OH-+4H2O=Sn(OH)62-+2H2↑(与苛性碱溶液作用放出氢)Sn + H2SO4 = SnSO4 + H2↑Sn+4H2SO4(浓)=Sn(SO4)2 +2SO2 + 4H2OSnS + Na2S2→ Na2SnS3(棕色固体溶解在二硫化钠溶液中。