沪教版九年级化学上册3.1.3 原子结构 相对原子质量ppt课件
- 格式:ppt
- 大小:1.74 MB
- 文档页数:30







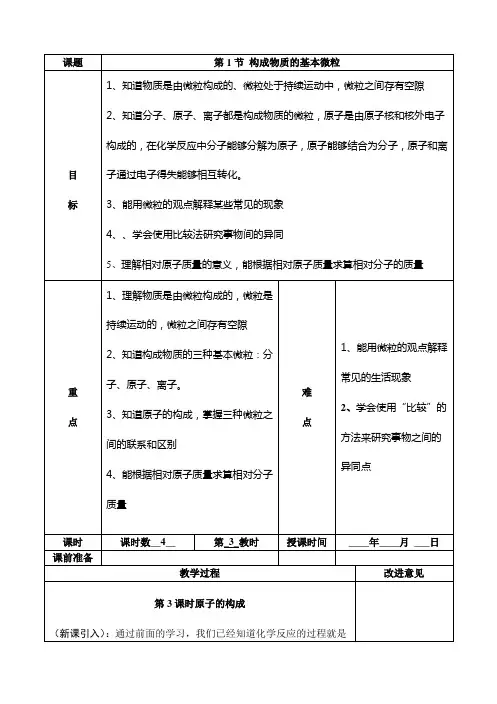
课题第 1 节 构成物质的基本微粒 1、知道物质是由微粒构成的、微粒处于持续运动中,微粒之间存有空隙2、知道分子、原子、离子都是构成物质的微粒,原子是由原子核和核外电子构成的,在化学反应中分子能够分解为原子,原子能够结合为分子,原子和离目子通过电子得失能够相互转化。
标3、能用微粒的观点解释某些常见的现象4、、学会使用比较法研究事物间的异同5、理解相对原子质量的意义,能根据相对原子质量求算相对分子的质量1、理解物质是由微粒构成的,微粒是持续运动的,微粒之间存有空隙2、知道构成物质的三种基本微粒:分1、能用微粒的观点解释重子、原子、离子。
常见的生活现象 难2、学会使用“比较”的方点3、知道原子的构成,掌握三种微粒之点间的联系和区别法来研究事物之间的异4、能根据相对原子质量求算相对分子同点质量课时 课前准备课时数__4__第_3_教时教学过程授课时间 ____年____月 ___日 改进意见第 3 课时原子的构成 (新课引入):通过前面的学习,我们已经知道化学反应的过程就是参加反应的物质的原子重新组合生成新的物质的过程。
那么不同的原 子(如氢原子和氧原子)有什么差异呢? (教师小结):上述问题的答案要从原子的内部去寻找,这就涉及到 又一个新的问题:原子能不能分成更小的微粒? (教师设问):你想象中的原子结构有哪些?(投影介绍):人类理解原子的过程:很早以前,在大家心目中的原子是一个没有内部结构的圆球。
但是,经过 20 世纪整整一个世纪的努力,科学家们不但打开了原子的大门,而且发现小小的原子内部结构复杂,构成原子的基本粒子已经发现了很多种,至今仍然在探索中。
人类对原子内部结构的理解是一部壮丽的史诗——1897 年汤姆生发现电子,说明原子并不是构成物质的最小粒子。
1911 年卢瑟福发现原子核。
(模拟探究):探究原子结构的奥秘:卢瑟福的α 粒子轰击金箔实验。
(问题与讨论):1、若质子质量,正电荷在原子内均匀分布,极少数α 粒子会发生大角度散射吗?____(填会或不会)。

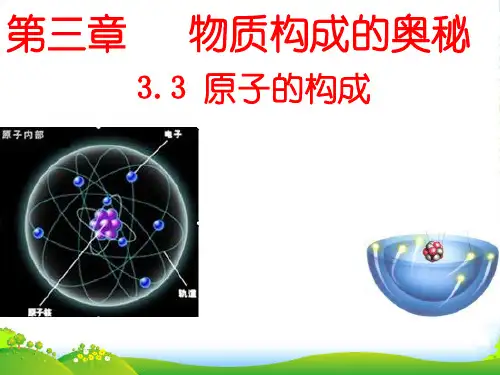
原子的结构(第一课时)1、知识与技能了解原子是由质子、中子和电子构成的利用图形、图示,化抽象为直观,初步学会使用类比、归纳、概括的方法收集和加工信息2、情感态度与价值观通过对微观世界的探索,增加学习化学的兴趣二:教学重难点1、教学重点原子构成微粒间的关系2、教学难点原子各构成微粒间关系式的应用三:教学过程1、新课导入PPT展示原子学说的发展过程,引导学生猜想原子核是否可分2、新课讲授知识点一:原子的结构提问:原子核是否可分学生:思考并回答展示:原子的微观结构图形和原子结构的相关数据学生:根据图示和原子结构相关数据描述原子构成提问:原子是否显电性?学生:思考并回答问题。
释疑:原子不显电性的原因展示:构成原子的各粒子带电情况归纳:核电荷数=质子数=核外电子数表格展示:碳、氢、氧、氟、氖、钠原子的构成微粒数由表格数据归纳:1、原子一般来说是由质子、中子、电子构成,但并不是所有原子核内都有中子(如氢);2.核外电子数=核内质子数=核电荷数;3.质子数不一定等于中子数;4.不同种原子的质子数不同;中子数可能相同。
知识点二:原子核外电子排布规律提问:绝大部分原子都不止一个电子,这些电子在原子核外是如何排列的呢?电子的排布有没有一定的规律呢?学生猜想与计论展示:核外电子的分层排布规律展示:原子结构示意图让学生猜想原子结构示意图上各数字和符号的含义,教师最后总结归纳展示:1——18号原子的原子结构示意图,学生分析计论,完成填空四:小结作业1、课堂小结梳理本课重点知识结构2、作业随堂练习并完成课后习题五:板书设计质子原子核中子原子核外电子原子核外电子排布规律:分层排布原子结构示意图六:教学反思成功之处:本课设计紧扣课程标准,教学方法选择较为适当,学生学习效果较好,课堂气氛较为热烈。
不足之处:教学基本功有待提升,师生互动较少。