酸碱盐氧化物关系
- 格式:ppt
- 大小:1.20 MB
- 文档页数:20

酸碱盐氧化物的概念并举例酸碱盐氧化物是一类重要的日常化学化合物,它们可以从影响我们生活和社会活动、工业中的诸多应用中看出其重要性。
那么,什么是这类化合物?它们又有什么特性?本文将对酸碱盐氧化物进行深入地剖析,并以一些具体实例来说明这类化合物的概念和特性。
首先要认识酸碱盐氧化物,需要明确它们的定义。
酸碱盐氧化物,也可以称为“加成性离子化合物”,其特征是氧原子由碱或酸中的一部分原子衍生,结果形成一个具有离子性质的化合物。
换句话说,这类化合物是由一个或多个带有正电荷离子(如氯离子、钾离子)和负电荷离子(如碳酸根)组成的化合物。
需要指出的是,酸碱盐氧化物的特质特性受到原子配位的影响,即该离子的配位性质。
要明白这一点,我们需要知道酸碱盐氧化物在氧化剂和受体之间的作用,以及它们之间的交互反应。
基本上,在酸碱盐氧化物的作用下,受体中的氧原子有可能会被氧化剂中的氧原子所替代,并形成新的离子,以及新的化合物。
要说明酸碱盐氧化物的概念,一些实例可以作为参考。
比如,氢氧化钠(NaOH)是一种重要的酸碱盐氧化物,它是由氢离子和碳酸根离子组成的化合物,结构表示如下:Na+ + OH- 。
同样,氯化钠(NaCl)也是一种重要的酸碱盐氧化物,它是由氯离子和碳酸根离子组成的化合物,结构如下:Na+ + Cl- 。
此外,硝酸盐是一种重要的酸碱盐氧化物,它是由两个元素氮和氧组成的混合物。
它主要由三种离子组成:氮离子(NO3-)、氯离子(Cl-)和钾离子(K+)。
硝酸盐的表示如下:NO3- +Cl- + K+ 。
最后,醋酸(CH3COOH)也是一种重要的酸碱盐氧化物,它是由两个元素碳和氧组成的混合物,其结构如下:H3COO- + H+ 。
总之,酸碱盐氧化物是一类重要的日常化学化合物,它们由一个或多个带有正电荷离子和负电荷离子组成的化合物,它们的性质特征受到原子配位的影响,它们是由氧化剂和受体之间的作用,以及它们之间的交互反应形成的。

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应,可归纳成下图来表示。
①金属+ 氧气?金属氧化物除Ag、Pt、Au外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,由酸转化成盐有四个途径:某些金属+ 某些酸?盐+ 氢气酸+ 碱性氧化物?盐+ 水酸+ 碱?盐+ 水酸+ 某些盐?另一种酸+ 另一种盐⑧酸?酸性氧化物+ 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨金属+ 非金属?无氧酸盐此处的非金属H2、O2除外。
当金属越活泼,非金属也越活泼时,反应就越容易进行。
⑩酸性氧化物+ 碱性氧化物?含氧酸盐(非初三知识)强酸(H2SO4、HNO3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物+ 酸?盐+ 水强酸(H2SO4、HNO3、HCl)可与所有碱性氧化物反应,弱酸(H2CO3、H2S等)只能和活碱、4参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+ 盐?另一种金属+ 另一种盐在金属活动性顺序里,排在前面的金属(K、Ca、Na除外)能把排在后面的金属从它的盐溶液里置换出来。
金属+ 酸?盐+ 氢气在金属活动性顺序里,排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性,跟金属反应时不会生成氢气,而是生成盐、水和其它气体。
除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体3除去Cu中的Fe,可将混合固体加入CuSO4溶液中,(Fe+CuSO4=Cu+FeSO4),然后过滤后取滤渣。
4除去Na2SO4溶液中的NaOH,可向溶液中加入适量的稀H2SO4溶液(2NaOH+H2SO4=Na2SO4+2H2O)5除去KCl溶液中的K2SO4,可向溶液中加入适量的BaCl2溶液(K2SO4+BaCl2=2KCl+BaSO4),然后过滤后取滤液。

酸碱盐氧化物氢化物的概念酸、碱、盐、氧化物和氢化物是化学中常见的基本概念,它们在化学反应和物质性质中起着重要的作用。
酸是指能够释放出氢离子(H+)的化合物或离子。
根据Arrhenius定义,酸能够在水中释放出H+离子。
例如,盐酸(HCl)在水中能够完全离解成氯离子(Cl-)和氢离子(H+)。
而根据Brønsted-Lowry定义,酸是能够给予质子(H+)的化合物或离子。
例如,硫酸(H2SO4)会给予水分子一个质子,生成氢离子(H+)和硫酸根离子(HSO4-)。
酸具有酸味、能腐蚀金属、能够与碱反应等特点。
碱是指能够释放出氢氧根离子(OH-)的化合物或离子。
根据Arrhenius定义,碱能够在水中释放出OH-离子。
例如,氢氧化钠(NaOH)在水中会完全离解成钠离子(Na+)和氢氧根离子(OH-)。
根据Brønsted-Lowry定义,碱是能够接受质子(H+)的化合物或离子。
例如,氨(NH3)会接受一个质子,生成铵离子(NH4+)。
碱具有苦味、涩味、能与酸反应等特点。
盐是由阳离子和阴离子组成的化合物。
在酸碱中和反应过程中,酸中的氢离子和碱中的氢氧根离子结合,形成水分子,同时生成盐。
例如,盐酸(HCl)和氢氧化钠(NaOH)在反应中生成氯化钠(NaCl)和水(H2O)。
同样,硫酸(H2SO4)和氨(NH3)在反应中生成硫酸铵(NH4HSO4)。
盐在化学中有很多重要的应用,例如用作调味品、消毒剂、肥料等。
氧化物是指含有氧元素的化合物。
氧化物通常是由氧原子与其他元素形成共价和离子键而形成的。
氧化物中的氧原子往往以氧离子(O2-)的形式存在。
氧化物可以分为酸性氧化物和碱性氧化物。
酸性氧化物是指能够与水反应生成酸的氧化物,例如二氧化硫(SO2)可以与水反应生成亚硫酸(H2SO3)。
碱性氧化物是指能够与水反应生成碱的氧化物,例如二氧化钙(CaO)可以与水反应生成氢氧化钙(Ca(OH)2)。
氧化物在工业生产中具有重要的应用,例如用作熔剂、催化剂等。

单质氧化物酸碱盐相互反应的规律性和特例1. 金属+金属→不反应,但可形成合金。
2. 非金属+非.金属→共价化合物如:P+Cl2、C+S、Xe+F2等反应。
特例:金刚石与石墨、红磷和白磷在一定条件下相互转化,生成物仍为单质,不是化合物。
3. 金属+非金属→无氧酸盐如:Fe + Cl2、Cu + Cl2、Na + S、Cu + S、Fe + S 等反应。
特例:2Na + H2=2NaH、3Mg + N2=== Mg3N2,NaH属氢化物,Mg3N2属氮化物,均不属盐类。
4. 金属+氧气→碱性氧化物如:Na、Mg、Cu 和 O2反应生成 Na2O、MgO、CuO。
特例:Na、Al、Fe在O2中燃烧,其产物 Na2O2属过氧化物,Al2O3属两性氧化物,Fe3O4是特殊的氧化物,确切讲是一种盐。
5. 非金属+氧气→酸性氧化物如:C、S、P 和 O2反应生成 CO2、SO2、P2O5。
特例:N2、C与O2反应生成的NO 、CO均不属于酸性氧化物,为中性氧化物。
6. 碱性氧化物+酸性氧化物→含氧酸盐如:CaO + CO2;CaO+SiO2(高温下);Na2O+P2O5等反应。
7. 碱性氧化物+水→碱如:Na2O、K2O、CaO、BaO、MgO(需热水)均可和水直接化合成碱。
特例:CuO、Fe2O3等不可直接和水反应。
8. 酸性氧化物+水→含氧酸如:SO2、SO3、P2O5等和水反应。
特例:SiO2不溶于水,NO2溶于水生成 HNO3和 NO等反应。
特例:3FeO+ 10HNO3(稀)=3Fe(NO3)3+NO +5H2OFe2O3+ 6HI= 2FeI2+I2 + 3H2O10.酸性氧化物+碱→盐+水如:CO2、SO2和NaOH反应生成Na2CO3和水及Na2SO3和水。
特例:CO2+ NaOH = NaHCO3、SO2.+ NaOH = NaHSO311.酸+碱→盐十水如:HCl + NaOH、H2SO4+Ba (OH)2、HNO3+ Ca(OH)2等。



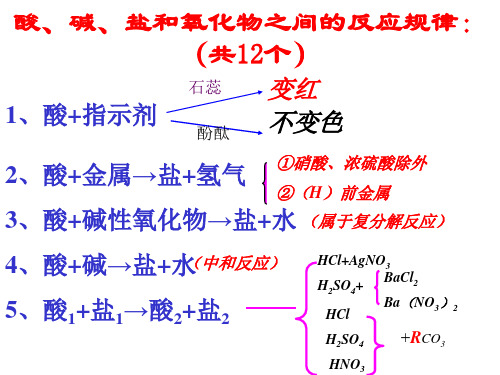
酸、碱、盐、金属、氧化物之间的反应规律一、活泼金属+酸→盐+氢气反应条件:1.金属位于金属活动顺序表中氢以前2.酸不能是硝酸、浓硫酸等强氧化性酸Fe+HCl一Mg+H2SO4一Al+H2SO4一Zn-十HCl一Cu+HCl一Mg+4HNO3==Mg(NO3)2+2H2O+2NO2↑二、金属氧化物+ 酸→盐+ 水Fe2O3 + H2SO4一FeO + HCl—CuO + HNO3—Na2O + HCl一三、酸+ 碱→盐+ 水HCl + NaOH —Fe(OH)3 + H2SO4一Cu(OH)2 + HNO3—Ca(OH)2 + HCl一四、盐+ 酸→新盐+ 新酸1.生成的新盐是不溶于新酸的沉淀AgNO3 + HCl一BaCl2 + H2SO4一2.碳酸盐都能与盐酸、硫酸、硝酸反应CO32-+ 2H+== CO2↑+ H2OCaCO3 + HCl—Na2CO3 + H2SO4一BaCO3+ HNO3—MgCO3 + HCl一五、非金属氧化物(CO2、SO2、SO3)+ 碱→盐+ 水CO2 + NaOH—SO2 + KOH—SO3 + NaOH—CO2 + Ca(OH)2—六、碱+ 盐→新碱+ 新盐反应条件:1.反应物中的碱和盐都能溶于水2.生成物中的新碱和新盐至少有一种是沉淀NaOH + CuSO4一NaOH + FeCl3—KOH + AlCl3—Ba(OH)2 + CuSO4一Ca(OH)2 + Na2CO3—NaOH + KNO3—七、金属+ 盐→新金属+ 新盐反应条件:1.金属比盐中所含的金属活泼2.反应物中的盐可溶于水3.能直接与水反应的金属除外(如:K、Ca、Na)Fe + CuSO4Cu + Hg(NO3)2—Al + CuSO4一Zn + AgNO3一Zn + MgSO4—Fe + AgCl —八、盐+ 盐→盐+ 盐反应条件:反应物中的两种盐均溶于水,生成物中的盐至少有一种是沉淀NaCl + AgNO3—K2SO4+ BaCl2一MgSO4 + K2CO3—Ba(NO3)2 + Na2SO4一BaCO3 + K2SO4一NaCl + KNO3。

九年级化学《酸碱盐氧化物》知识点总结一、酸碱盐的基本概念1. 酸的定义:能够放出H +离子的化合物称为酸。
根据以下的实验证明了上述定律:酸和碱可以互相中和,中和产生的产物是盐和水。
3. 盐的定义:酸和碱反应得到的产物称为盐。
4. 酸碱盐的化学变化式5. 水解反应方程式6. 分类(1)按离子化程度:强酸/弱酸;强碱/弱碱(2)按化学性质:有机酸/无机酸1. 酸碱指示剂的定义:能够根据pH值的变化,改变自身颜色的化合物称为酸碱指示剂。
2. 常见酸碱指示剂:三、氧化物1. 氧化物的定义:氧化物是由一个或多个氧元素与其他元素形成的化合物。
2. 氧化态:氧元素的氧化态通常为-2,与之结合的其他元素的氧化态都是正的。
3. 氧化剂和还原剂:氧化剂是指在氧化反应中能够发生氧化反应的化合物;还原剂是指在还原反应中能够发生还原反应的化合物。
4. 金属氧化物的酸碱性:金属氧化物为碱性氧化物,只能与酸发生中和反应,不能与碱反应。
四、化学反应方程式1. 化学反应的表示方法(2)化学反应式2. 化学反应方程式的基本要素:(1)反应物(2)产物3. 化学反应的原子守恒法则:在任何化学反应中,物质的质量量不会发生任何变化。
五、酸碱中和反应1. 酸碱中和反应的定义:酸和碱在一定量下反应,生成盐和水的反应称为酸碱中和反应。
2. 酸碱中和反应的实验现象:(1)酸碱反应时会伴随着水的生成,而有些酸碱反应在气体生成时也会伴随着水的生成。
(2)酸碱反应不是热反应,也不是爆炸反应,常常为剧烈的气体的生成。
(3)酸碱反应的影响:反应温度、反应物浓度、酸碱性质、溶液浓度。
六、溶液浓度表示法1. 溶液的基本概念:溶液是将溶质溶解在溶剂中形成的均相混合物。
(1)摩尔浓度(2)摩尔分数(3)体积浓度(4)质量浓度3. 溶液浓度表示法的计算方法(1)热的概念2. 热的单位3. 热的计算八、化学反应速率和化学平衡(1)化学反应速率和化学反应速度常数2. 化学平衡(3)化学平衡的移动。

单质、氧化物、酸、碱、盐相互转化规律一、氧化物:1.定义:由元素组成的并且含有的化合物叫氧化物。
2.分类:(1)按组成元素分类①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)(2)按化学性质分类①不成盐氧化物:(如:H2O、CO、NO、MnO2)②可成盐氧化物:Ⅰ、酸性氧化物;Ⅱ、碱性氧化物;Ⅲ、两性氧化物。
两性氧化物:是指既能与酸反应生成盐和水、也能和碱反应生成盐和水的氧化物(如氧化铝)。
如:Al2O3+ HCl= Al2O3+ NaOH=二、单质、氧化物、酸、碱、盐相互转化关系图作用1.确定各类物质的转化规律.⑴两条纵向关系:⑵四条横线:①金属+非金属= 盐;②碱性氧化物+酸性氧化物=盐;③碱+酸=盐+水;④盐+盐=盐+盐。
⑶四条交叉线:①碱性氧化物+酸=盐+水②酸性氧化物+碱=盐+水③碱+盐=新碱+新盐④酸+盐=新酸+新盐⑷两条折线:①活泼金属+酸(盐酸、稀硫酸)=盐+氢气②金属+盐=金属+盐2.确定各类物质的反应规律及其主要化学性质.以酸、碱、盐、氧化物为例说明它们具有哪些重要的化学性质?3.确定制取物质的可能方法。
例1:怎样制取烧碱的可能途径有哪些?写出有关反应的化学方程式。
例2:怎样制取MgCl2 ?写出有关反应的化学方程式。
(7种方法)练习:1.试用五种方法制备ZnSO4,写出有关反应的化学方程式。
①;②;③;④;⑤……2.从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)8种物质中选出4种,使得下图中各线条相连的物质均能反应生成难溶物。
将选出物质的化学式按要求填写在下图相应的方框中,并写出(1)(2)、(3)(4)的化学方程式。
(1)_______________________________;(2)_______________________________;(3)_______________________________;(4)。

酸碱盐氧化物是地球上最常见的物质,也是各种化学反应的主要参与者。
酸碱盐氧化物是指包含氧原子的离子结构的物质,它们的主要特征是可以与水反应,产生酸性或碱性反应。
酸碱盐氧化物的种类非常多,大致可以分为三类:酸性氧化物、碱性氧化物和中性氧化物。
酸性氧化物是指具有质子的氧化物,它们在溶液中可以把水分解为氢离子和氧离子,表现出酸性性质。
例如,硫酸和硝酸是常见的酸性氧化物,它们都能分解水,将水分解为氢离子和氧离子,从而表现出酸性性质。
碱性氧化物是指具有氧原子多余质子的氧化物,它们在溶液中可以把水分解为氢离子和氢氧离子,表现出碱性性质。
例如,氢氧化钠和氢氧化钾是常见的碱性氧化物,它们都可以将水分解为氢离子和氢氧离子,从而表现出碱性性质。
中性氧化物是指具有氧原子等于质子的氧化物,它们在溶液中不能分解水,表现出中性性质。
例如,氧化铝、氧化铬和氧化钼都是常见的中性氧化物,它们在溶液中不能分解水,表现出中性性质。
除了上述三大类酸碱盐氧化物外,还有其他类型的氧化物,如氢氧化硅、氧化氢氮和氧化磷等。
它们在某些情况下也具有酸碱性质,但一般情况下,它们都表现出中性性质。
总之,酸碱盐氧化物是地球上最常见的物质,它们的种类很多,可以分为酸性氧化物、碱性氧化物和中性氧化物三大类。
它们可以通过与水反应,表现出酸性、碱性或中性性质。

化合物分为酸碱盐氧化物的依据1. 化合物的基本概念好啦,今天我们来聊聊化合物,特别是酸、碱、盐和氧化物这几个大家伙。
首先,化合物就像一锅大杂烩,里面有不同的成分,但又都融合得很好。
比如说,水(H₂O)就是氢和氧的结合;而食盐(NaCl)则是钠和氯的好朋友。
说到这儿,大家可能会想:“这化合物有啥用呢?”嗯,真的是用途广泛,生活中少不了它们,就像锅里少了盐,菜也没味道了。
2. 酸的特征2.1 酸的定义先来说说酸。
酸就像那些脾气不太好的小朋友,碰到谁都能“咕咕”一声,尤其是在水里。
酸性物质能够释放氢离子(H⁺),这可是真正的“惹事精”。
咱们常见的酸有硫酸、盐酸、醋酸,听到这些名字是不是觉得有点陌生?其实,醋就是醋酸的民间称呼,平时咱们吃凉拌菜时都离不开它。
2.2 酸的性质酸还有个特征,就是能跟碱发生反应,形成盐和水。
就像一对欢喜冤家,打打闹闹最后却能和好。
这一过程叫做中和反应,酸碱中和后,原本的“火药味”变成了“温柔乡”,所以说,酸和碱真是不可分割的好搭档。
3. 碱的特征3.1 碱的定义再来聊聊碱。
碱可是酸的克星,它能接受氢离子,常常让酸感到不快。
比如,氢氧化钠(NaOH)就是咱们常用的强碱,做饭时用来清洗锅具,去油腻得可快了。
碱和酸的关系就像是“水火不容”,但其实它们有时又能互相补充,创造出新东西。
3.2 碱的性质说到碱,大家要知道,碱性物质在水里通常会变得滑滑的,摸上去有种“滑溜溜”的感觉。
喝了碱水可不是开玩笑的,太浓的碱水可会让你肚子不舒服。
不过,生活中适量的碱性物质却可以帮助中和过多的酸,就像生活中遇到困难时,总有朋友会来帮忙。
4. 盐的特征4.1 盐的定义然后就是盐,大家可能会想:盐不就是食盐吗?其实盐的种类可多了,食盐(NaCl)只是其中之一。
盐的形成一般是酸和碱反应后留下的“产物”。
就像一对情侣,打完架后,大家都不高兴,但和好之后,居然还生出了小宝宝(盐)!4.2 盐的性质盐的性质很有趣,它们在水中溶解后,能让水变得有味道,这就是我们爱吃的咸味。

氧化物酸碱盐相互关系竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2. 碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca,Mg 的氧化物可以。
)22Ca(OH)O H CaO ==+3. 碱−→−∆碱性氧化物+水;(除K,Na,Ba,Ca,Mg 的氢氧化物外一般都可以。
)()O H CuO OH Cu 22+==∆4. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)5. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+6. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
)3222CO H O H CO ==+7. 酸−→−∆酸性氧化物+水;(一般都可以,但硫酸不行。
) O H CO CO H 2232+↑==8. 酸――→盐(有三种方法);横的关系:1. 金属+非金属→盐(无氧酸盐); NaCl Cl Na 222点燃==+2. 碱性氧化物+酸性氧化物→盐(含氧酸盐); 32CaCO CO CaO ==+3. 碱+酸→盐+水(中和反应);()O H CuCl HCl OH Cu 22222+==+ 4. 盐+盐→新盐+新盐(△)()白色↓+==+AgCl NaNO NaCl AgNO 33斜的关系:1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+3. 碱+盐→新碱+新盐;(△)()()白色↓+==+33222CaCO NaOH CO Na OH Ca4. 酸+盐→新酸+新盐;(△)O H CO CaCl HCl CaCO 22232+↑+==+5. 金属+酸→盐+氢气;(★) ↑+==+2442H ZnSO SO H Zn6. 金属+盐→新金属+新盐。
(★) Cu Cu 44+==+FeSO SO Fe△ 生成物要有沉淀或气体或水。