酸 碱 盐 氧化物 化学式书写专题
- 格式:doc
- 大小:59.50 KB
- 文档页数:4

初中常见的酸碱盐单质氧化物的名称俗称化学式以及用途酸、碱、盐、单质和氧化物是化学中非常常见的概念。
下面我将分别为你介绍初中常见的酸、碱、盐、单质和氧化物以及它们的俗称、化学式和用途。
1.酸酸是指在水中能产生H+离子(氢离子)的化合物。
常见的酸有硫酸、盐酸、硝酸等。
-硫酸:俗称油酸,化学式H2SO4、用途包括工业生产和实验室试剂。
-盐酸:俗称盐酸,化学式HCl。
用途包括工业生产、实验室试剂和酸性清洁剂。
-硝酸:俗称透明液体,化学式HNO3、用途包括工业生产和实验室试剂。
2.碱碱是指在水中能产生OH-离子(氢氧根离子)的化合物。
常见的碱有氢氧化钠、氢氧化钾等。
-氢氧化钠:俗称苏打粉,化学式NaOH。
用途包括生产肥皂和清洗剂、调节土壤酸碱度。
-氢氧化钾:俗称烧碱,化学式KOH。
用途包括电镀、制备碱性燃料电池等。
3.盐盐是由金属离子和非金属离子组成的化合物。
通常分为无机盐和有机盐。
常见的无机盐有氯化钠、硫酸铜等。
-氯化钠:俗称食盐,化学式NaCl。
用途包括食品调味剂和消毒剂。
-硫酸铜:俗称蓝石,化学式CuSO4、用途包括电镀、杀菌剂和园艺等。
4.单质单质是由同种原子组成的物质。
常见的单质有氢气、氧气、氮气等。
-氢气:俗称氢气、氢,化学式H2、用途包括化学试剂、气体燃料和氢能源储存。
-氧气:俗称氧气、氧,化学式O2、用途包括呼吸、燃烧和氧剂等。
-氮气:俗称氮气、氮,化学式N2、用途包括气体保护、氮气充气和制备氨气等。
5.氧化物氧化物是指由金属和非金属元素组成的化合物,其中氧为阴离子,氧化态为-2、常见的氧化物有氧化铁、二氧化硅等。
-氧化铁:俗称赤铁矿,化学式Fe2O3、用途包括制备铁和红色颜料。
-二氧化硅:俗称二氧化硅,化学式SiO2、用途包括制备玻璃、陶瓷和电子元件等。
总结:初中常见的酸包括硫酸、盐酸、硝酸;常见的碱包括氢氧化钠、氢氧化钾;常见的盐包括氯化钠、硫酸铜;常见的单质包括氢气、氧气、氮气;常见的氧化物包括氧化铁、二氧化硅等。

中考化学酸碱盐专题复习一.酸、碱、盐的初步概念1 电离时生成的阳离子全部是氢离子的化合物叫做酸。
如 H2SO4、HNO3、HCl等都属于酸类.2 电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
如 NaOH、Ca(OH)2、Ba(OH)2等。
3 电离时生成金属离子和酸根离子的化合物叫做盐。
如 NaCl、KNO3、CuSO4·5H20等都属于盐类。
铵根离子虽不是金属离子,但因其具备金属离子的特征,因此铵根离子和酸根离子构成的化合物应属盐类。
二.酸性氧化物和碱性氧化物(1)金属氧化物大多为碱性氧化物,非金属氧化物大多为酸性氧化物.(2)碱性氧化物中只有 K2O、Na2O、BaO、CaO能与水化合生成可溶性碱;酸性氧化物如 CO2、SO2、SO3、P2O5等能与水化合生成对应的含氧酸。
(3)酸性氧化物与碱的反应可看作先是酸性氧化物与水化合生成含氧酸,含氧酸再与碱相互交换成分得出生成物,即:二、酸、碱、盐的性质1.酸的通性酸的通性。
酸的通性实质上是氢离子的性质。
方法指导:“通性"是指某类物质所共有的一般规律,是具有一定条件和运用范围的,“酸"──常用盐酸、稀硫酸,而不能用具有强氧化性的硝酸、浓硫酸,因为它们跟金属反应一般不生成氢气.2.酸溶液与酸性溶液酸溶液是酸的水溶液,酸性溶液是指呈酸性(PH<7)的溶液。
酸溶液一定呈酸性,但呈酸性的溶液其溶质不一定是酸。
有些盐溶液,如NaHSO4溶液、NH4Cl 溶液也呈酸性,也能使紫色石蕊试液变红.3.碱的通性碱在水溶液中电离生成的阴离子都是氢氧根离子,因而碱类都具有一些相似的化学性质,即碱的通性.方法指导:学习碱的性质时既要掌握OH—具有的一般规律即通性,又要明确不同的阳离子所具有的特殊性。
如 Ca(OH)2溶液能与Na2CO3溶液反应,而 NaOH溶液却不与 Na2CO3溶液反应。
4.难溶性碱如Cu(OH)2、Fe(OH)3等的特性(1)大多数难溶性碱受热容易分解,如:Cu(OH)2=CuO+ H2O 。


酸碱与盐的命名与化学式酸、碱和盐是化学中常见的三种化合物。
它们在我们的日常生活中扮演着重要的角色,不仅应用广泛,而且对我们身体的健康也具有重要影响。
本文将探讨酸、碱和盐的命名规则和化学式的表示方法。
酸的命名与化学式:酸是一种能够释放出氢离子(H+)的化合物。
根据酸所含有的元素种类和数量的不同,它们的命名方式会有所差异。
下面是几种常见的酸的命名规则和化学式表示方法:1. 一元酸(只含有一个非氧元素)当一个酸只含有一个非氧元素时,它的命名通常以“氢氧化物”结尾,并且以该元素名称的基础上加上“酸”来命名。
例如:- HCl:氯化氢(氢氧化物)- HF:氟化氢(氢氧化物)2. 二元酸(含有氧和另一个非氧元素)当一个酸含有氧和另一个非氧元素时,其命名方式有所不同。
通常情况下,酸的名称以“酸”结尾,并且以氧元素的数量来表示。
同时,非氧元素的名称会根据阴离子和阳离子的不同而有所变化: - H2SO4:硫酸(氧数为4)- HNO3:硝酸(氧数为3)3. 酸的化学式表示方法酸的化学式表示方法主要采用分子式来表示,即以元素符号表示酸中所含有的元素,并用下标数字表示元素的数量。
例如: - HCl:氯化氢- H2SO4:硫酸- HNO3:硝酸碱的命名与化学式:碱是可以与酸中的氢离子结合形成盐的化合物。
与酸相似,碱的命名方式也与其组成元素有关。
下面是几种常见的碱的命名规则和化学式表示方法:1. 金属氢氧化物当一个碱由金属与氢氧化物组成时,其命名方式通常以金属元素名称开头,并在后面加上“氢氧化物”来命名。
例如:- NaOH:氢氧化钠- KOH:氢氧化钾2. 短缺氧的非金属氢氧化物当碱由短缺氧的非金属元素和氢氧化物组成时,其命名方式与金属氢氧化物相似,以非金属元素的名称开头,并加上“氢氧化物”来命名:- NH4OH:氢氧化铵3. 碱的化学式表示方法碱的化学式表示方法与酸类似,采用分子式来表示。
以元素符号表示碱中所含有的元素,并用下标数字表示元素的数量。

酸(酸性氧化物)的反应一、酸(酸性氧化物)+碱(碱性氧化物)——盐+水Na2O+HCl——Fe2O3+HCl——FeO+HCl——Al2O3+HCl——Ca(OH)2+CO2(少量)——NaOH+CO2(少量)——二、酸(酸性氧化物)+盐——水/ 气体/ 沉淀三、强酸制弱酸强酸+ 盐== 新盐+ 弱酸1.除杂(洗气)CO2中混有少量SO2 (酸性H2SO3大于H2CO3)Na2HCO3+ SO2——H2SO3为何不用Na2CO3SO2中混有少量SO3 (酸性H2SO4大于H2SO3)Na2HSO3+ SO3——H2SO4为何不用Na2SO32. Ca(ClO)2的漂白原理(久置失效原因)Ca(ClO)2+CO2+H2O——3. 制H2SiO3Na2SiO3+CO2+H2O——Na2SiO3+HCl——4. 制备Al(OH)3(此时把Al(OH)3当作酸)NaAlO2+CO2+H2O——NaAlO2+HCl——四、氧化性酸(浓H2SO4、HNO3)的反应1、氧化性酸+金属(金属氧化物)——盐+氧化性酸的还原产物+水Cu+H2SO4(浓) △Cu+HNO3 (浓) ——Cu+HNO3 (稀) ——Fe+H2SO4(浓) △Fe+HNO3 (浓) △Fe+HNO3 (稀) ——过量Fe+HNO3 (稀) ——2、氧化性酸+C △CO2+氧化性酸的还原产物+水碱(碱性氧化物)的反应一、强碱制弱碱强碱+ 盐== 新盐+ 弱碱1、实验室制取Al(OH)3AlCl3+NH3·H2O——为何不用NaOH2、实验室制取NH3NH4Cl+Ca(OH)2——3、制备Fe(OH)3 或Fe(OH)2FeCl3+NaOH——FeCl2+NaOH——二、NaOH与Al(OH)3、Al2O3、Al的反应Al(OH)3+NaOH——Al2O3+NaOH——Al+NaOH+H2O——还有Si+NaOH+H2O——不稳定性一、弱碱△氧化物+水(化合价不变)Al(OH)3 △Fe(OH)3 △二、弱酸△氧化物+水(化合价不变)H2SiO3 △H2SO3 △三、发生氧化还原反应Fe(OH)2+O2+H2O——Fe(OH)3四、加热分解NaHCO3 △HClO △其他反应一、制O2Na2O2+CO2——Na2O2+H2O——H2O2——二、NO2、NO的反应NO +O2——NO2+H2O ——NO +O2+H2O——NO2+O2+H2O——三、Cl2Cl2+H2O——根据Cl2与H2O的反应原理,推测氯气与NaOH、Ca(OH)2反应的产物是什么? Cl2+NaOH——84消毒液Cl2+Ca(OH)2——漂白粉、漂粉精。

一、金属单质+ 酸-------- 盐+ 氢气(置换反应)1. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑2. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑3. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑4. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑二、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐1. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu2. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg三、金属氧化物+酸-------- 盐+ 水1. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O2. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O3. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O4. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O四、金属氧化物+碱-------- 盐+ 水1.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 2.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 3.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 4.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O5. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O五、酸+ 碱-------- 盐+ 水1.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O2. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O3.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O4. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O5. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O6.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O7.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O8.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O9.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O10.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O11.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O六、酸+ 盐-------- 另一种酸+ 另一种盐1.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑2.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑3.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑4.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO35. 碳酸氢钠和稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑6.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑7.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl七、碱+ 盐-------- 另一种碱+ 另一种盐1.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 2.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl 3.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl 4. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl5. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH6. 氢氧化钡与碳酸钠:Ba(OH)2+Na2CO3==BaCO3↓+2NaOH7. 氯化铵和氢氧化钠混合:NH4Cl+NaOH==NaCl+NH3↑+H2O8.氢氧化钡和硫酸铵混合: Ba(OH)2+ (NH4)2SO4 ==BaSO4↓+2NH3↑+2H2O 9. 氢氧化钙和硝酸铵混合:Ca(OH)2+ 2NH4NO3==Ca(NO3)2+2NH3↑+2H2O八、盐+ 盐----- 两种新盐1.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO32.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl3.硫酸钠和硝酸钡:Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO34.碳酸钠溶液和氯化钙溶液:CaCl2+Na2CO3==CaCO3↓+2NaCI一、金属单质+ 酸-------- 盐+ 氢气(置换反应)1. 锌和稀硫酸2. 铁和稀硫酸3. 铝和稀硫酸4. 铝和稀盐酸二、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐1. 铁和硫酸铜溶液反应:2. 铜和硝酸汞溶液反应:三、金属氧化物+酸-------- 盐+ 水1. 氧化铁和稀盐酸反应:2. 氧化铁和稀硫酸反应:3. 氧化铜和稀盐酸反应:4. 氧化铜和稀硫酸反应:四、非金属氧化物+碱-------- 盐+ 水1.苛性钠暴露在空气中变质:2.苛性钠吸收二氧化硫气体:3.苛性钠吸收三氧化硫气体:4.消石灰放在空气中变质:5. 消石灰吸收二氧化硫:五、酸+ 碱-------- 盐+ 水1.盐酸和烧碱起反应:2. 盐酸和氢氧化钾反应:3.盐酸和氢氧化铜反应:4. 盐酸和氢氧化钙反应:5. 盐酸和氢氧化铁反应:6.氢氧化铝药物治疗胃酸过多:7.硫酸和烧碱反应:8.硫酸和氢氧化钾反应:9.硫酸和氢氧化铜反应:10.硫酸和氢氧化铁反应:11.硝酸和烧碱反应:六、酸+ 盐-------- 另一种酸+ 另一种盐1.大理石与稀盐酸反应:2.碳酸钠与稀盐酸反应:3.碳酸镁与稀盐酸反应:4. 碳酸氢钠和稀盐酸反应:5.盐酸和硝酸银溶液反应:6.硫酸和碳酸钠反应:7.硫酸和氯化钡溶液反应:七、碱+ 盐-------- 另一种碱+ 另一种盐1.氢氧化钠与硫酸铜:2.氢氧化钠与氯化铁:3.氢氧化钠与氯化镁:4. 氢氧化钠与氯化铜:5. 氢氧化钙与碳酸钠:6. 氢氧化钡与碳酸钠:7. 氯化铵和氢氧化钠混合:8.氢氧化钡和硫酸铵混合:9. 氢氧化钙和硝酸铵混合:八、盐+ 盐----- 两种新盐1.氯化钠溶液和硝酸银溶液:2.硫酸钠和氯化钡:3.硫酸钠和硝酸钡:4.碳酸钠溶液和氯化钙溶液:。

高中化学方程式单质、氧化物、酸、碱、盐的关系小编高中化学方程式大全,将化学方程式分类汇总,内容有:化学方程式反应现象总结、酸碱盐的化学方程式、氧化还原反应方程式、分解反应方程式、物质与氧气的反应方程式、离子反应方程式和置换反应方程式等。
单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液) ------- 另一种金属+ 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O 硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO3硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO4 氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐+ 盐----- 两种新盐氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO3硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl。
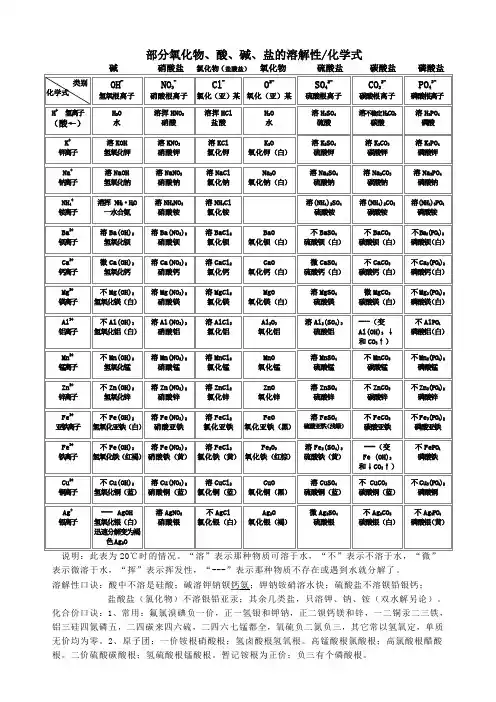
部分氧化物、酸、碱、盐的溶解性/化学式
表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了。
溶解性口诀:酸中不溶是硅酸;碱溶钾钠钡钙氨;钾钠铵硝溶水快;硫酸盐不溶钡铅银钙;
盐酸盐(氯化物)不溶银铅亚汞;其余几类盐,只溶钾、钠、铵(双水解另论)。
化合价口诀:1、常用:氟氯溴碘负一价,正一氢银和钾钠,正二钡钙镁和锌,一二铜汞二三铁,铝三硅四氮磷五,二四碳来四六硫,二四六七锰都全,氧硫负二氮负三,其它常以氢氧定,单质无价均为零。
2、原子团:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
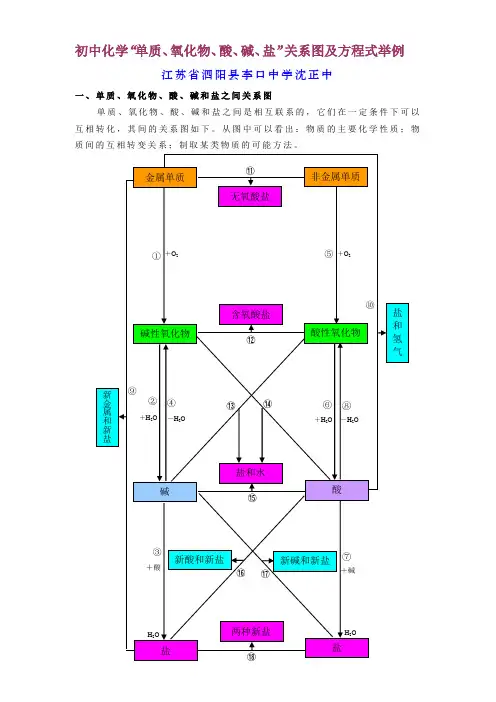
初中化学“单质、氧化物、酸、碱、盐”关系图及方程式举例江苏省泗阳县李口中学沈正中一、单质、氧化物、酸、碱和盐之间关系图单质、氧化物、酸、碱和盐之间是相互联系的,它们在一定条件下可以互相转化,其间的关系图如下。
从图中可以看出:物质的主要化学性质;物质间的互相转变关系;制取某类物质的可能方法。
二、单质、氧化物、酸、碱和盐之间关系方程式举例①金属单质+ O2→碱性氧化物2Mg + O2 点燃2MgO3Fe + 2O2 点燃Fe3O42Cu + O2△2CuO4Al + 3O2 点燃2Al2O3②碱性氧化物+ H2O →碱MgO+H2O Mg(OH)2CaO + H2Ca(OH)2Na2O + H22NaOHK2O + H22KOHBaO + H2Ba(OH)2④碱加热→碱性氧化物+ H2O2Fe(OH)加热Fe2O3+3H2OCu(OH)加热CuO+H2OMg(OH)加热MgO+H2O2Al(OH)加热Al2O3+3H2O⑤非金属单质+ O2→酸性氧化物2H2 + O2 点燃2H2O4P + 502 点燃2P2O5S + O2 点燃SO2C + O2 点燃CO22C + O2 点燃2COC + CO2高温2CO⑥酸性氧化物+ H2O →酸CO2 + H2H2CO3SO2 + H2H2SO3SO3 + H2H2SO4P2O5+H22HPO3P2O5+3H22H3PO43NO2+H22HNO3+NOH2SO4(浓度大于98%)加热H2O + SO3⑨金属单质+ 盐→ 新金属+ 新盐Fe + CuSO4Cu + FeSO4CuSO4ZnSO4 + Cu⑩金属单质+ 酸→ 盐+ 氢气Zn + H2SO4(稀) ZnSO4 + H2↑Mg + H2SO4(稀MgSO4 + H2↑2Al + 3H2SO4(稀) Al2(SO4)3 + 3H2↑Fe + H2SO4(稀) FeSO4 + H2↑Zn + 2HCl(稀ZnCl2 + H2↑Mg + 2HCl(稀) (稀MgCl2 + H2↑2Al + 6HCl(稀2AlCl3 + 3H2↑Fe + 2HCl(稀FeCl2 + H2↑⑪非金属单质(氧气除外)+ 金属单质→ 无氧酸盐2Na+ Cl2点燃2NaCl2Na + S 点燃Na2SCu + Cl2点燃CuCl2⑫酸性氧化物+ 碱性氧化物→ 含氧酸盐Na2O + CO2Na2CO3(缓慢吸收)CaO + SO2CaSO3Na2O + SO2Na2SO3Na2O + SO3Na2SO4(较快)CaO + SO3CaSO4(微溶,较慢)CaO + CO2CaCO3(非常缓慢)Na2O + SiO2 Na2SiO3(熔融时)CaO + SiO2CaSiO3(熔融时)⑬酸性氧化物+ 碱→ 盐+ 水CO2+2NaOH NaCO3+H2OCa(OH)2+CO2CaCO3+H2OCa(OH)2+SO3CaSO4↓+H2OCa(OH)2+SO2CaSO3↓+H2O⑭碱性氧化物+ 酸→ 盐+ 水③⑦⑮酸+ 碱→ 盐+ 水Cu(OH)2 + H2SO4CuSO4 + 2H2ONaCl + H2O2NaOH + H2SO4Na2SO4 + 2H2ONaOH + HNO3NaNO3 + H2OMg(OH)2 + 2HNO3Mg(NO3)2 + 2H2OBaSO4↓+2H2O⑰碱+ 盐→ 新碱+ 新盐CuSO4Cu(OH)2↓ + Na2SO4 FeCl3Fe(OH)3↓ + 3NaClCa(OH)2 + Na2CO3CaCO3↓ + 2NaOH NaOH + NH4NaCl+NH3↑ + H2OCuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓⑱盐+ 盐→ 新盐+ 另一新盐KCl + AgNO3AgCl↓ + KNO3NaCl + AgNO3AgCl↓ + NaNO3Na2SO4 + BaCl2BaSO4↓ + 2NaClBaCl2 + 2AgNO32AgCl↓ + Ba(NO3)2。

酸碱盐的知识点【篇一:酸碱盐的知识点】氧化物、酸、碱和盐的知识点可以从以下十个方面掌握:一、电离方程式h2so4=2h++so42-naoh=na++oh-al2(so4)3=2al3++3so42-二、物质的俗称和主要成分生石灰——cao熟石灰、消石灰、石灰水的主要成分——ca(oh)2石灰石、大理石——caco3食盐的主要成分——nacl纯碱、口碱——na2co3烧碱、火碱、苛性钠——naoh胆矾、蓝矾——cuso4.5h2o碳酸钠晶体——na2co3.10h2o氨水——nh3.h2o三、金属活动性1、金属活动性顺序:k ca na mg al zn fe sn pb(h) cu hg ag pt au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(k、ca、na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四个微溶物:ca(oh)2(石灰水注明“澄清”的原因)caso4(实验室制二氧化碳时不用稀硫酸的原因)ag2so4(鉴别so42-和cl-时,不用硝酸银的原因)mgco3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
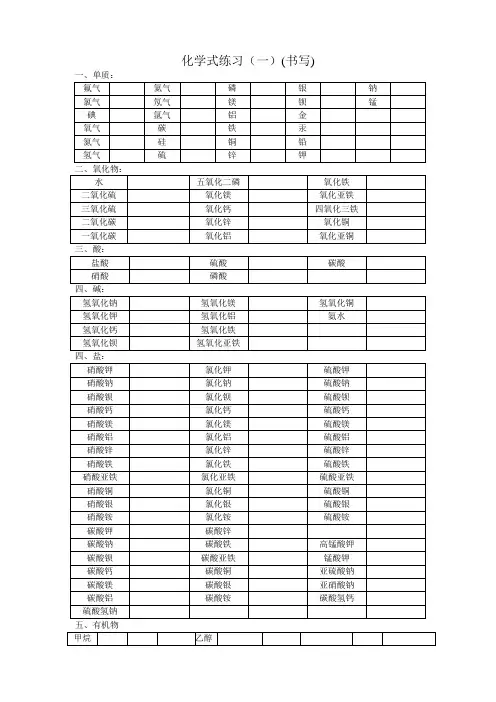
物质的化学式书写及读法专题指导一、稀有气体单质,化学式书写方法:直接用对应的元素符号化学式读法:读作“某气”,即在对应元素符号名称后加一个“气”字1、氦气:He2、氖气:Ne3、氩气: Ar二、某些非金属固体单质,化学式书写方法:直接用对应的元素符号 (初中只记这三种)化学式读法:直接读出对应的元素符号名称1、碳 :C2、硫: S3、磷: P 三、金属单质,化学式书写方法:直接用对应的元素符号化学式读法:直接读出对应的元素符号名称1、铁:Fe2、铝:Al3、铜: Cu4、钠: Na5、钙:Ca6、汞:Hg 四、非金属气体单质(一般为双原子分子),化学式书写方法:在对应的元素符号右下角用“2”作下标化学式读法:读作“某气”,即在对应元素符号名称后加一个“气”字,与稀有气体的一样 1、氢气:H 2 2、氧气:O 2 3、氮气:N 2 4、氯气: Cl 2五、名称中直接读出原子个数的,化学式书写方法:不必利用化合价,先撇开数字,先读的写后,后读的写前,然后在对应的元素符号右下角补回数字作下标这类化学式的读法:当你看到一个化学式的时候,如果化学式中元素的化合价不止一个 (通常指化学式前面的元素),就要读出原子的个数,读作“几某化几某”,或者“几某化某”;反之,就不必读出个数,一般读作“某化某”1、一氧化碳:CO2、二氧化碳:CO 23、一氧化氮:NO4、二氧化氮:NO 25、二氧化硫:SO 26、三氧化硫:SO 37、二氧化锰: MnO 28、四氧化三锰:Mn 3O 49、五氧化二磷:P 2O 5 10、四氧化三铁Fe 3O 4 11、二氧化氯: ClO 2 12、二氧化硅: SiO 2以下的需要利用化合价来书写化学式当物质的名称读作“某化某”时,化学式书写方法:先读的写后,后读的写前某① 化 某② 氯① 化 锌②写某②的元素符号 写某①的元素符号 Zn Cl标出某②的化合价 标出某①的化合价 Zn Cl将某②和某①的化合价数值 交叉, Zn 1 Cl 2 写在元素符号右下角作下标检查(下标之间能约分 ZnCl 2 的约分,“1”省略不写)一、氧化物:只有两种元素,其中一种是O 元素的化合物,化学式读法:读作“氧化某”1、氧化氢或水:H 2O2、氧化钙:CaO3、氧化镁:MgO4、氧化铝 :Al 2O 35、氧化亚铜:Cu 2O6、氧化铜:CuO7、氧化亚铁:FeO8、氧化铁:Fe 2O 3(在元素符号正上方标化合价,必须“+”、“—”同时出现)+2 -19、过氧化氢或双氧水:H2O2二、酸:由H+ 和酸根离子构成的化合物,化学式读法:如果化学式中含有氧元素,将对应酸根名称中的“根”字去掉,然后加上一个“酸”字, 读作“某酸”;如果化学式中没有氧元素,读作“氢某酸”1、硫酸:H2SO42、碳酸:H2CO33、硝酸HNO34、盐酸或氢氯酸HCl5、磷酸H3PO46、氢硫酸:H2S三、碱:由金属离子和OH—离子构成的化合物,化学式读法:读作“氢氧化某”1、氢氧化钾:KOH2、氢氧化钠:NaOH3、氢氧化钙:Ca(OH)24、氢氧化镁:Mg(OH)25、氢氧化钡:Ba(OH)26、氢氧化锌:Zn(OH)227、氢氧化铝:Al(OH)38、氢氧化铜:Cu(OH)29、氢氧化亚铁:Fe(OH)210、氢氧化铁:Fe(OH)311、氨水:NH3·H2O四、盐:由金属离子和酸根离子构成的化合物(一)、氯化物:(不读作氯盐)——Cl 可看作是特殊的酸根1、氯化氢:HCl2、氯化钙:CaCl23、氯化镁:MgCl24、氯化钡:BaCl25、氯化锌:ZnCl26、氯化铝:AlCl37、氯化亚铜:CuCl8、氯化铜:CuCl29、氯化亚铁:FeCl210、氯化铁:FeCl3(二)、硫酸盐(化学式中有SO4 ,读作“硫酸某”)1、硫酸钾:K2SO42、硫酸钠:Na2SO43、硫酸银:Ag2SO44、硫酸钙:CaSO45、硫酸镁:MgSO46、硫酸钡:BaSO47、硫酸锌:ZnSO48、硫酸铝Al2(SO4) 39、硫酸铜CuSO410、硫酸亚铁:FeSO4 11、硫酸铁:Fe2(SO4) 3(三)、碳酸盐(化学式中有CO3 ,读作“碳酸某”)1、碳酸钾:K2CO32、碳酸钠:Na2CO33、碳酸钙:CaCO34、碳酸镁:MgCO35、碳酸钡:BaCO3(四)、硝酸盐(化学式中有NO3 ,读作“硝酸某”)1、硝酸钾:KNO32、硝酸钠:NaNO33、硝酸银:AgNO34、硝酸钙:Ca(NO3)25、硝酸镁:Mg(NO3)26、硝酸钡:Ba(NO3)27、硝酸锌:Zn(NO3)28、硝酸铝:Al2(NO3)3 9、硝酸铜:Cu(NO3)2 10、硝酸亚铁:Fe(NO3)2 11、硝酸铁:Fe(NO3)3(五)、铵盐-----特殊的盐,不是由金属离子和酸根离子构成,因为铵根离子不是金属离子。
酸碱盐一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(N H3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸→ 盐 + 氢气(3)碱性氧化物 + 酸→ 盐 + 水(4)碱 + 酸→ 盐 + 水(5)盐 + 酸→ 另一种盐 + 另一种酸(产物符合复分解条件)3、三种离子的检验三、碱1、氢氧化钠、氢氧化钙的物理性质、用途2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→ 盐+水(3)酸+碱→ 盐+水(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 =Δ= CuO +H2O2Fe(OH)3 =Δ= Fe2O3+3H2O②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓ F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、酸性氧化物与碱性氧化物四、中和反应溶液酸碱度的表示法--pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法--pH(1)(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨在各省市中考试卷的命题中,无不将酸碱盐的化学性质的考察作为重中之重。
酸 碱 盐 氧化物 化学式书写专题(内容:化学式书写、物质命名与分类)一、知识准备:(必须熟记)1、熟记常见元素化合价口诀与原子团名称、符号、化合价口诀。
常见元素化合价口诀:钠 、钾 、 银 、氢 正一价, 钙、 镁 、钡、锌 正二价, 铜 正一(亚铜)正二、;,铝正三, 铁有正二(亚铁);和正三 氧、硫 负二、氯负一(S 、Cl 唯一负价分别为 —2、— 1) 常见原子团名称、符号、化合价: 原子团名称 硝酸根 氢氧根 硫酸根 碳酸根 铵根 原子团符号 NO 3OHSO 4CO 3NH 4 化合价- 1价—2价+1价优生了解:盐酸根(氯元素)Cl — 1价、氢硫酸根(硫元素)S —2价,它们不是原子团,但它是酸根 高锰酸根 MnO 4 — 1价, 氯酸根 ClO 3 —1价;锰酸根 MnO 4 - 2价, 亚硫酸根 SO 3 —2价,磷酸根PO 4 —3价.2、化合物(酸碱盐氧化物)的组成及名称特点:本无化学式,有时可书写其主要成分的化学式表示)化学式书写:除H 2,N 2,O 2,Cl 2外,其余单质均用元素符号表示 正价 负价 命 名 名称特点 (几)氧化(几)X ”氧化”X菜 酸根 X 酸 “酸”字最后金属 氢氧化 X "氢氧化”X 金属 (Cl 或S ) X 化X 氯化X ;硫化X金属 含氧酸根 X 酸 X “酸”字居中二、书写化学式的步骤:1>根据物质名称特点,找出组成化合物的正价和负价两部分—-—————-—-—(关键) 2〉正前负后,(标,约,)交 写 原子团右下角需写小数字时,必加括号.化学式书写中最易出现不标、约、交、写的错误,一定要避免出这样的错误!!!三、由书写化学式分类或由化学式写出物质名称的思维步骤: A 、已知物质名称书写化学式思维步骤:物质名称→名称特点→物质类别→正负价两部份→正前负后标约交写→检查正误 B 、由物质化学式写出物质名称并分类的思维步骤:化学式→正负价两部份→物质类别→名称特点→命名(写出名称)物 质混合物 纯净物 单质 化合物[练习1]1、写出下列物质化学式并指出物质类别(单质、氧化物、酸、碱、盐):硝酸钾____________( ); 硫酸__________( );硝酸银__________( ); 氢氧化钡__________( );氧化铝__________( ); 硝酸 ____________( ); 氯化钡____________( ); 碳酸__________( ); 氢氧化钙________( );硫化锌____________( ); 过氧化氢________( ); 硝酸铵__________( ); 硫酸钠__________( ); 氢氧化钾________( ); 碳酸钠__________( ); 碳酸钙___________( ); 氧化钙 __________( );氯化银__________( );盐酸______________( ); 硫酸亚铁________( ); 硫酸锌_________ ( ); 碳酸钡____________( ); 硫酸钡____________( ); 氯化铵 _________( ); 氯化亚铁____________( ); 氧化铁 __________( ); 氢氧化钠_______( ); 氮气 _____________( ); 氢氧化镁________( ); 碳酸钾_________( ); 氦气_____________( ); 氯酸钾___________( ); 高锰酸钾________( );2、根据化学式,写出其相应的物质名称,并指出物质的类别(单质、氧化物、酸碱、盐):CaO___________( ); AlCl 3____________( ); Ca (OH )2_________( ); FeSO 4___________( ); Ba(NO 3)2_________( ); H 3PO 4___________( ); MgSO 4 ___________( ); Na 2O______________( ); Fe (OH )3___________ ( ); K 2CO 3__________( ); Na 2SO 3___________(); Fe 3O 4____________( );CuSO 4___________( );FeCl 2 ____________( ); HNO 3_________( );Al 2O 3 ___________( ); Ba(OH )2__________( );CuO ____________( ); Zn(OH)2___________();BaCO 34___________( );(NH 4)2SO 4________( );3、下列物质的名称或化学式有错误,请改正。
酸 碱 盐 氧化物 化学式书写专题(内容:化学式书写、物质命名与分类)一、知识准备:(必须熟记)1、熟记常见元素化合价口诀与原子团名称、符号、化合价口诀。
常见元素化合价口诀:钠 、钾 、 银 、氢 正一价, 钙、 镁 、钡、锌 正二价, 铜 正一(亚铜)正二、;,铝正三, 铁有正二(亚铁);和正三 氧、硫 负二、氯负一(S 、Cl 唯一负价分别为 -2、- 1) 常见原子团名称、符号、化合价: 原子团名称 硝酸根 氢氧根 硫酸根 碳酸根 铵根 原子团符号 NO 3OHSO 4CO 3NH 4 化合价— 1价—2价+1价优生了解:盐酸根(氯元素)Cl - 1价、氢硫酸根(硫元素)S -2价,它们不是原子团,但它是酸根 高锰酸根 MnO 4 - 1价, 氯酸根 ClO 3 -1价;锰酸根 MnO 4 - 2价, 亚硫酸根 SO 3 -2价,磷酸根PO 4 -3价。
2、化合物(酸碱盐氧化物)的组成及名称特点:本无化学式,有时可书写其主要成分的化学式表示)化学式书写:除H 2,N 2,O 2,Cl 2外,其余单质均用元素符号表示 正价 负价 命 名 名称特点 (几)氧化(几)X "氧化"X菜 酸根 X 酸 “酸”字最后金属 氢氧化 X "氢氧化"X金属 (Cl 或S) X 化X 氯化X ;硫化X金属 含氧酸根 X 酸 X “酸”字居中二、书写化学式的步骤:1>根据物质名称特点,找出组成化合物的正价和负价两部分-----------(关键) 2>正前负后,(标,约,)交 写 原子团右下角需写小数字时,必加括号.化学式书写中最易出现不标、约、交、写的错误,一定要避免出这样的错误三、由书写化学式分类或由化学式写出物质名称的思维步骤: A 、已知物质名称书写化学式思维步骤:物质名称→名称特点→物质类别→正负价两部份→正前负后标约交写→检查正误 B 、由物质化学式写出物质名称并分类的思维步骤:化学式→正负价两部份→物质类别→名称特点→命名(写出名称)物质混合物 纯净物 单质化合物[练习1]1、写出下列物质化学式并指出物质类别(单质、氧化物、酸、碱、盐):硝酸钾____________( ); 硫酸__________( ); 硝酸银__________( ); 氢氧化钡__________( ); 氧化铝__________( ); 硝酸 ____________( ); 氯化钡____________( ); 碳酸__________( ); 氢氧化钙________( ); 硫化锌____________( ); 过氧化氢________( ); 硝酸铵__________( ); 硫酸钠__________( ); 氢氧化钾________( ); 碳酸钠__________( ); 碳酸钙___________( ); 氧化钙 __________( ); 氯化银__________( ); 盐酸______________( ); 硫酸亚铁________( ); 硫酸锌_________ ( ); 碳酸钡____________( );硫酸钡____________( ); 氯化铵 _________( ); 氯化亚铁____________( ); 氧化铁 __________( ); 氢氧化钠_______( ); 氮气 _____________( ); 氢氧化镁________( ); 碳酸钾_________( ); 氦气_____________( ); 氯酸钾___________( ); 高锰酸钾________( );2、根据化学式,写出其相应的物质名称,并指出物质的类别(单质、氧化物、酸碱、盐):CaO___________( ); AlCl 3____________( ); Ca(OH)2_________( );FeSO 4___________( ); Ba(NO 3)2_________(); H 3PO 4___________( );MgSO 4 ___________( ); Na 2O______________( ); Fe(OH)3___________ ( ); K 2CO 3__________( );Na 2SO 3___________();Fe 3O 4____________( );CuSO 4___________( );FeCl 2 ____________( ); HNO 3_________( );Al 2O 3 ___________( ); Ba(OH)2__________( );CuO ____________( );Zn(OH)2___________( ); BaCO 34___________( ); (NH 4)2SO 4________( );3、下列物质的名称或化学式有错误,请改正。
氢氧化钠 Na(OH) ___________; 氧化铁 FeO ___________; 碳酸钠 NaCO 3___________; 硝酸钡 BaNO 3 ____________; 硝酸氢 HNO 3__________;氧化二钾 K 2O___________; 氯化镁 Mg(Cl)2 ____________; 硫酸钠 Na 2SO 3________; 磷酸 PO 4 ___________.练习 2一.标出下列物质中划有横线元素的化合价:H2O2KClO3Al2O3FeCl2Hg(NO3)2Na2S AgClCH4K2MnO4ZnSO4NH4Cl K3PO4二.根据原子团名称,写出相应原子团的符号并在其上方标出化合价氢氧根________;硫酸根________;硝酸根_________;碳酸根______ ; 铵根________;※{锰酸根________;锰酸根_________;.高锰酸根_______;氯酸根_________;磷酸根________;}三.化合物一般都由正价和负价两部份组成,各类化合物的组成和名称都有自己的特点:酸是由_____________和_____________组成,名称特点是_____________________;碱是由_____________和_____________组成,名称特点是_____________________;盐是由_____________和_____________组成,根据酸根是否含有氧元素,分为无氧酸盐(如:NaCl、K2S)和含氧酸盐(如: KClO3、Na2CO3)前者名称特点是氯化某或硫化某;后者名称特点是___________________。
四.(1)用数字和符号表示:两个硝酸根离子_____; 三个铝离子_______; 氯离子________;两个铁离子_______; 三个碳酸根离子_____; 四个亚铁离子_____;两个氢离子____; 两个铵根离子_____(2)写出下列符号中"2"的意义:2Al3+____________________________; Fe2+________________________________;2 OH-____________________________; 2MnO4-______________________________.五.写出下列物质的化学式,并在括号中写出物质类别(单质、氧化物、酸、碱、盐):氢氧化钾__________( ); 碳酸钠__________( ); 硝酸钡___________( ); 氯化锌____________( ); 盐酸____________( ); 氢氧化铁__________( ); 氯化镁____________( );双氧水_____________ ( ); 氯化镁_________( );硝酸铜____________( );硫酸__________( );硝酸银_________( );硫酸铝__________( ); 氢氧化钾________( ); 氯化银_________( );碳酸钾________( ); 氧化钠__________( ); 氯化钾_________( );碳酸______________( ); 硫酸亚铁________( ); 氮气__________( );碳酸钙____________( ); 硫酸钡____________( ); 氧化镁________( );氯化钡____________( ); 硫酸铁__________( ); 氢氧化钠_______( );氯气_____________( ); 氢氧化铜________( ); 硝酸钾_________( );氯化铝__________( );硫酸铜__________( ); 硫酸亚铁_________( ); 硅__________( );氩气___________( ); 氧化钙_________( );氢氧化镁_________( ); 碳酸钡__________( ); 二氧化氯___________( ). 氢氧化钡__________( ); 碳酸钠__________( );氯化钠___________( ); 氯化钡____________( ); 硝酸____________( ); 氢氧化镁_______( );氯化铁____________( );氢氧化钙________ ( );氯酸钾_________( );硝酸铜____________( );氯化钙_________( );氧化汞_________( );氧化铝____________( );硫酸铵___________( );氢氧化铝_______( );氢氧化铁__________( );硝酸银_________( );金_________( );硫酸锌______________( );硝酸铵________( );氧化铁________( );六.改正化学式,写出其相应的物质名称,并指出物质的类别(单质、氧化物、酸、碱、盐): CaCl___________( ); KCLO3____________( ); CaOH2_________( );Na(OH)___________( ); BaNO32_________( ); SO4___________( );MgO2______________( );AgCl3 _________( );KSO4__________( ); NaCO3___________( ); AlSO4____________( );AlO___________( );Mg(Cl)2 ____________( );。