广东省韶关市2019届高三上学期高考调研考试理科综合化学试题
- 格式:doc
- 大小:445.04 KB
- 文档页数:17

广东省韶关市高三上学期理综-化学期中考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2019高一上·吉林月考) 实验中的下列操作正确的是()A . 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中B . Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液做沉淀处理后,将余下废液倒入指定的回收缸中再做其他处理C . 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干D . 用分液法分离食盐水和苯的混合液时,用烧杯从下口接收液体进而回收苯2. (2分) (2016高一下·荆州期中) 下列有关化学用语表示正确的是()A . 次氯酸的结构式:H﹣Cl﹣OB . 16O2﹣和18O2﹣的结构示意图:C . 氮气的电子式:D . 电子式表示氯化钠的形成过程:3. (2分) (2018高三上·吉林期中) 用NA表示阿伏加德罗常数的值,下列有关说法错误的是()A . 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,CH3COO-数目是NAB . 1.68gFe与足量高温水蒸气反应,转移电子的数目为0.09NAC . 氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NAD . 常温下,2L 0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同4. (2分)(2018·南通模拟) 根据下列实验操作和现象所得到的结论正确的是()选项实验操作实验现象结论A向蛋白质溶液中滴加CuSO4溶液有固体析出蛋白质发生盐析B 向浓度均为0.10 mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液出现黄色沉淀Ksp(AgCl)>Ksp(AgI)C 取等物质的量的Al和Fe,分别与足量的盐酸反应Al产生的氢气多金属性:Al>FeD向苯酚浊液中滴加饱和Na2CO3溶液浊液变澄清酸性:苯酚>碳酸A . AB . BC . CD . D5. (2分) (2016高三上·大连期中) X,Y,Z,W,R属于短周期主族元素.X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m﹣n,W 元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述错误的是()A . X与Y形成的两种化合物中阴、阳离子的个数比均为1:2B . Y的氢化物比R的氢化物稳定,熔沸点高C . Z,W,R最高价氧化物对应水化物的酸性强弱顺序是:R>W>ZD . RY2、WY2通入BaCl2溶液中均有白色沉淀生成6. (2分) (2018高二下·海宁期中) 一种熔融碳酸盐燃料电池原理示意如图。
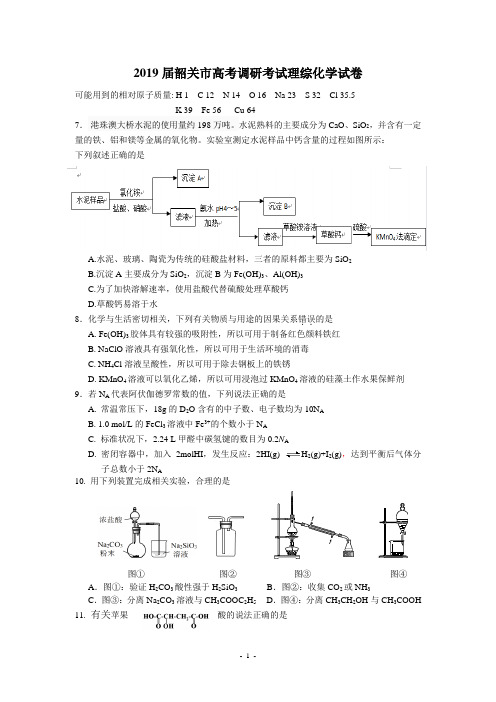
2019届韶关市高考调研考试理综化学试卷可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5K 39 Fe 56 Cu 647. 港珠澳大桥水泥的使用量约198万吨。
水泥熟料的主要成分为CaO 、SiO 2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示: 下列叙述正确的是A.水泥、玻璃、陶瓷为传统的硅酸盐材料,三者的原料都主要为SiO 2B.沉淀A 主要成分为SiO 2,沉淀B 为Fe(OH)3、Al(OH)3C.为了加快溶解速率,使用盐酸代替硫酸处理草酸钙D.草酸钙易溶于水8.化学与生活密切相关,下列有关物质与用途的因果关系错误..的是 A. Fe(OH)3胶体具有较强的吸附性,所以可用于制备红色颜料铁红B. NaClO 溶液具有强氧化性,所以可用于生活环境的消毒C. NH 4Cl 溶液呈酸性,所以可用于除去钢板上的铁锈D. KMnO 4溶液可以氧化乙烯,所以可用浸泡过KMnO 4溶液的硅藻土作水果保鲜剂9.若N A 代表阿伏伽德罗常数的值,下列说法正确的是A. 常温常压下,18g 的D 2O 含有的中子数、电子数均为10N AB. 1.0 mol/L 的FeCl 3溶液中Fe 3+的个数小于N AC. 标准状况下,2.24 L 甲醛中碳氢键的数目为0.2N AD. 密闭容器中,加入2molHI ,发生反应:2HI(g)H 2(g)+I 2(g),达到平衡后气体分子总数小于2N A图① 图② 图③ 图④A .图①:验证H 2CO 3酸性强于H 2SiO 3B .图②:收集CO 2或NH 3C .图③:分离Na 2CO 3溶液与CH 3COOC 2H 5D .图④:分离CH 3CH 2OH 与CH 3COOH11. 有关苹果酸的说法正确的是A .苹果酸中能发生酯化反应的官能团有2种B .1 mol 苹果酸可与3 mol NaOH 发生反应C .1 mol 苹果酸与足量金属Na 反应生成1 mol H 2D .苹果酸与互为同分异构体12.短周期元素X 、Y 、Z 、M 的原子序数依次增大,其中X 、Y 、Z 三种元素能形成二元10电子微粒m 、n 、p 、q ,且有反应q p n m +↑−→−+∆;M 的最高价氧化物对应的水化物为最强酸。

广东省2019届高三三模理科综合化学试卷【含答案及解析】姓名___________ 班级____________ 分数__________一、选择题1. 下列有关物质的说法正确的是A. 石油气的主要成分包括氢气、乙烯、丙烷等B. 常温下可用铁、铜的容器来盛放冷的浓硝酸或浓硫酸C. 农业上常用的化肥,如硫酸铵、碳酸氢铵都是铵盐D. 多数合金的熔点一般比它的成分金属高,性能更好2. 下列关于有机化合物的说法正确的是A. 苯和甲苯互为同系物,都能使高锰酸钾褪色B. 对二甲苯与氢气完全加成的产物的一氯代物有3种C. 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等D. 淀粉、油脂、蛋白质的水解产物都是非电解质3. 设N A 代表阿伏伽德罗常数的值,下列说法正确的是A. 室温时,1.0L pH=13的Ba(OH) 2 溶液中含有OH - 的数目为0.2N AB. 标准状况下,11.2L CH 2 Cl 2 中含有的原子数为2.5N AC. 1.68g Fe 与足量高温水蒸气反应,转移电子数为0.09N AD. 17g H 2 O 2 所含非极性键数目为0.5N A4. 短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素,其中X与W 处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),Z与W、W与Q的原子序数之差均为3,五种元素原子的最外层电子数之和为21,下列说法不正确的是A. Q的单质能与Z的最高价氧化物的水化物发生氧化还原反应B. 气态氢化物的稳定性:Q>WC. 一定条件下,Q的单质可把Y的单质从其氢化物中置换出来D. 最高价氧化物对应水化物的酸性顺序:Q>Y>W>X5. 下列实验操作、现象或结论的说法不正确的是A. 在沸水中滴加几滴饱和氯化铁溶液,继续煮沸得胶体,再加入Na 2 SO 4 溶液,可观察到红褐色沉淀B. 某溶液加入BaCl 2 溶液,生成白色沉淀,加稀盐酸沉淀不溶,可确定有SO 4 2- 存在C. FeCl 2 、NaOH、Mg(NO 2 ) 2 三种溶液不需其他试剂即可鉴别D. 用标准盐酸滴定未知浓度的Na 2 CO 3 溶液,可用酚酞作为指示剂6. 某新型可充电电池,能长时间保持稳定的放电电压。

广东韶关2019高三第一次重点考试理综试题-化学可能用到的相对原子质量:H -1C -12N -14O -16Cl -35.5Li -7Na —23Mg -24Al -27Fe -567、某有机物A 是农药生产中的一种中间体,其结构简式如右图所示,以下表达正确的选项是A 、有机物A 属于芳香烃B 、有机物A 能够和Br 2的CCl 4溶液发生加成反应C 、有机物A 和浓硫酸混合加热,能够发生消去反应D 、1molA 和足量的NaOH 溶液反应,最多能够消耗3molNaOH8、以下各条件下可能共存的离子组是A 、某无色溶液中:NH 4+、Na +、Cl -、MnO 4-B 、常温下由水电离出的c (H +)=1×10-13mol ·L -1的溶液中:Na +、K +、SO 32-、CO 32-C 、在c (H +)=1×10-13mol ·L -1的溶液中:NH 4+、Al 3+、SO 42-、NO 3-D 、在pH=1的溶液中:K +、Fe 2+、Cl -、NO 3-9、用N A 表示阿伏加德罗常数的数值,以下说法中一定正确的选项是A 、1Llmol ·L -1的FeCl 3溶液中含有N A 个Fe 3+B 、往某容器中投入1molN 2和3molH 2,一定条件下充分反应后,生成的NH 3的数目为2N AC 、钠与水反应生成1.12LH 2,反应中转移的电子数为0.1N AD 、常温常压下,22g 氧气和26g 臭氧混合气体所含氧原子总数为3N A10、以下有关实验操作的说法正确的选项是A 、SO 2通入品红溶液和高锰酸钾溶液中,溶液均褪色,说明SO 2具有漂白性B 、用蒸馏水将pH 试纸先润湿,可用于检验氨气C 、在常温下,将氯化铝溶液蒸发结晶,最后能得到氯化铝晶体D 、某无色溶液中加Ba(NO 3)2溶液,再加入稀盐酸,沉淀不溶解,那么原溶液中一定有SO 42- 11、依照以下热化学方程式〔1〕C(s)+O 2(g)=CO 2(g)△H 1=-393.5kJ ·mol -1〔2〕H 2(g)+21O 2(g)=H 2O(l)△H 2=-285.8kJ ·mol -1〔3〕CH 3COOH(l)+2O 2(g)=2CO 2(g)+2H 2O(l)△H 3=-870.3kJ ·mol -1能够计算出2C(s)+2H 2(g)+O 2(g)=CH 3COOH(l)的△H 为A 、△H =+244.1kJ ·mol -1B 、△H =-488.3kJ ·mol -1C 、△H =-996.6kJ ·mol -1D 、△H =+996.6kJ ·mol -112、有一可充—放电的锂离子电池,放电时负极反应为:LiC 6-e -=6C+Li +,正极反应:CoO 2+Li ++e -=LiCoO 2,以下说法正确的选项是A 、放电时Li +向负极移动B 、该电池能够采纳水溶液做电解质,也能够用有机溶剂C 、充电时LiCoO 2作阳极D 、充电时假设有1mol 电子转移,那么阴极消耗1molLiC 622、主族元素X 、Y 、Z 、W 、M 在元素周期表中的位置如右图所示,W 最高价氧化物对应的水化物为强酸,以下说法正确的选项是A 、原子半径:Y<Z<MB 、M 最高价氧化物对应的水化物一定是强酸C 、Z 与M 对应的氢化物的沸点:M>ZD 、一定条件下,M 、Y 对应的单质都能与W 的氢化物发生置换反应23、以下有关实验操作和现象都正确的选项是A 、模拟铁钉腐蚀B 、制备少量氧气C 、电解法制镁D 、制备氢氧化铝 O O Cl OH X Y Z W M30、〔15分〕黄酮醋酸〔F 〕具有独特抗癌活性,它的合成路线如下::RCN 在酸性条件下发生水解反应:〔1〕A 转化为B 的同时还生成了乙酸,那么A 的结构简式为,该反应类型是。

2019届韶关市高考模拟考试理综化学试卷可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56Co 59 Pb 2077.下列说法不正确...的是A.导电高分子材料聚乙炔不能发生加成反应B.厕所清洁剂,醋,肥皂,厨房清洁剂四种物质溶液的pH依次增大C.“血豆腐”(也叫血旺)和白豆腐的制作原理都与胶体性质有关D.工业生产肥皂要经过皂化,盐析,洗涤,整理等步骤8.有关下列四组实验描述不正确...的是A.加热甲装置中的烧杯可以分离SiO2和NH4ClB.利用装置乙无法证明非金属性强弱:Cl>C>SiC.打开丙中的止水夹,一段时间后,可观察到烧杯内溶液沿导管上升D.装置丁一段时间后,向铁电极区滴入2滴铁氰化钾溶液,有蓝色沉淀生成9.国际计量大会第26次会议新修订了阿伏加德罗常数(N A=6.02214076×1023mol-1),并将于2019年5月20日正式生效。
设a为N A的值,下列说法正确的是A.56g聚乙烯分子中含碳碳双键的数目为2 aB.在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75 aC.1.0L pH=1的HCl溶液中Cl-数为0.1aD.18g干冰与足量Na2O2反应转移电子数为a10. 三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。
纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是A.①④的一氯代物有三种B.①③属于烯烃,均能发生加成反应C.②④互为同分异构体D.②③的碳原子间构成的最小环均为六元环11. A、B、C、D为短周期主族元素,25 ℃时,其最高价氧化物的水化物溶液(浓度均为0.1 mol·L-1)的pH和原子序数的关系如图所示。
下列有关说法正确的是A.简单离子半径:D>C>A>BB.D元素氧化物的水化物一定是强酸C.B、C的简单离子都能破坏水的电离平衡D.氢化物的还原性:C>D12.“碳呼吸电池”是一种新型能源装置,其工作原理如图。

2019届韶关市高考调研考试理综化学试卷可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5K 39 Fe 56 Cu 647. 港珠澳大桥水泥的使用量约198万吨。
水泥熟料的主要成分为CaO 、SiO 2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示: 下列叙述正确的是A.水泥、玻璃、陶瓷为传统的硅酸盐材料,三者的原料都主要为SiO 2B.沉淀A 主要成分为SiO 2,沉淀B 为Fe(OH)3、Al(OH)3C.为了加快溶解速率,使用盐酸代替硫酸处理草酸钙D.草酸钙易溶于水8.化学与生活密切相关,下列有关物质与用途的因果关系错误..的是 A. Fe(OH)3胶体具有较强的吸附性,所以可用于制备红色颜料铁红B. NaClO 溶液具有强氧化性,所以可用于生活环境的消毒C. NH 4Cl 溶液呈酸性,所以可用于除去钢板上的铁锈D. KMnO 4溶液可以氧化乙烯,所以可用浸泡过KMnO 4溶液的硅藻土作水果保鲜剂9.若N A 代表阿伏伽德罗常数的值,下列说法正确的是A. 常温常压下,18g 的D 2O 含有的中子数、电子数均为10N AB. 1.0 mol/L 的FeCl 3溶液中Fe 3+的个数小于N AC. 标准状况下,2.24 L 甲醛中碳氢键的数目为0.2N AD. 密闭容器中,加入2molHI ,发生反应:2HI(g)H 2(g)+I 2(g),达到平衡后气体分子总数小于2N A10. 用下列装置完成相关实验,合理的是图① 图② 图③ 图④A .图①:验证H 2CO 3酸性强于H 2SiO 3B .图②:收集CO 2或NH 3C .图③:分离Na 2CO 3溶液与CH 3COOC 2H 5D .图④:分离CH 3CH 2OH 与CH 3COOH11. 有关苹果酸的说法正确的是A .苹果酸中能发生酯化反应的官能团有2种B .1 mol 苹果酸可与3 mol NaOH 发生反应C .1 mol 苹果酸与足量金属Na 反应生成1 mol H 2D .苹果酸与互为同分异构体12.短周期元素X 、Y 、Z 、M 的原子序数依次增大,其中X 、Y 、Z 三种元素能形成二元10电子微粒m 、n 、p 、q ,且有反应q p n m +↑−→−+∆;M 的最高价氧化物对应的水化物为最强酸。
2019年高考试题-理综化学(广东卷a)解析版注意事项:认真阅读理解,结合历年的真题,总结经验,查找不足!重在审题,多思考,多理解!无论是单选、多选还是论述题,最重要的就是看清题意。
在论述题中,问题大多具有委婉性,尤其是历年真题部分,在给考生较大发挥空间的同时也大大增加了考试难度。
考生要认真阅读题目中提供的有限材料,明确考察要点,最大限度的挖掘材料中的有效信息,建议考生答题时用笔将重点勾画出来,方便反复细读。
只有经过仔细推敲,揣摩命题老师的意图,积极联想知识点,分析答题角度,才能够将考点锁定,明确题意。
化学试解析可能用到的相对原子质量:H1C12N14O16Na23Al27S32Cl35.5Cu63.5【一】单项选择题:本大题共16小题,每题4分,总分值64分.在每题给出的四个选项中,只有一项为哪一项符合题目要求的.选对的得4分,选错或不答的得0分。
7、以下说法正确的选项是A、糖类化合物都具有相同的官能团B、酯类物质是形成水果香味的主要成分C、油脂的皂化反应生成脂肪酸和丙醇D、蛋白质的水解产物都含有羧基和羟基A有醛基和酮基。
C高级脂肪酸钠盐和甘油。
D羧基和氨基8、水溶解中能大量共存的一组离子是A、Na+、Al3+、Cl-、CO32-B、H+、Na+、Fe2+、MnO4-C、K+、Ca2+、Cl-、NO3-D、K+、NH4+、OH-、SO42-A红色的发生双水解B红色的发生氧化还原反应D红色生成弱电解质9、设n A为阿伏加德罗常数的数值,以下说法正确的选项是A、常温常压下,8gO2含有4n A个电子B、1L0.1mol·L-1的氨水中有n A个NH4+C、标准状况下,22.4L盐酸含有n A个HCl分子D、1molNa被完全氧化生成Na2O2,失去个2n A电子B氨水部分电离C盐酸为液体D.Na化合价从0到+1失去1e—,1mol应该是1n A10、以下表达Ⅰ和Ⅱ均正确并且有因果关系的是选项表达I 表达IIA NH4Cl为强酸弱碱盐用加热法除去NaCl中的NH4ClB Fe3+具有氧化性用KSCN溶液可以鉴别Fe3+C 溶解度:CaCO3<Ca(HCO3)2溶解度:Na2CO3<NaHCO3D SiO2可与HF反应氢氟酸不能保存在玻璃瓶中A两者没有因果关系,前是盐类的水解,后是铵盐的不稳定性。
高中2019届毕业班第三次诊断性考试理科综合能力测试一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.处理锂离子二次电池正极废料铝钴膜(含有LiCoO2、Al等)的一种工艺如下:下列有关说法不正确的是A. 碱浸的目的是溶解铝B. 酸溶时H2 O2被还原C. H2SO4/H2O2可改用浓盐酸D. 铝、钴产物可再利用【答案】B【解析】【分析】本题以锂离子二次电池正极废料为研究对象,体现了化学在推进生态文明建设、解决生态环境问题等方面大有作为,同时考查学生通过所学知识解决这一实际问题的能力,根据流程,LiCoO2不与碱反应,Al能与NaOH反应,使Al转变成可溶的NaAlO2,然后过滤得到LiCoO2,LiCoO2中Li为+1价,O为-2价,Co为+3价,依据整个流程,产品中Co的化合价为+2价,即“酸溶”中Co被还原,H2O2被氧化,“酸溶”液中加入NaOH,得到“净化液”,除去Li元素,加入草酸铵溶液,使Co2+转变成CoC2O4沉淀;【详解】A、根据铝钴膜的成分以及流程,Al能与NaOH反应,生成可溶的NaAlO2,LiCoO2不溶于NaOH,然后过滤得到LiCoO2,因此碱浸的目的是溶解铝,故A说法正确;B、LiCoO2中Co显+3价,产品中CoC2O4,Co显+2价,化合价降低,LiCoO2为氧化剂,H2O2为还原剂,H2O2被氧化,故B说法错误;C、H2SO4提供H+,H2O2作还原剂,盐酸也能提供H+,+3价Co也能氧化Cl-转化成+2价Co,故C说法正确;D、根据上述分析,铝、钴产物可以再利用,故D说法正确。
2.N A代表阿伏加德罗常数的值。
下列判断正确的是A. 2.24 L H2和0.2 mol Cl2光照反应后氯分子数目为0.IN AB. 7.8 gNa2O2与足量CO2充分反应转移电子数目为0.2N AC. 1.8 g重水中所含中子、原子的数目分别为N A、0.3N AD. CaCO3、KHCO3混合物粉末10 g中氧原子数目为0.3N A【答案】D【解析】【详解】A、没有指明H2的体积是否是标准状况下测定,因此无法直接使用22.4L·mol-1,故A错误;B、Na2O2与CO2反应方程式为2Na2O2+2CO2=2Na2CO3+O2,1molNa2O2参与反应,转移电子物质的量1mole-,因此7.8gNa2O2参与反应转移电子物质的量为7.8g/78g·mol-1×1=0.1mol,故B错误;C、重水的化学式为D2O,即2H2O,其摩尔质量为20g·mol-1,1mol重水含有中子物质的量为10mol,原子物质的量为3mol,1.8g重水的物质的量为 1.8g/20g·mol-1=0.09mol,含有中子、原子物质的量分别为0.9mol、0.27mol,故C错误;D、CaCO3和KHCO3的摩尔质量都是100g·mol-1,因此10g该混合物中含有氧原子的物质的量为10g×3/100g·mol -1=0.3mol,故D正确。
韶关市2019届高三第二次调研考试理科综合一、单项选择题(本大题共16小题,每题4分,共64分。
在每小题给出的四个选项中只有一个选项符合题目要求•选对的得4分,选错或不答的得0分)1. 下列关于核酸的说法,错误的是A. 核酸与ATP都含有C H 0、N P元素B. 由碱基A、C和T可以组成的核苷酸有6种C. DNA和RNA勺自我复制都遵循碱基互补配对原则D. 用吡罗红甲基绿染色剂进行染色观察DNA和RNA在细胞中的分布2. 右下图为人体某细胞所经历的生长发育各个阶段示意图,图中①〜⑦为不同的细胞,a〜c表示细胞所进行的生理过程。
据图分析,下列叙述正确的是A. 与①相比,②③④的分裂增殖能力加强,分化能力减弱B. ⑤⑥⑦的核基因相同,细胞内的蛋白质种类和数量也相同C. ②③④的形成过程中发生了基因分离和自由组合D. 进人c过程的细胞,酶活性降低,代谢减慢继而凋亡老、死亡3. 下列有关同位素标记法的叙述,不正确的是A. 小白鼠吸人18。
2后呼出的二氧化碳一定不含B. 用14C标记的CO2研究光合作用暗反应中碳的转移途径C. 用35s标记的噬菌体侵染细菌,能说明蛋白质不进人细菌细胞D. 用15N标记的脱氧核苷酸培养大肠杆菌,繁殖两代后所有的大肠杆菌都会有放射性4. 下图是中心法则示意图,各个数字代表不同的过程,有关叙述不正确的是A. 过程1和过程2都是边解旋边进行B. 过程1和过程2所需原料相同C. 过程3和过程4不能发生在人体健康细胞内D. 过程5的直接模板是mRNA5. 有关生物进化及新物种形吨的叙述,正确的是A. 群落是生物进化的基本单位,也是生物繁殖的基本单位B. 地理隔离必然导致生殖隔离,从而形成新的物种C. 自然选择通过作用于个体而影响种群的基因频率D. 细菌进化的原材料可来自基因突变和染色体异6.有关种群和群落叙述,正确的是A. 右图中种群开始呈“ J”型增长,达到K值后呈“ S”型增长B. 右图中种群在时间相对值为2时的年龄组成为稳定型C. 用标志重捕法调查某草原中田鼠的种群密度种群数量ab C)种群数*个18—02。
2019届高三综合测试(一)理综化学试题7.下列关于物质分类的说法正确的是A.Na2O,CaO,Na2O2都是碱性氧化物B.干冰,二氧化硅,氯化钠都是由分子构成的物质C.HCOOH,H2SO4,H2S都含有两个氢原子,都是二元酸D.NaOH,CH3COONH4,HCl都是强电解质8.下列关于C2H4和C3H6两种气体,下列说法正确的是A.质量相同时,分子数相同B.同温同压下,密度相同C.体积相同时,分子数相同D.质量相等时,原子数相同9.N A表示阿伏伽德罗常数,下列叙述正确的是A.标况下,44.8L的SO3含有2N A的S原子B.Na2O2与1molSO2完全反应时转移的电子数为N AC.常温常压下,1mol CO2与NO2的混合物中含有的氧原子数为2N AD.1L 0.5mol/L的Na2CO3溶液中的CO32-数目为0.5N A 10.36.5g的HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为w,物质的量浓度为c,N A 表示阿伏伽德罗常数,则下列说法正确的是A.c=1.0mol/L B.所得溶液中含有N A个HCl分子C.36.5gHCl气体占有的体积为22.4LD.w=36.5c/(1000ρ)11.某溶液中存在下列各组离子,向该溶液中投入Al粉,只产生H2,则溶液中可能可以大量存在的离子组是A.SO42-Cl- NH4+ Fe2+ B.Na+K+ HCO3- Cl-C.Fe3+ SO42- NO3- Na+ D.ClO-Na+ SO32- K+12.下列离子方程式的书写正确的是A.向0.1mol/L HCl溶液中加入少量的0.1mol/L的Na2CO3溶液:CO32- + H+ = HCO3-B.NaHCO3溶液中滴加过量的Ca(OH)2溶液:HCO3- + Ca2+ + OH-= CaCO3↓ + H2OC.氢氧化钙溶液与稀硫酸混合:Ca2++ OH-+ H++ SO42- = CaSO4↓+ H2OD.向NaClO中通入过量的SO2:ClO- + SO2 + H2O = HClO + HSO3-13.已知神九火箭中使用的燃料为偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4)。
2019届韶关市高考调研考试理综化学试卷可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56 Cu 641.港珠澳大桥水泥的使用量约198万吨。
水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:下列叙述正确的是A. 水泥、玻璃、陶瓷为传统的硅酸盐材料,三者的原料都主要为SiO2B. 沉淀A主要成分为SiO2,沉淀B为Fe(OH)3、Al(OH)3C. 为了加快溶解速率,使用盐酸代替硫酸处理草酸钙D. 草酸钙易溶于水【答案】B【解析】【详解】A.水泥、玻璃、陶瓷均为硅酸盐工业产品,所以主要成分是硅酸盐,三者的原料不同,三者的原料并非都主要为SiO2,例如:陶瓷的主要原料有黏土等,水泥的主要原料有石灰石和黏土(铝硅酸盐),故A错误;B.水泥样品的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物,加入氯化铵、盐酸和硝酸,由于二氧化硅与酸不反应,则得到的沉淀A为SiO2,滤液中含有Ca2+、Fe3+、Al3+、Mg2+等离子,加入氨水调节pH到4~5之间,可生成Al(OH)3、Fe(OH)3沉淀,则沉淀B为Fe(OH)3、Al(OH)3,故B正确;C.使用盐酸代替硫酸处理草酸钙,在溶液中剩余的盐酸也能被高锰酸钾氧化,从而干扰草酸的测定,进而使测得的钙的含量产生误差,故C错误;D.草酸钙是难溶于水的白色固体,故D错误;本题答案为B。
2.化学与生活密切相关,下列有关物质与用途的因果关系错误..的是A. Fe(OH)3胶体具有较强的吸附性,所以可用于制备红色颜料铁红B. NaClO溶液具有强氧化性,所以可用于生活环境的消毒C. NH4Cl溶液呈酸性,所以可用于除去钢板上的铁锈D. KMnO4溶液可以氧化乙烯,所以可用浸泡过KMnO4溶液的硅藻土作水果保鲜剂【答案】A【解析】【详解】A.Fe(OH)3胶体具有较强的吸附性,可用Fe(OH)3胶体净水,而利用Fe(OH)3分解生成Fe2O3,制备红色颜料铁红,故A错误;B.NaClO中Cl元素化合价为+1价,NaClO溶液具有强氧化性,所以可用于生活环境的消毒,故B正确;C.因为NH4Cl水解使得NH4Cl溶液显酸性,所以可用于除去钢板上的铁锈,故C正确;D.乙烯是果实的催熟剂,KMnO4溶液可以氧化乙烯,所以可用浸泡过KMnO4溶液的硅藻土吸收乙烯,作水果保鲜剂,故D正确;本题答案为A。
【点睛】胶体粒子具有表面积大,吸附能力强的特点,所以Fe(OH)3胶体具有较强的吸附性,可用此性质将水中的悬浮物吸附在胶粒表面,并沉淀使水得到净化。
3.若N A代表阿伏加德罗常数的值,下列说法正确的是A. 常温常压下,18g的D2O含有的中子数、电子数均为10N AB. 1.0 mol/L的FeCl3溶液中Fe3+的个数小于N AC. 标准状况下,2.24 L甲醛中碳氢键的数目为0.2N AD. 密闭容器中,加入2molHI,发生反应:2HI(g) H2(g)+I2(g),达到平衡后气体分子总数小于2N A【答案】C【解析】【详解】A.D2O的摩尔质量为20g/mol,18g的D2O物质的量小于1mol,18gD2O含有的中子数、电子数均小于10N A,故A错误;B.1.0 mol/L的FeCl3溶液中,溶液的体积未知,无法计算Fe3+的个数,故B错误;C.标准状况下,甲醛是气体,2.24 L甲醛的物质的量为1mol,由甲醛的结构式可知,1mol甲醛中碳氢键的数目为0.2N A,故C正确;D.反应2HI(g) H2(g)+I2(g),是反应前后气体体积不变的可逆反应,密闭容器中,加入2molHI,发生反应:2HI(g) H2(g)+I2(g),达到平衡后气体分子总数等于2N A,故D错误;本题答案为C。
4.用下列装置完成相关实验,合理的是A. 验证H2CO3酸性强于H2SiO3B. 收集CO2或NH3C. 分离Na2CO3溶液与CH3COOC2H5D. 分离CH3CH2OH与CH3COOH【答案】B【解析】【详解】A.浓盐酸易挥发,盐酸也能和硅酸钠反应,使硅酸钠溶液变浑浊,故A不合理;B.从左进气右出气可收集CO2,从右进气左出气可收集NH3,故B合理;C.分离Na2CO3溶液与CH3COOC2H5,应用分液漏斗分液的方法分离,故C不合理;D.CH3CH2OH与CH3COOH是互溶的两种液体,不能用分液的方法分离,故D不合理;本题答案为B。
【点睛】用分液漏斗对于互不相溶、密度不同液体进行分离,密度大的在下层,从下口放出,密度小的在上层,从上口倒出;用蒸馏方法分离沸点不同的液态混合物。
5.有关苹果酸的说法正确的是A. 苹果酸中能发生酯化反应的官能团有2种B. 1 mol苹果酸可与3 mol NaOH发生反应C. 1 mol苹果酸与足量金属Na反应生成1 mol H2D. 苹果酸与互为同分异构体【答案】A【解析】【详解】A. 苹果酸中能发生酯化反应的官能团是羧基和羟基,故A正确;B. 苹果酸中只有羧基可以和氢氧化钠发生反应,所以1 mol苹果酸可与2 mol NaOH发生反应,故B错误;C. 苹果酸中能和钠反应的官能团是羟基和羧基,所以1 mol苹果酸与足量金属Na反应生成1.5molH2,故C错误;D. 苹果酸与是同一种物质不是同分异构体,故D错误;本题答案为A。
6.短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z 三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应;M的最高价氧化物对应的水化物为最强酸。
则下列说法正确是A. 原子半径X<M<Z<YB. 非金属性X <M<Z<YC. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性D. MZ2可用于自来水的杀菌消毒【答案】D【解析】【分析】短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z 三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应,符合此反应的应为NH4+OH-NH3H2O,所以X为H、Y为N、Z为O,M为短周期,最高价氧化物对应的水化物为最强酸, M为Cl。
【详解】A.由上述分析可知原子半径大小应为:X< Z <Y< M,故A错误;B.由上述分析可知非金属性:Y <Z,故B错误;C.X、Y、Z三种元素组成的化合物的水溶液可能呈酸性,例如:HNO3、NH4NO3,也可能显碱性,例如NH3·H2O,故C错误;D.由上述分析可知,MZ2是ClO2,具有强氧化性,可用于自来水的杀菌消毒,故D正确;本题答案为D。
【点睛】熟记10电子微粒是解题的关键,常见的10电子微粒有原子:Ne分子:HF、H2O、NH3、CH4单核离子:N3-、O2-、F-、Na+、Mg2+、Al3+多核离子:NH4+、H3O+、OH-、NH2-7.如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,电池反应为:4Li+FeS2=Fe+2Li2S。
下列说法不正确...的是A. 该装置将化学能转化为电能B. 可以用水代替 SO(CH3)2做溶剂C. 电子移动方向是由a极经外电路流向b极D. b极电极反应式是:FeS2+4Li++4e-=Fe+2Li2S【答案】B【解析】【详解】A.锂电池是属于原电池,该装置将化学能转化为电能,故A正确;B.若用水代替SO(CH3)2做溶剂,则水会和锂直接反应而无电流产生,故B错误;C.a为电池的负极,b为电池的正极,电子从电池的负极经外电路流向电池的正极,故C正确;D.b为电池的正极,电极反应式为:FeS2+4Li++4e-=Fe+2Li2S,故D正确;本题答案为B。
8.实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
【査阅资料】① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。
K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
【答案】 (1). 圆底烧瓶 (2). MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (3). 提高KClO 的产率,防止Cl2与KOH反应生成KC1O3 (4). HCl (5). 吸收Cl2,防止污染空气 (6). 3C1O−+2Fe3++10OH−=2FeO42-+3Cl−+5H2O (7). 重结晶 (8).【解析】【分析】(1)装置A是实验室制取氯气的装置,按实验室制取氯气的有关原理回答;(2)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;(3)制取氯气中含有HCl,装置B吸收的气体是HCl,装置D的作用是尾气吸收;(4)KC1O加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,生成K2FeO4和H2O,则KClO被还原成KCl,利用得失电子守恒、电荷守恒等配平书写离子方程式;(5)K2FeO4和KCl均易溶于水,K2FeO4粗产品含有KCl等杂质,应用重结晶的方法分离;(6)依据Fe守恒,计算产率。
【详解】(1)装置A是实验室制取氯气的装置,a是圆底烧瓶,A中发生的反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;本题答案为:圆底烧瓶、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(2)Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以为了提高KClO的产率,防止Cl2与KOH反应生成KC1O3,C中三颈烧瓶置于冰水浴中;本题答案为:提高KClO的产率,防止Cl2与KOH反应生成KC1O3。