高二化学选修水电离和溶液酸碱性课件
- 格式:ppt
- 大小:553.00 KB
- 文档页数:15




水的电离和溶液pH值水的电离和溶液的pH值是电解质溶液的重点和难点,同时也是高考化学试题的热点。
分析多年的高考化学试题,我们不难发现:水的电离和溶液pH值这一知识点试题每年考并且常考常新。
因此,有必要认真加以训练。
相关知识点1、电解质溶液的酸碱性跟水的电离密切相关。
实验证明,水是一极弱电解质,能微弱电离:H2O+H2OH3O++OH-可简写为:H2OH++OH-。
此电离平衡易受外界条件(温度、电解质等)影响,但遵循平衡移动原理。
实验还证明,在溶液中,在一定温度下,[H+]与[OH-]的乘积是一常数,即[H+]·[OH-]=Kw。
Kw简称为水的离子积。
它是一温度函数,随温度升高而增大。
25℃时,Kw=1×10-14,100℃,Kw=1×10-12。
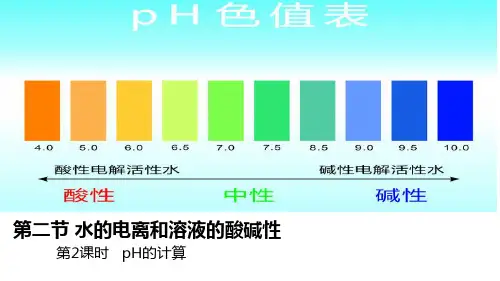
2、电解质溶液的酸碱性取决于[H+]与[OH-]的相对大小。
在常温下,中性溶液[H+]=[OH-]=1×10-7mol/L,酸性溶液[H+]>[OH-];[H+]>1×10-7mol/L;碱性溶液[H+]<[OH-],[H+]<1×10-7mol/L。
3、电解质稀溶液的酸碱性可用pH值大小来统一量度,其定义式:pH=-1g[H+],同样可定义:pH=-1g[OH-],在常温下,pH+pOH=14。
4、电解质溶液pH值的测定:(1)酸碱指示剂是测定溶液的pH值范围。
常用指示剂有:甲基橙、石蕊、酚酞,并熟记它们的变色范围。
(2)pH试纸是粗确测定溶液的pH 值,应掌握其操作步骤。
(3)测定溶液pH值最精确的方法是用pH计。
解题指导1、解答水电离的相关试题时应注意:(1)运用平衡移动原理来分析水的电离平衡移动—定性判断;(2)运用溶液中[H+]·[OH-]=Kw和水电离出的[H+]=[OH-]掌握相关运算—定量计算。
(3)正确处理矛盾的主要方面与次要方面的关系,比如,在处理溶液的稀释、电离与水解等关系时,一定要抓住主要矛盾。