知识点:理想气体与实际气体PPT.
- 格式:ppt
- 大小:208.50 KB
- 文档页数:1







热力学系统的理想气体与实际气体热力学是研究能量转换和能量传递的学科,而热力学系统是指能够与外界发生能量交换的物体或介质。
在热力学的研究中,我们常常涉及到两种类型的气体:理想气体和实际气体。
本文将探讨理想气体与实际气体之间的差异及其在热力学系统中的应用。
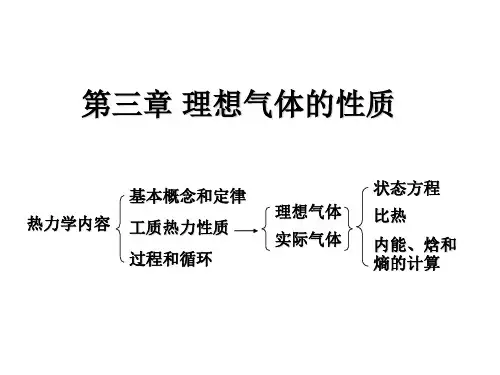
一、理想气体的定义与性质1. 理想气体的定义理想气体是在一定的温度和压力下,具有如下特性:分子之间无相互作用力,分子体积可忽略不计,分子运动符合玻尔兹曼分布定律。
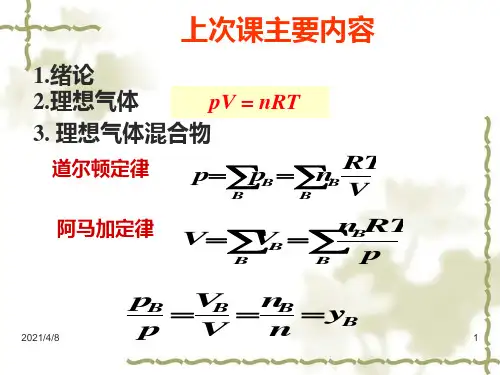
2. 理想气体的性质(1)温度与压力的关系:理想气体的温度与压力成正比,即PV = nRT,其中P为气体的压力,V为气体的体积,n为气体的物质量,R 为气体常数,T为气体的绝对温度。
(2)摩尔体积:理想气体的摩尔体积与温度和压力成反比,即V/n = RT/P。
(3)理想气体的状态方程:理想气体的状态方程可以用来描述气体的状态,即PV = nRT。
(4)理想气体的内能和焓:理想气体的内能只与温度有关,与压力和体积无关;焓是气体的内能与气体对外界做的功之和。
二、实际气体的行为与修正尽管理想气体模型在很多情况下可以提供准确的结果,但在高压、低温等条件下,实际气体的行为与理想气体有很大差异。
实际气体的行为可以通过以下修正来描述。
1. Van der Waals修正Van der Waals修正是一种修正理想气体行为的经验模型。
Van der Waals方程为(P + an²/V²)(V - nb) = nRT,其中a和b分别为Van der Waals方程的修正常数。
这个方程能够更好地描述实际气体的状态。
2. Peng-Robinson修正Peng-Robinson修正是Van der Waals方程的改进版。
Peng-Robinson 方程为P = (RT)/(V - b) - (aα)/(V (V + b)),其中a和b的表示方式与Van der Waals方程略有不同,α是一个校正因子。


热力学知识:热力学中的理想气体和实际气体热力学是一门研究能量转化和传递的学科,其中气体是热力学研究的重点之一。
不同于固体和液体,气体不具有固定的形状和体积,而是具有高度可压缩和可扩张性质。
热力学中,气体大致可分为理想气体和实际气体两类,它们之间的区别和联系是气体热力学研究的重要话题。
理想气体是一种十分简化的模型,它的特点是没有分子之间的相互作用,分子体积可以忽略不计,分子间的碰撞是完全弹性的。
在理想气体模型中,气体分子只受到容器壁的碰撞和分子间弹性碰撞的影响,这使得理想气体状态方程的推导变得非常简单。
理想气体状态方程表达式为PV=nRT,其中P表示气体压强,V表示气体体积,n表示气体摩尔数,R为气体常数,T为气体温度。
理想气体模型的简化带来便利,它可以快速推导出一系列重要的热力学公式和定律,例如达朗贝尔定律、玻意耳定律、查理定律等。
理想气体模型还可以用来描述许多实际气体的近似行为,例如高温下的稀薄气体和某些惰性气体。
另外,理想气体模型具有良好的数学性质,它的状态方程是线性的,易于求解和计算。
然而,实际气体的行为远没有理想气体那么简单。
在实际气体中,分子间存在各种各样的相互作用,例如分子间的引力和斥力、分子体积占据和环境分子的碰撞等。
这些相互作用使得实际气体无法完全遵循理想气体模型的简化条件。
因此,实际气体的状态方程和行为会受到各种复杂的影响,不同种类的气体呈现出不同的物理化学性质。
对于实际气体,热力学研究采用的是状态方程和热力学性质的实验测量。
常用的实际气体状态方程包括范德瓦尔斯方程、文德勒方程、理查兹方程等。
这些方程都考虑了实际气体的复杂性,同时也带来了一些计算上的挑战。
实际气体在不同温度、压强下呈现出不同的行为,例如高压高温下可能会发生相变或受到化学反应的影响,这些都需要通过实验进行研究。
在热力学中,理想气体和实际气体之间的对比非常重要。
理想气体模型可以帮助我们推导出气体的基本性质和定律,为热力学研究提供基础模型。