镰刀型细胞贫血症
- 格式:doc
- 大小:133.00 KB
- 文档页数:5

镰刀型细胞贫血症及其发病机理人类的贫血症是由于身体无法制造足够的血红蛋白造成的,人类的贫血症有许多种。
其中,镰刀型细胞贫血症属于分子病,是指基因突变使蛋白质的分子结构或合成的量异常直接引起机体功能障碍的一类疾病。
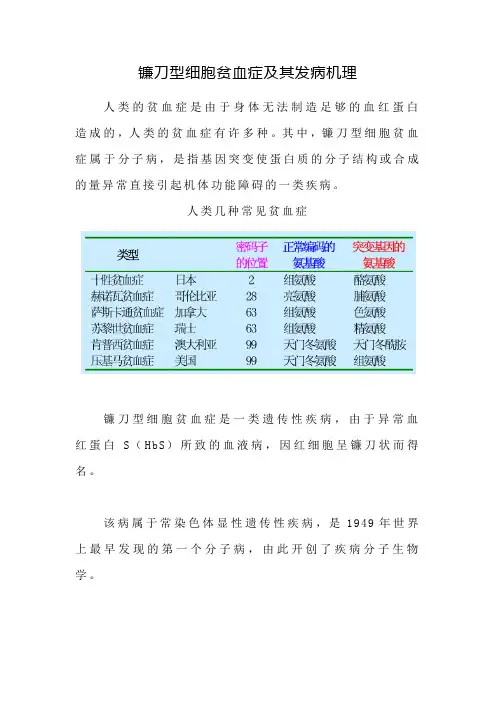
人类几种常见贫血症镰刀型细胞贫血症是一类遗传性疾病,由于异常血红蛋白S(HbS)所致的血液病,因红细胞呈镰刀状而得名。
该病属于常染色体显性遗传性疾病,是1949年世界上最早发现的第一个分子病,由此开创了疾病分子生物学。
该病主要见于非洲黑种人,最初见于非洲恶性疟疾流行区的黑种人中。
HbS杂合子对恶性疟疾具有保护性,单核吞噬系统将镰状细胞连同疟原虫一起清除,疟疾不治自愈,使HbS杂合子患者得以生存。
人教版教材人教版教材认为,正常的GAG突变为GTG(A→T);但浙科版教材认为,正常的GAA突变为GTA(A→T)。
查找一些资料两种情况都有,其中,大多数情况是支持前者,但也有的资料同时说明了两种方式的存在。
另外,除了异常血红蛋白S(HbS),即第6位氨基酸由正常的谷氨酸变成了缬氨酸,形成HbS,还有一种是异常血红蛋白C(HbC),即第6位氨基酸由正常的谷氨酸变成了赖氨酸,形成HbC。
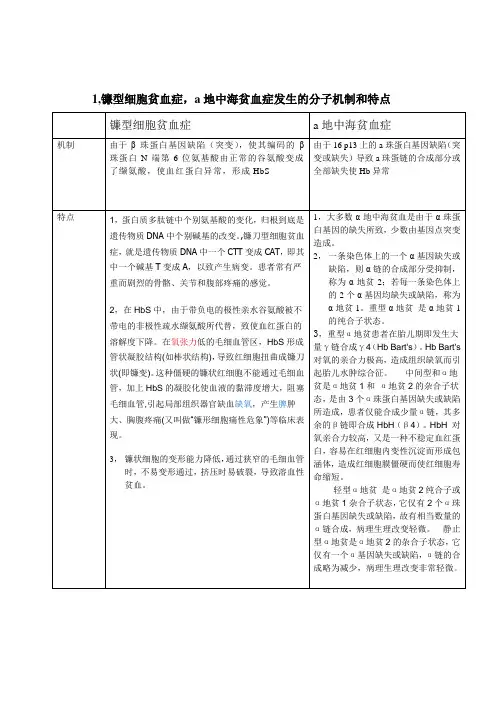
如下所示:发病机理:正常成人血红蛋白是由两条α链和两条β链相互结合成的四聚体,α链和β链分别由141和146个氨基酸顺序连接构成。
镰状细胞贫血的发生是由于β珠蛋白基因的第6位密码子由正常的GAG突变为GTG(A→T),使其编码的β珠蛋白N端第6位氨基酸由正常的谷氨酸变成了缬氨酸,形成HbS。
镰状细胞贫血患者因β链第6位上的谷氨酸被缬氨酸替代形成HbS,HbS在脱氧状态下相互聚集,形成多聚体。
这种多聚体由于其HbS的β链与邻近的β链通过疏水键连接而非常稳定,水溶性较氧合HbS低5倍以上。
纤维状多聚体排列方向与细胞膜平行,并与细胞膜紧密接触,故当有足够的多聚体形成时,红细胞即由正常的双凹形盘状变为镰刀形,此过程称为“镰变”。

镰状细胞贫血症的分子机制镰状细胞贫血症,这个名字听起来是不是有点拗口?咱们聊聊这病,就像讲个故事一样。
想象一下,咱们的血液里有很多红细胞,像小船一样在血管里悠哉游哉地游着,运送氧气,让咱们活力满满。
可是,有些小船却变成了镰刀的形状,怎么回事呢?这就得从咱们的基因说起了。
基因就像是身体的说明书,告诉细胞怎么做它们该做的事情。
镰状细胞贫血症的根本原因,就是这些基因出了点小问题。
有一段时间,科学家们发现,镰状细胞贫血症和一种叫“β珠蛋白”的蛋白质有关。
平常的红细胞里,β珠蛋白和α珠蛋白结合,形成一种叫“血红蛋白”的东西。
正常的血红蛋白像个快乐的小伙伴,帮助红细胞保持圆润的形状,顺利通过血管。
但是,等到基因出问题了,β珠蛋白就变得不那么友好了。
这一变,血红蛋白的形状就跟原来的不一样了,红细胞也就变成了镰刀的模样。
你想想,镰刀形状的红细胞在血管里走动,那可不是轻松的事,简直就像在狭窄的巷子里搬家,走哪都不顺!更有趣的是,这种镰刀状的细胞还特别容易“结伴”,一旦聚在一起,咱们的血管就像被堵住了一样。
哎呀,真是让人心慌慌的。
不仅如此,这些镰刀细胞的寿命也短得可怜,正常的红细胞能活个120天,而镰状细胞可能几天就“退休”了。
这下好了,身体里总是缺少红细胞,导致贫血,身体就像是缺了水的花儿,显得无精打采。
镰状细胞贫血症不光是让人感觉疲惫,还会引起各种麻烦。
比如,疼痛。
那些镰刀形状的细胞在血管里聚集,压迫周围的组织,疼痛感就来了,真是让人恨不得跳脚。
不过,不同的人体验疼痛的感觉不一样,有些人痛得厉害,有些人却只是小痛小痛的,真是个看心情的病。
咱们能不能治好它呢?虽然现在没有彻底根治的办法,但有些治疗方法还是能帮忙。
比如,医生会给病人开一些药物,帮助缓解疼痛,改善生活质量。
有些人甚至接受骨髓移植,换个“新的说明书”,让身体重新开始。
这就像换了个新电脑,运转起来可顺畅多了。
还有些人选择通过饮食来增强身体的抵抗力,像吃些富含叶酸和维生素的食物。

106.镰刀型细胞贫血病概述镰刀型细胞贫血病(sickle cell disease,SCD)是一种常染色体显性遗传血红蛋白(Hb)病。
由于β-肽链第6位的谷氨酸被缬氨酸替代,使血红蛋白S (hemoglobin S,HbS)异常,以致红细胞呈镰刀状得名。
临床表现为慢性溶血性贫血、慢性局部缺血导致器官组织损害、易感染和再发性疼痛危象(以前也称为镰状细胞危象)。
镰状细胞综合征通常用于描述与链状细胞改变现象有关的所有疾病,包括纯合子状态、杂合子状态、HbS与其他异常血红蛋白的双杂合子状态3种主要表现形式,而镰状细胞贫血病这一术语则通常用于描述HbS的纯合状态。
病因和流行病学镰状细胞贫血病是1949年世界上发现的第一个分子病,由此开创了疾病分子生物学。
正常成人血红蛋白是由两条α链和两条β链相互结合成的四聚体,α链和β链分别由141和146个氨基酸顺序连接构成。
镰状细胞贫血患者因β链第6位氨基酸谷氨酸被缬氨酸所代替,形成了异常HbS,取代了正常血红蛋白(HbA),在脱氧状态时HbS分子间相互作用,聚集成为溶解度很低的螺旋形多聚体,使红细胞扭曲成镰状细胞(镰变)。
这种多聚体形似长绳状,由于其HbS的β链与邻近的β链通过疏水链连接,结构非常稳定,水溶性较氧合HbS 降低5倍以上。
纤维状多聚体与细胞膜平行紧密接触,也常与其他纤维连成线,所以当有足够多的多聚体形成时,红细胞即由正常的双凹圆盘状扭曲变为典型的新月形或镰刀形,并导致红细胞变形性显著下降。
脱氧HbS的聚合是慢性缺血、血管阻塞现象的必要条件。
红细胞内HbS浓度、脱氧程度、酸中毒、红细胞脱水程度等许多因素与红细胞镰变有关。
红细胞镰变的初期是可逆的,给予氧即可逆转镰变过程。
但当镰变已严重损害红细胞膜后,镰变就变为不可逆,即使将这种细胞置于有氧条件下,红细胞仍保持镰状。
镰变的红细胞僵硬,变形性差,可受血管的机制破坏和单核巨噬系统吞噬而发生溶血。
镰变的红细胞还可使血液黏滞性增加,血流缓慢,加之变形性差,易堵塞毛细血管引起局部缺氧和炎症反应导致相应部位产生疼痛危象,多发生于肌肉、骨骼、四肢关节、胸腹部,尤以关节和胸腹部为常见。

镰刀形红细胞贫血的生化机制镰刀形红细胞贫血,听起来有点吓人,其实它就是咱们的红血球变得像镰刀一样,真是让人哭笑不得。
想象一下,正常的红细胞就像一个个小圆饼,轻轻松松地在血液中畅游,带着氧气去喂养全身的细胞。
但这镰刀形的家伙,哎呀,完全变了个样,变得硬邦邦,样子就像个不怎么好吃的弯曲面条。
它们一旦进入血管,就会跟正常的细胞打架,造成血液流动不畅,真是麻烦透顶。
为什么会发生这样的事情呢?其实啊,镰刀形红细胞贫血跟遗传有很大关系。
像个顽皮的小孩,咱们的基因就会传递一些不太靠谱的指令,导致红细胞在制造的时候出错。
换句话说,就是我们身体里的“工厂”出了问题。
那些工厂原本应该造出圆圆的细胞,却偏偏做出了这种难看的镰刀形,简直是给我们身体制造了不少困扰。
要知道,这种贫血可不是闹着玩的,常常让人感到疲惫不堪,甚至出现疼痛,仿佛身上背着个大石头一样,动都动不了。
更有意思的是,这种病在某些地方尤其常见,像非洲、地中海地区,简直是个“流行病”。
许多家长常常无奈地看着孩子,心里想着:哎,怎么就偏偏撞上了这样的运气呢?再加上,镰刀形红细胞在一些特定的情况下,比如缺氧或者脱水,表现得特别“活跃”,像是在血管里搞事情,惹得周围的细胞也跟着慌张。
就像是在一场热闹的舞会上,有人忽然跌倒,大家都跟着乱了阵脚,场面一度失控。
生活中,这种贫血可不是小事,真的是影响了一大堆事情。
咱们常常听到有人说,身体是革命的本钱,这话可真不假。
镰刀形红细胞贫血让很多人无法正常生活,工作、学习都受到影响,心情也跟着跌到了谷底。
有人可能会觉得这只是小病,实则不然,长时间的贫血,身体的各个器官都可能受到影响,真是捡了芝麻,丢了西瓜。
在治疗上,医生通常会采取一些手段来改善病情。
有些人需要定期输血,给身体补充正常的红细胞,像给植物浇水一样,才能让它们恢复活力。
还得服用一些药物来促进红细胞的生成,真的是无微不至,生怕出一点岔子。
再加上,饮食上也要讲究,富含叶酸和铁的食物绝对是我们的好朋友,像菠菜、红肉,都是补血的好帮手。



[病因]红细胞内含有HbS其化学性质与正常血红蛋白A不同。
HbS在低氧状态
下其溶解度降低聚合成为螺旋状,拉长后使红细胞扭曲成镰刀形,此时红细胞失去弹性
H其“可变性”减低,不易通过毛细血管。
加上毛细血管中血液粘滞度增加,血流缓慢,局部缺氧,更进~步促成镰刀状红细胞之形成,随之导致在网状内皮系统破坏而溶m,
青岛医学院内科血液病组编.实用血液病学.青岛医学院,.
镰刀细胞贫血即Hb—S的纯合子状态,是一种慢性,遗传性溶血性贫血。
患者自父母二人各遗传到一个Hb—S基因,红细胞中有Hb—S,没有Hb—A。
在低氧条件下,红细胞变成镰刀形
陈文杰陈辉树编著.造血系统疾病临床病理学.北京医科大学,1997年06月第1版.
病理学基础:镰刀红细胞变形性很差,使红细胞变得僵硬,在微细的毛细血管中不易通过、引起血管堵塞,造成局部缺氧,又加重红细胞发生镰刀形变,造成恶性循环。
血管堵塞引起血栓形成和梗塞,因此脾脏常发生梗死。
这种梗死的形态学改变并无特征性与其它原因所致的梗死相似。
未发生梗死的部位与其它先天性溶血性贫血和椭圆形红细胞增多症等脾脏形态无明显不同,可见红髓充血或淤血,脾窦受压,髓外造血及含铁血黄素沉着(图2—19)。
梗死也可发生在其它器官,并引起相应的症状,如下肢溃疡,骨坏死,血尿,肺出血坏死或
陈文杰陈辉树编著.造血系统疾病临床病理学.北京医科大学,1997年06月第1版.。

镰刀型细胞贫血症的遗传机制概述及解释说明引言是文章的开场白,它对主题进行了概述并介绍了文章的结构和目的。
在这篇关于镰刀型细胞贫血症遗传机制的长文中,引言将包括以下内容:1.1 概述:镰刀型细胞贫血症(Sickle Cell Anemia,简称SCA)是一种常见的遗传性血液疾病,它主要影响到人体内的红细胞,并导致氧气供应不足。
SCA在全球范围内广泛存在,在一些地区甚至呈高发态势。
其严重程度因个体而异,但患者通常会经历严重的疼痛发作、溶血性贫血以及各种可能损害脏器功能的并发症。
1.2 文章结构:本文将从三个方面来阐述镰刀型细胞贫血症遗传机制:首先介绍镰刀型细胞贫血症的基本情况和相关知识;接着分析该疾病的遗传基础以及造成发生过程变化的分子机制;最后对已有成果进行总结并展望未来的研究方向,同时给出临床管理方面的建议。
1.3 目的:本文旨在提供一个关于镰刀型细胞贫血症遗传机制的综述,并通过深入剖析该疾病相关基因及分子过程来促进对其治疗和预防方法的进一步研究。
同时,本文希望为临床医生和患者提供一些建议以更好地管理镰刀型细胞贫血症患者的健康。
以上是“1. 引言”部分内容的详细清晰撰写。
2. 镰刀型细胞贫血症介绍:2.1 定义与历史背景:镰刀型细胞贫血症是一种遗传性血液疾病,主要影响红细胞的形态和功能。
它最早被描述于20世纪初,在非洲地中海沿岸地区首次发现。
镰刀型细胞贫血症得名于其引起的异常红细胞形态,这些受影响的红细胞呈半月形或弯曲的外观,类似于锚爪中的镰刀。
2.2 病因和发病机制:镰刀型细胞贫血症是由基因突变引起的遗传疾病。
正常情况下,红细胞内含有一种称为血红蛋白(Hb)的蛋白质,它们帮助携带氧输送到身体各个部位。
然而,在镰刀型细胞贫血症患者中,出现了一种称为HbS的异常变异形式,这导致了正常Hb结构的改变。
当体内氧气水平降低或在高度负荷的情况下,HbS会聚集并形成红细胞内的不稳定链。
这种聚集导致红细胞变得更加脆弱和易碎。
镰刀型细胞贫血症镰刀型细胞贫血症是20世纪初被人们发现的一种遗传病。
1910年,一个黑人青年到医院看病,他的症状是发烧和肌肉酸痛。
经过检查发现,他患的是当时人们尚未认识的一种特殊的贫血症,他的红细胞不是正常的圆饼状,而是弯曲的镰刀状。
后来,人们就把这种病称为镰刀型细胞贫血症。
镰刀型细胞贫血症主要发生在黑色人种中,在非洲黑人中的发病率最高,在意大利、希腊等地中海沿岸国家和印度等地,发病人数也不少,在我国的南方地区也发现有这类病例。
1928年,人们就已经了解到镰刀型细胞贫血症是一种遗传病。
后来证实,它是一种常染色体隐性遗传病。
1949年,一位曾经两次获得诺贝尔奖的美国著名化学家鲍林(L·C·Pauling),在美国的《科学》杂志上发表了题为《镰刀型细胞贫血症——分子病》的研究报告。
他在文章中写道:“在我们的研究开始之时,有证据表明红细胞镰变的过程可能是与红细胞内血红蛋白的状态和性质密切相关的。
”鲍林将正常人、镰刀型细胞贫血症患者和镰刀型细胞贫血症基因携带者的血红蛋白,分别放在一定的缓冲溶液中进行电泳,发现正常人和患者的血红蛋白的电泳图谱明显不同,而携带者的血红蛋白的电泳图谱,与由正常人的和患者的血红蛋白以1∶1的比例配成的混合物的电泳图谱非常相似。
鲍林推测镰刀型细胞贫血症是由于血红蛋白分子的缺陷造成的。
正常的血红蛋白是由两条α链和两条β链构成的四聚体,其中每条肽链都以非共价键与一个血红素相连接。
α链由141个氨基酸组成,β链由146个氨基酸组成。
镰刀型细胞贫血症患者的血红蛋白的分子结构与正常人的血红蛋白的分子结构不同。
1956年,英格拉姆(Ingram)等人用胰蛋白酶把正常的血红蛋白(HbA)和镰刀型细胞的血红蛋白(HbS)在相同条件下切成肽段,通过对比二者的滤纸电泳双向层析谱,发现有一个肽段的位置不同。
也就是说,HbS和HbA的α链是完全相同的,所不同的只是β链上从N末端开始的第6位的氨基酸残基,在正常的HbA分子中是谷氨酸,在病态的HbS分子中却被缬氨酸所代替。
生化PBL病例211临本2班第二小组1.血红蛋白的ɑ-链和β-维持血红蛋白的空间结构有何特点?维持血红蛋白四级空间的力量包括哪些化学键?(1) 血红蛋白是由四条多肽链组成的──二条α链(每条α链含141个氨基酸残基)和二条β链(每条β链含146个氨基酸残基)。
每条多肽链的螺旋结构形成一个疏水性的空间,可保护血红素分子不与水接触,Fe2+不被氧化。
Fe2+位于血红素卟啉环的中央,与卟啉环的4个吡咯基、O2及多肽链上的组氨酸形成六配位体。
每个血红蛋白分子可逆结合4个氧分子,每克血红蛋白可结合1.34 mL氧气。
(2)范德华力、氢键、离子键和疏水键作用还有亚基间的二硫键。
——选自【血液病】黄晓军主编及生物化学教材2.镰刀细胞性贫血的分子基础是什么(基因和蛋白质的改变)?用什么方法可以诊断?根本原因是基因的改变,第十七位的碱基T由A代替,最终导致翻译出的蛋白质改变,即导致细胞镰化的直接原因,原本的谷氨酸被缬氨酸所代替,谷氨酸为带负电荷的极性亲水氨基酸,而缬氨酸为不带电荷的非极性疏水氨基酸,这种疏水性导致导致血红蛋白的溶解度大大降低,当氧分压低时(如血液流至毛细血管处),HbS会形成棒状凝胶结构,使红细胞扭曲成镰刀状,红细胞的变形性降低可引起溶血。
[诊断]可应用镰刀试验,血红蛋白溶解性,电泳及色层柱析法等,并结合临床表现作出诊断。
3.为什么患者的红细胞会变成镰刀状?正常的谷氨酸被缬氨酸代替,缬氨酸是一个疏水氨基酸,这样的氨基酸分子暴露在血红蛋白分子外部是不利的。
由于这样的疏水作用,血红蛋白分子的这个位点不易与水结合,水溶性降低,众多的血红蛋白分子相互聚集沉淀,形成纤维状的纤维沉淀。
这样的结果是使得红细胞的形态结构发生变化,红细胞特有的圆饼状结构消失,变成扁平细长的镰刀型细胞。
4.患者产生症状(贫血、疼痛等)的病理学基础是什么?僵硬的镰形红细胞难以通过微循环,加上凝胶化结构使血液粘滞性增加,阻塞微循环引起局部缺血缺氧,甚至坏死,产生剧痛。
根据血管闭塞的部位不同,导致不同器官的病变,如肝、肾、脑、心损伤等.又由于这种镰变红细胞的变形性降低,易在脾和肝阻留破坏,出现溶血性贫血症状。
——选自【医学遗传学】第二版446页5.镰刀细胞性贫血在世界范围内的分布有何特点?非洲和美洲的黑人为主,杂合子状态者占非洲黑人的20%,美国黑人群的8% ,此外也见于希腊、意大利、土耳其、中东、土著印第安人及上述民族长期通婚的人群。
杂合子之间通婚,其1/4 子女为纯合子。
而在我国见于两广及香港、台湾。
本病多见于非洲、美洲黑人,也见于中东、希腊、土籍印第安人及与上述民族长期通婚的人群。
1987年我国首次报道此病⋯,但其亲代系非洲黑人。
6.镰刀细胞性贫血的血红蛋白在电泳行为上与正常血红蛋白有何差别?正常血红蛋白电泳区带:HbA>95%,HbF<2%,HbA2为1.0%~3.1%。
通过与健康人血红蛋白电泳图谱进行比较,可发现异常血红蛋白区带,如HbH、HbE、HbBarts、HbS 、HbD 和HbC等异常血红蛋白。
镰状细胞贫血血红蛋白电泳显示HbS占80%以上,HbF增多至2%~15%,HbA2正常,而HbA缺如。
7.人血红蛋白(HbA)由哪些肽链组成?这些肽链在一级结构上有何差别?由两条α肽链(每条α链含141个氨基酸残基)和两条β肽链(每条β链含146个氨基酸残基)组成蛋白质一级结构:指多肽中从N-端到C-端的氨基酸序列,包括二硫键的位置。
主要化学键为肽键。
氨基酸数量的差别9.概念蛋白质的一级结构(primary structure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。
它是由基因上遗传密码的排列顺序所决定的。
各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。
蛋白质的二级结构(secondary structure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
蛋白质的三级结构是蛋白质的多肽链在各种二级结构的基础上再进一步盘曲或折迭形成具有一定规律的三维空间结构。
蛋白质三级结构的稳定主要靠次级键,包括氢键、疏水键、盐键以及范德华力(V an der Wasls力)等。
这些次级键可存在于一级结构序号相隔很远的氨基酸残基的R基团之间,因此蛋白质的三级结构主要指氨基酸残基的侧链间的结合。
次级键都是非共价键,易受环境中pH、温度、离子强度等的影响,有变动的可能性。
二硫键不属于次级键,但在某些肽链中能使远隔的二个肽段联系在一起,这对于蛋白质三级结构的稳定上起着重要作用。
蛋白质的四级结构具有二条或二条以上独立三级结构的多肽链组成的蛋白质,其多肽链间通过次级键相互组合而形成的空间结构称为结构域(domain)也是蛋白质构象中二级结构与三级结构之间的一个层次。
在较大的蛋白质分子中,由于多肽链上相邻的超二级结构紧密联系,形成二个或多个在空间上可以明显区别它与蛋白质亚基结构的区别。
一般每个结构域约由100-200个氨基酸残基组成,各有独特的空间构象,并承担不同的生物学功能。
如免疫球蛋白(IgG)由12个结构域组成,其中两个轻链上各有2个,两个重链上各有4个;补体结合部位与抗原结合部位处于不同的结构域。
一个蛋白质分子中的几个结构域有的相同,有的不同;而不同蛋白质分子之间肽链中的各结构域也可以相同。
如乳酸脱氢酶、3-磷酸甘油醛脱氢酶、苹果酸脱氢酶等均属以NAD+为辅酶的脱氢酶类,它们各自由2个不同的结构域组成,但它们与NAD+结合的结构域构象则基本相同。
氢键:与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y 形式的键,称为氢键。
(X与Y可以是同一种类原子,如水分子之间的氢键)疏水键(hydrophobic bond)是两个不溶于水的分子间的相互作用。
当分子中烃基链与水接触时,因不能被水溶剂化,界面水分子整齐地排列,导致系统熵值降低,能量增加,产生表面张力。
为了克服表面张力,疏水基团会收缩、卷曲和结合,将原来规则排布于表面的水分子排挤出,使疏水表面减少,转换出的水分子呈无序态,熵值回升,焓变值减少,从而降低系统能量。
这种非极性的烃基链因能量效应和熵效应等热力学作用是疏水基团在水中的相互结合作用成为疏水键。
α-螺旋:蛋白质中常见的一种二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。
每个氨基酸残基(第n个)的羰基氧与多肽链C端方向的第4个残基(第n+4个)的酰胺氮形成氢键。
在典型的右手α-螺旋结构中,螺距为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。
β-转角:蛋白质分子中,肽链经常会出现180°的回折,在这种回折角处的构象就是β-转角(β-turn或β-bend)。
β-转角中,第一个氨基酸残基的C=O与第四个残基的N桯形成氢键,从而使结构稳定β-折叠结构(β-sheet):又称为β-折叠片层(β-plated sheet)结构和β-结构等,是蛋白质中的常见的二级结构,是由伸展的多肽链组成的。
折叠片的构象是通过一个肽键的羰基氧和位于同一个肽链或相邻肽链的另一个酰胺氢之间形成的氢键维持的。
氢键几乎都垂直伸展的肽链,这些肽链可以是平行排列(走向都是由N到C方向);或者是反平行排列(肽链反向排列)。
非极性氨基酸:氨基酸的R基团不带电荷或极性极微弱,如:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸。
它们的R基团具有疏水性。
极性氨基酸:氨基酸的R基团带电荷或有极性极性中性氨基酸:R基团有极性,但不解离,或仅极弱地解离,它们的R基团有亲水性。
如:丝氨酸、苏氨酸、半胱氨酸、酪氨酸、谷氨酰胺、天门冬酰胺。
酸性氨基酸:R基团有极性,且解离,在中性溶液中显酸性,亲水性强。
如天门冬氨酸、谷氨酸。
碱性氨基酸:R基团有极性,且解离,在中性溶液中显碱性,亲水性强。
如组氨酸、赖氨酸、精氨酸。
离子键:又被称为盐键,是化学键的一种,通过两个或多个原子或化学集团失去或获得电子而成为离子后形成。
带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时,表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。
因此,离子键是阳离子和阴离子之间由于静电作用所形成的化学键。
范德华力之一范德华力是存在于分子间的一种吸引力,它比化学键弱得多。
一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。
范德华力之二范德华力也叫分子间力。
分子型物质能由气态转变为液态,由液态转变为固态,这说明分子间存在着相互作用力,这种作用力称为分子间力或范德华力。
分子间力有三种来源,即色散力、诱导力和取向力。
色散力是分子的瞬时偶极间的作用力,它的大小与分子的变形性等因素有关。
一般分子量愈大,分子内所含的电子数愈多,分子的变形性愈大,色散力亦愈大。
诱导力是分子的固有偶极与诱导偶极间的作用力,它的大小与分子的极性和变形性等有关。
取向力是分子的固有偶极间的作用力,它的大小与分子的极性和温度有关。
极性分子的偶极矩愈大,取向力愈大;温度愈高,取向力愈小。
在极性分子间有色散力,诱导力和取向力;在极性分子与非极性分子间有色散力和诱导力;在非极性分子间只有色散力。
实验证明,对大多数分子来说,色散力是主要的;只有偶极矩很大的分子(如水),取向力才是主要的;而诱导力通常是很小的。
范德华力之三在物质的聚集态中,分子间存在着一种较弱的吸引力,作用能的大小一般只有每摩尔几千焦至几十千焦,比化学键的键能小1~2个数量级,亦称范德华引力或范氏力。
它由三部分作用力组成:①当极性分子相互接近时,它们的固有偶极将同极相斥而异极相吸,定向排列,产生分子间的作用力,叫做取向力。
偶极矩越大,取向力越大。
②当极性分子与非极性分子相互接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,产生诱导偶极,然后诱导偶极与固有偶极相互吸引而产生分子间的作用力,叫做诱导力。
当然极性分子之间也存在诱导力。
③非极性分子之间,由于组成分子的正、负微粒不断运动,产生瞬间正、负电荷重心不重合,而出现瞬时偶极。
这种瞬时偶极之间的相互作用力,叫做色散力。
分子量越大,色散力越大。
当然在极性分子与非极性分子之间或极性分子之间也存在着色散力。
范德华引力是存在于分子间的一种不具有方向性和饱和性,作用范围在几百个皮米之间的力。
它对物质的沸点、熔点、气化热、熔化热、溶解度、表面张力、粘度等物理化学性质有决定性的影响。