2020-2021学年化学人教版必修2课件:课时作业 1-1-3 核素
- 格式:ppt
- 大小:1.07 MB
- 文档页数:29


第二节元素周期律第1课时原子核外电子的排布一、核外电子的分层排布1.电子的能量(1)在多电子原子里,电子的能量________。
(2)在离核较近的区域内运动的电子的能量________,在离核较远的区域内运动的电子的能量________。
2.电子层(1)概念:在多电子的原子里,电子运动的________的区域简化为________的壳层,称作电子层。
核外电子的排布一般总是尽先从________排起,当一层________后再填充下一层。
4.核外电子的排布规律分析下表和课本表1-2,填写下列空白:(1)最多是____;次外层所能容纳的电子数最多是____;K、L、M、N各电子层所能容纳的电子数最多依次是____、____、____、____。
(2)在元素周期表中,随着元素核电荷数的增加,在____族元素之后,增加了新的电子层并出现了新的周期,该元素最外层电子数是____。
研究各元素原子核外电子排布(课本表1-2)可以发现,稀有气体元素的原子各电子层电子数已达到最多所能容纳的电子数。
原子核外各电子层最多容纳的电子数(电子层数为n)是______。
5.核外电子的分层运动,又叫核外电子的分层排布,其主要规律:(1)原子核外电子总是先排能量________的电子层,然后由____向____,依次排布在能量____________的电子层即排满了____层才排____层,排满了____层才排____层。
(2)原子核外每个电子层最多容纳______个电子。
(3)原子最外层电子数不超过____个电子(K层为最外层不能超过_____个电子)。
(4)原子次外层电子数不超过____个电子(K层为次外层不能超过____个电子。
)二、核外电子排布的表示方法——结构示意图1.原子结构示意图用小圆圈表示原子核,圆圈内的数字表示核内质子数,弧线表示各电子层,弧线上的数字表示该电子层上的电子数,这样的图示称为原子结构示意图。
例如,钠原子的结构示意图为:2.离子结构示意图离子结构示意图与原子结构示意图写法相同,只是在原子结构示意图中,核内质子数等于____________;离子结构示意图中,二者____相等。


第二节元素周期律[激趣导读] 元素周期律的发现,奠定了现代科学的基础。
恩格斯说:“门捷列夫完成了科学上的一个勋业。
”斯大林也给元素周期律以高度的评价,他说:“门捷列夫的元素周期律清楚地表明,由量变而发展到质变在自然发展史中有多么重大的意义。
”就让我们一起在这一节课中探究元素周期律对生产、生活的重大指导意义吧![目标] 1.掌握1~20号元素原子的核外电子排布,并了解核外电子排布规律。
掌握原子的最外层电子排布与元素原子得失电子能力和化合价的关系。
2.掌握元素周期律的实质,及原子核外电子排布、原子半径、主要化合价的周期性变化。
3.根据第3周期元素原子得失电子能力的递变规律,掌握同周期元素原子性质的递变规律。
4.能通过原子结构、元素周期律,推测不熟悉元素的性质,或由其结构、性质推测它在周期表中的位置等。
第1课时原子核外电子的排布1.电子层根据电子的能量差别和通常运动的区域离核远近不同,把核外电子通常运动的不同区域看成不同的电子层。
各电子层的序号、能量见下表:2.核外电子排布的一般规律①核外电子总是尽可能排布在能量最低的电子层里,然后再排布在能量较高的电子层里。
即电子层最先排满K层,当K层排满时再排布在L 层中等等。
②各核外电子层最多容纳的电子数目是2n2个(n为电子层序数)。
③最外层电子数目不超过8个(K层为最外层时不超过2个)。
④次外层电子数目不超过18个,倒数第三层不超过32个。
说明:以上规律是互相联系的,不能孤立地理解。
例如:当M层是最外层时,最多可排8个电子,当M层不是最外层时,最多可排18个电子。
3.画出下列微粒的结构示意图探究点一原子核外电子的排布规律及表示方法1.核外电子排布规律在含有多个电子的原子里,电子依能量的不同分层排布,其主要规律是:(1)核外电子首先排布在能量最低的第一电子层,然后由里向外,依次排布在能量逐步升高的电子层。
(2)原子核外各电子层最多排布2n2个电子。
(3)原子最外层电子数目不能超过8个(K层为最外层时电子数不能超过2个)。


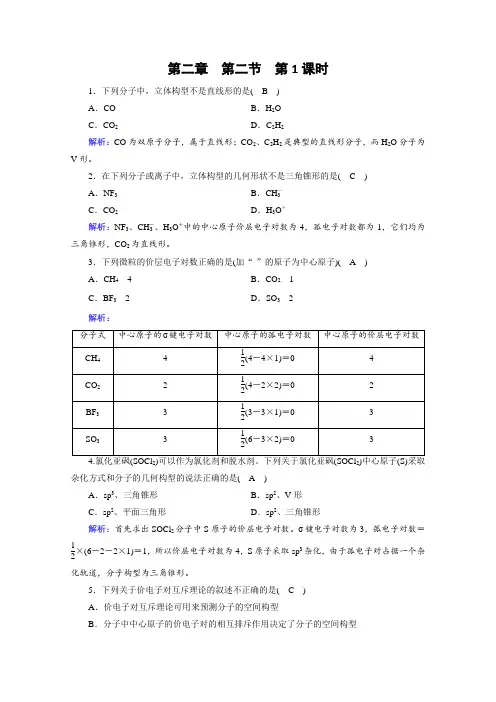
第二章 第二节 第1课时1.下列分子中,立体构型不是直线形的是( B ) A .CO B .H 2O C .CO 2D .C 2H 2解析:CO 为双原子分子,属于直线形;CO 2、C 2H 2是典型的直线形分子,而H 2O 分子为V 形。
2.在下列分子或离子中,立体构型的几何形状不是三角锥形的是( C ) A .NF 3 B .CH -3 C .CO 2D .H 3O +解析:NF 3、CH -3、H 3O +中的中心原子价层电子对数为4,孤电子对数都为1,它们均为三角锥形,CO 2为直线形。
3.下列微粒的价层电子对数正确的是(加“·”的原子为中心原子)( A ) A .C ·H 4 4 B .C ·O 2 1 C .B ·F 3 2 D .S ·O 3 2 解析:22杂化方式和分子的几何构型的说法正确的是( A )A .sp 3、三角锥形B .sp 2、V 形C .sp 2、平面三角形D .sp 2、三角锥形解析:首先求出SOCl 2分子中S 原子的价层电子对数。
σ键电子对数为3,弧电子对数=12×(6-2-2×1)=1,所以价层电子对数为4,S 原子采取sp 3杂化,由于孤电子对占据一个杂化轨道,分子构型为三角锥形。
5.下列关于价电子对互斥理论的叙述不正确的是( C ) A .价电子对互斥理论可用来预测分子的空间构型B .分子中中心原子的价电子对的相互排斥作用决定了分子的空间构型C .中心原子上的孤电子对不参与相互排斥作用D .分子中键角越大,价电子对之间的斥力越小,分子越稳定解析:中心原子上的孤电子对会占据中心原子周围的空间,并参与相互排斥作用。
6.下列分子或离子的中心原子,带有一对孤电子对的是( D ) ①BeCl 2 ②CH 4 ③NH 3 ④CH 2O ⑤SO 2 ⑥H 2S ⑦CO 2-3 ⑧NH +4 A .②③⑤⑥⑦ B .③⑦⑧ C .④⑥⑧D .③⑤解析:根据孤电子对数=12(a -xb ),可以计算出各微粒中心原子的孤电子对数分别为0、0、1、0、1、2、0、0,故含有一对孤电子对的是③⑤。



一、选择题(每小题4分,共48分,每小题只有一个正确选项)1.下列关于化学观或化学研究方法的叙述中,错误的是(D) A.在化工生产中应遵循“绿色化学”的思想B.在过渡元素中寻找优良的催化剂C.在元素周期表的金属和非金属分界线附近寻找半导体材料D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4解析:氟元素没有正价,D选项错误。
2.原子结构决定元素的性质,下列说法正确的是(B)A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O C.第二周期元素的最高化合价都等于其原子的最外层电子数D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强解析:Na+、Al3+的电子层结构相同,Al的核电荷数大,离子半径较小,Cl-的电子层数最多,离子半径最大,故离子半径:Cl->Na +>Al3+,A错误;第ⅥA族中O元素的非金属性最强,对应的氢化物最稳定,B正确;O元素、F元素没有最高化合价,C错误;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,不是最高价氧化物对应的水化物,其酸性不一定符合此规律,如非金属性:Cl>S,但次氯酸是弱酸,硫酸是强酸,D错误。
3.X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。
若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是(B)A.X的气态氢化物比Y的稳定B.W的最高价氧化物对应水化物的酸性比Z的强C.Z的非金属性比Y的强D.X与Y形成的化合物都易溶于水解析:四种元素都是短周期元素,且“Y原子的最外层电子是内层电子数的3倍”,故Y是氧元素,X是氮元素、Z是硫元素、W 是氯元素。
根据元素周期律推断知,只有B选项正确。
4.W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示。
已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是(D)A.X的非金属性是同周期中最强的B.对应气态氢化物的稳定性:Y>ZC.对应简单离子半径:X>WD.Y的氧化物能与X的最高价氧化物对应的水化物反应解析:根据条件可知,W的原子序数是8,则W是氧元素,又因为W、X、Y、Z的原子序数递增,原子半径X最大,且X和氖原子的核外电子数相差1,故X是钠,Y的单质是一种常见的半导体材料,则Y是硅,Z的非金属性在同周期元素中最强,则Z是氯。

第2课时键参数——键能、键长与键角1.根据键能数据(H—Cl 431 kJ·mol-1,H—I 297 kJ·mol-1),可得出的结论是()A.溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸B.HI比HCl的熔、沸点高C.HI比HCl稳定D.断裂等物质的量的HI和HCl中的化学键,HI消耗的能量多2.能够用键能的大小作为主要依据来解释的是 ()A.常温常压下,氯气呈气态而溴单质呈液态B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸C.稀有气体一般难于发生化学反应D.空气中氮气的化学性质比氧气稳定3.在下列的比较中错误的是 ()A.强度:σ键>π键B.键角:H2O<CO2C.键长:H—F>F—FD.键能:C—C>C—Si4.三氯化磷分子的空间结构是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间结构理由的叙述,正确的是()A.PCl3分子中P—Cl三个共价键的键长、键角都相等B.PCl3分子中P—Cl三个共价键键能、键角均相等C.PCl3分子中的P—Cl键属于极性共价键D.PCl3分子中P—Cl键的三个键角都是100.1 °,键长相等5.下列说法正确的是()A.氯化氢的分子式是HCl而不是H2Cl,是由共价键的方向性决定的B.CH4分子的空间结构是正四面体形,是由共价键的饱和性决定的C.电子云在两个原子核间重叠后,电子在两核间出现的概率增大D.分子中共价键键长越长,键能越大,则分子越稳定6.能说明BF3分子中四个原子在同一平面的理由是 ()A.任意两个键的夹角为120°B.B—F键是非极性共价键C.三个B—F键的键能相同D.三个B—F键的键长相等7.由短周期前10号元素组成的物质T和X,有如图L2-1-3所示的转化。
X不稳定,易分解。
下列有关说法正确的是()图L2-1-3A.为使该转化成功进行,Y可以是酸性KMnO4溶液B.等物质的量的T、X分子中含有π键的数目均为N AC.X分子中含有的σ键个数是T分子中含有的σ键个数的2倍D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键8.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是()A.键角是描述分子空间结构的重要参数B.因为H—O键的键能小于H—F键的键能,所以O2、F2与H2反应的能力逐渐减弱C.水分子可表示为H—O—H,分子中的键角为180°D.H—O键的键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗的能量为2×463 kJ9.氰气的化学式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似。