最新初中化学还原反应
- 格式:doc
- 大小:163.00 KB
- 文档页数:8

还原反应化学初中教案全套
一、教学目标:
1. 了解还原反应的概念和特点;
2. 掌握还原反应的基本原理;
3. 能够辨别还原反应与氧化反应;
4. 能够正确描述还原反应的化学方程式。
二、教学内容:
1. 还原反应的概念和特点;
2. 还原反应的基本原理;
3. 还原反应与氧化反应的区别;
4. 还原反应的化学方程式。
三、教学重点与难点:
1. 还原反应的概念和特点;
2. 还原反应的化学方程式。
四、教学过程:
1. 导入:通过案例引入还原反应的概念;
2. 讲解:介绍还原反应的特点和基本原理;
3. 演示:进行实验演示还原反应的过程;
4. 练习:让学生进行练习,练习还原反应的化学方程式;
5. 总结:对还原反应进行总结,澄清重点难点。
五、教学辅助工具:
1. 实验仪器及材料;
2. 讲义PPT;
3. 案例分析。
六、教学评价:
1. 参与学生情况;
2. 学生练习情况;
3. 学生对还原反应的理解情况。
七、教学反思:
1. 教案设计合理性;
2. 教学环节流程是否合理;
3. 学生反馈及教师反馈。

初中化学复分解反应方程式总结1、碱性氧化物+酸→盐+H2OFe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2OCuO+H2SO4==CuSO4+H2O ZnO+2HNO3==Zn(NO3)3+H2O2、碱+酸→盐+H2OCu(OH)2+2HCl==CuCl2+2H2O Cu(OH)2+H2SO4==CuSO4+2H2ONaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2OBa(OH)2+H2SO4==BaSO4↓+2H2O3、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑ Na2CO3+2HCl==2NaCl+H2O+CO2↑HCl+AgNO3==A gCl↓+HNO3 H2SO4+BaCl2==BaSO4↓+2HClBa(NO3)2+H2SO4==BaSO4↓+2HNO3 NaHCO3+HCl==NaCl+H2O+CO2↑4、盐1+盐2→新盐1+新盐2KCl+AgNO3==AgCl↓+KNO3 NaCl+AgNO3==AgCl↓+NaNO3Na2SO4+BaCl2==BaSO4↓+2NaCl BaCl2+2AgNO3==2AgCl↓+Ba(NO3)25、盐+碱→新盐+新碱CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaClCa(OH)2+Na2CO3==CaCO3↓+2NaOH NaOH+NH4Cl==NaCl+NH3↑+H2O初中化学其它反应方程式总结初中化学其它反应方程式总结1、二氧化碳通入澄清石灰水:CO2 +Ca(OH)2 ==CaCO3↓+ H20现象:澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)2、氢氧化钙和二氧化硫反应:SO2 +Ca(OH)2 ==CaSO3+ H203、氢氧化钙和三氧化硫反应:SO3 +Ca(OH)2 ==CaSO4+ H204、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O5、氢氧化钠和二氧化硫反应(除去二氧化硫):2NaOH + SO2 ==== Na2SO3 + H2O6、氢氧化钠和三氧化硫反应(除去三氧化硫):2NaOH + SO3 ==== Na2SO4 + H2O注意:1-6都是:酸性氧化物+碱-------- 盐+ 水7、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O现象:发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊。


初中化学还原反应Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】还原反应一、C 还原氧化铜1、实验装置2、操作:(1)将炭和氧化铜混合均匀,放入大试管中高温加热(2)将生成的气体通入澄清石灰水(3)看到明显的现象后,先将导管移出石灰水,在停止加热(防止倒吸使试管炸裂)3、现象及化学方程式黑色固体逐渐变为红色大试管 C+2CuO====2Cu+CO2澄清石灰水变浑浊小试管CO 2+Ca(OH)2====CaCO 3+H 2O思考:1CO 2外,还可能有CO ,生成该气体的化学方程式: C+CO 22相关化学反应:2Fe 2O 32 2FeO+C====2Fe+CO 2 CO 2+C====2CO 二、H 2还原氧化铜实验装置:1、操作顺序:氢——灯——灯——氢(先通氢气的目的:排尽试管中的空气,防止加热时爆炸)2、现象:黑色粉末逐渐变为红色,试管内壁出现水雾3、实验结论:氢气和氧化铜加热条件下反应生成铜和水H 2+CuO====H 2O+Cu三、CO 还原氧化铜实验装置:1、操作步骤:先通CO 再加热(排尽试管内空气,防止加热时爆炸)。
看到明显现象后,先停止加热,再停止通入COA 、黑色固体逐渐变为红色:CO+CuO====CO 2+Cu2、现象及化学方程式B 、澄清石灰水变浑浊:CO 2+Ca(OH)2+H 2OC 、气体燃烧,产生蓝色火焰:2CO+O 2====2CO 2 3、结论:CO+CuO====CO 2+Cu还原性4、通过该实验可得到CO 的性质可燃性5、装置C 的作用:进行尾气处理(防止气体污染空气)。

初中化学的归纳氧化还原反应的原理与实例解析氧化还原反应是化学反应中最常见的一种类型,它涉及到物质的氧化和还原过程。
在初中化学中,学生需要掌握氧化还原反应的原理和实例。
本文将对初中化学中的氧化还原反应进行归纳与解析。
一、氧化还原反应的原理氧化还原反应是指物质中的原子失去或获得电子的过程。
在化学反应中,如果一个物质失去电子,它被认为是被氧化的;如果一个物质获得电子,它被认为是被还原的。
在氧化还原反应中,发生氧化反应的物质称为氧化剂,它能够接受其他物质的电子;发生还原反应的物质称为还原剂,它能够提供电子给其他物质。
氧化还原反应的核心是电子的转移,即氧化剂从其他物质中获得电子,而还原剂将电子提供给其他物质。
这种电子的转移导致了化学物质的电荷状态发生改变,从而引起了化学反应。
二、氧化还原反应的实例解析1. 钠与氯的反应钠是一种常见的金属元素,其电子排布为2, 8, 1。
氯是一种常见的非金属元素,其电子排布为2, 8, 7。
当钠和氯发生反应时,钠失去了其外层的一个电子,变成了带有正电荷的钠离子Na+,被氧化了。
而氯接受了钠离子失去的电子,变成了氯离子Cl-,被还原了。
综上所述,钠与氯的反应属于氧化还原反应。
2. 铁与氧的反应铁是一种常见的金属元素,其电子排布为2, 8, 14, 2。
氧是一种常见的非金属元素,其电子排布为2, 6。
当铁与氧发生反应时,铁失去了两个电子,变成了带有正电荷的铁离子Fe2+,被氧化了。
而氧接受了铁离子失去的电子,变成了氧离子O2-,被还原了。
综上所述,铁与氧的反应属于氧化还原反应。
3. 硫酸与铜的反应硫酸是一种含有硫元素的酸,其化学式为H2SO4。
铜是一种金属元素,其电子排布为2, 8, 18, 1。
当硫酸和铜发生反应时,硫酸中的氧氧化了铜,使其失去了电子,变成了带有正电荷的铜离子Cu2+,被氧化了。
而硫酸中的氢接受了铜离子失去的电子,形成了氢气H2,并被还原了。
综上所述,硫酸与铜的反应也属于氧化还原反应。

初中化学复分解反应方程式总结1、碱性氧化物+酸→盐+H2OFe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2OCuO+H2SO4==CuSO4+H2O ZnO+2HNO3==Zn(NO3)3+H2O2、碱+酸→盐+H2OCu(OH)2+2HCl==CuCl2+2H2O Cu(OH)2+H2SO4==CuSO4+2H2ONaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2OBa(OH)2+H2SO4==BaSO4↓+2H2O3、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑ Na2CO3+2HCl==2NaCl+H2O+CO2↑HCl+AgNO3==AgCl↓+HNO3 H2SO4+BaCl2==BaSO4↓+2HClBa(NO3)2+H2SO4==BaSO4↓+2HNO3 NaHCO3+HCl==NaCl+H2O+CO2↑4、盐1+盐2→新盐1+新盐2KCl+AgNO3==AgCl↓+KNO3 NaCl+AgNO3==AgCl↓+NaNO3Na2SO4+BaCl2==BaSO4↓+2NaCl BaCl2+2AgNO3==2AgCl↓+Ba(NO3)25、盐+碱→新盐+新碱CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaClCa(OH)2+Na2CO3==CaCO3↓+2NaOH NaOH+NH4Cl==NaCl+NH3↑+H2O初中化学其它反应方程式总结初中化学其它反应方程式总结1、二氧化碳通入澄清石灰水:CO2 +Ca(OH)2 ==CaCO3↓+ H20现象:澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)2、氢氧化钙和二氧化硫反应:SO2 +Ca(OH)2 ==CaSO3+ H203、氢氧化钙和三氧化硫反应:SO3 +Ca(OH)2 ==CaSO4+ H204、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O5、氢氧化钠和二氧化硫反应(除去二氧化硫):2NaOH + SO2 ==== Na2SO3 + H2O6、氢氧化钠和三氧化硫反应(除去三氧化硫):2NaOH + SO3 ==== Na2SO4 + H2O注意:1-6都是:酸性氧化物+碱-------- 盐+ 水7、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O现象:发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊。

初中化学可以被氢气还原的物相
初中化学中被氢气还原的物相主要有:
1. 氧化铜:当氢气与氧化铜反应时,氧化铜会被还原为铜单质,该反应方程式为CuO+H₂=Cu+H₂O。
2. 碳化铁:氢气能还原碳化铁中的铁。
当碳化铁和氢气反应时,碳化铁中的铁元素会被还原出来,生成铁单质和碳单质,该反应方程式为Fe₂C+H₂=2Fe+CH ₂。
3. 氧化亚铁:氢气能还原氧化亚铁中的铁。
当氧化亚铁和氢气反应时,氧化亚铁中的铁元素会被还原出来,生成铁单质和水,该反应方程式为FeO+H₂=Fe+H ₂O。
以上内容仅供参考,建议查阅初中化学教材或咨询化学老师,获取更准确的信息。


化学还原反应定义
还原反应就是物质(分子、原子或离子)得到电子或电子对偏近的反应。
一个完整的化学反应中,还原反应与氧化反应一般是同时存在的。
定义
化学上把物质氧化数降低(得电子)的反应叫做还原反应。
氧化还原反应
简介
氧化还原反应是在反应前后,某种元素的氧化数有变化的化学反应。
这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。
本质上是发生了电子转移(或偏移),但不局限于不同种元素之间。
大多数无机复分解反应都不是氧化还原反应,因为这些复分解反应中的离子互相交换,不存在电子的转移,各元素的氧化数没有变化
置换反应都是氧化还原反应。
有单质参加的化合反应一定是氧化还原反应。
有单质生成的分解反应一定是氧化还原反应。
另外要注意,有单质参加反应的化学反应不一定是氧化还原反应,如氧气生成臭氧(仅中学阶段可以如此认为,实际上由于电子偏移仍然算是氧化还原反应)。
概念
反应的本质是氧化数有变化,即电子有转移。
氧化数升高,即失电子的半反应是氧化反应;氧化数降低,得电子的反应是还原反应。
氧化数升高的物质还原对方,自身被氧化,因此叫还原剂,其产物叫氧化产物;氧化数降低的物质氧化对方,自身被还原,因此叫氧化剂,其产物叫还原产物。
即:
还原剂+ 氧化剂→ 氧化产物+ 还原产物
一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。

化学物质还原反应一、课程目标知识目标:1. 理解还原反应的基本概念,掌握还原剂和氧化剂在化学反应中的作用;2. 掌握常见化学物质的还原反应类型,如金属离子、非金属离子和有机物的还原反应;3. 了解还原反应在实际生活和工业中的应用。
技能目标:1. 能够正确书写还原反应的化学方程式,并进行平衡;2. 能够运用还原剂和氧化剂进行化学反应的实验操作,观察并记录实验现象;3. 能够分析还原反应中电子转移的过程,解释实验结果。
情感态度价值观目标:1. 培养学生对化学学科的兴趣,激发学习热情;2. 培养学生的观察力、思考力和实验操作能力,形成严谨的科学态度;3. 引导学生关注化学与生活、环境的联系,培养环保意识和社会责任感。
课程性质:本课程为化学学科的一章节,重点探讨还原反应的类型、原理和应用。
通过本章节的学习,使学生能够掌握还原反应的基本知识,提高实验操作能力。
学生特点:考虑到学生所在年级,他们对化学基础知识和实验操作已有一定了解,但可能对还原反应的理解和应用尚不深入。
教学要求:结合学生特点和课程性质,将课程目标分解为具体的学习成果,注重理论与实践相结合,提高学生的实际操作能力。
在教学过程中,注重启发式教学,引导学生主动思考、探索,培养其解决问题的能力。
同时,关注学生的情感态度价值观培养,使他们在掌握知识的同时,形成良好的科学素养。
二、教学内容1. 还原反应基本概念:讲解还原反应的定义、特点,介绍还原剂和氧化剂的概念及作用。
教材章节:第一章 第三节2. 还原反应类型及实例:- 金属离子的还原反应:如铁离子、铜离子等;- 非金属离子的还原反应:如硫离子、氮离子等;- 有机物的还原反应:如醇、醛、酮的还原。
教材章节:第一章 第四节3. 还原反应在生活和工业中的应用:介绍还原反应在冶炼、化学合成、环境保护等方面的应用。
教材章节:第一章 第五节4. 实验教学:组织学生进行以下实验操作:- 铜离子还原实验:使用锌粉作为还原剂,观察铜离子还原为铜单质的现象;- 硫离子还原实验:使用铁粉作为还原剂,观察硫离子还原为硫单质的现象;- 醛的还原反应实验:使用钠硼氢化钠作为还原剂,观察醛还原为醇的反应过程。
还原反应的定义是什么还原反应的定义是什么在中国各版本的初中教科书中的还原反应主要指金属氧化物与还原剂(氢气,一氧化碳,碳单质)反应产生金属单质和另外一种物质的反应。
下面是店铺给大家整理的还原反应的简介,希望能帮到大家!还原反应的定义还原反应就是物质(分子、原子或离子)得到电子或电子对偏近的反应。
一个完整的化学反应中,还原反应与氧化反应一般是同时存在的,不可能仅有一项。
氧化还原介绍氧化还原反应氧化还原反应是在反应前后,某种元素的氧化数有变化的化学反应。
这种反应可以理解成由两个半反应构成,即氧化反应和还原反应。
本质上是发生了电子转移(或偏移),但不局限于不同种元素之间。
大多数无机复分解反应都不是氧化还原反应,因为这些复分解反应中的离子互相交换,不存在电子的转移,各元素的氧化数没有变化置换反应都是氧化还原反应。
有单质参加的化合反应一定是氧化还原反应。
有单质生成的分解反应一定是氧化还原反应。
另外要注意,有单质参加反应的化学反应不一定是氧化还原反应,如氧气生成臭氧(仅中学阶段可以如此认为,实际上由于电子偏移仍然算是氧化还原反应)。
概念反应的本质是氧化数有变化,即电子有转移。
氧化数升高,即失电子的半反应是氧化反应;氧化数降低,得电子的反应是还原反应。
氧化数升高的物质还原对方,自身被氧化,因此叫还原剂,其产物叫氧化产物;氧化数降低的物质氧化对方,自身被还原,因此叫氧化剂,其产物叫还原产物。
即:还原剂+ 氧化剂---> 氧化产物 + 还原产物一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”。
例子氢气与氯气的化合反应氢气与氯气的化合反应,其总反应式如下:H2 + Cl2 → 2HCl我们可以把它写成两个半反应的形式:氧化反应:H2 → 2H+ + 2e-还原反应:Cl2 + 2e- → 2Cl-单质总为0价。
第1个半反应中,氢元素从0价被氧化到+1价;同时,在第2个半反应中,氯元素从0价被还原到−1价. (本段中,“价”指氧化数)两个半反应加合,电子数削掉:H2 → 2H+ + 2e-+ 2e- + Cl2 → 2Cl----------------------H2 + Cl2 → 2H+ + 2Cl-最后,离子结合,形成氯化氢:2H+ + 2Cl- → 2HCl有机反应还原反应(Reduction Reaction)还原反应的概念——化学反应中,使有机物分子中碳原子总的氧化态降低的还原反应还原反应反应称为还原反应。
有机物还原反应1. 介绍有机物还原反应是一种重要的有机化学反应,在有机合成和生物化学领域得到广泛应用。
还原反应指的是有机物中的一个或多个化合物的氧化态发生还原,也就是减少了氧化态的数值。
这种反应可以通过引入还原剂来实现,通常是通过转移氢原子、电子或还原等效物来完成。
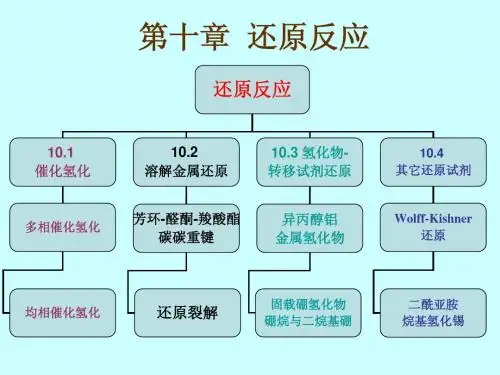
2. 还原剂的种类还原反应中使用的还原剂有很多种,下面列举了一些常用的还原剂和其特点:2.1 金属还原剂金属还原剂是一种常见的还原剂,如锂铝烷等。
它们可以转移电子给有机物分子,使其发生还原反应。
2.2 氢化物还原剂氢化物还原剂是一种常用的还原剂,如氢气、硼氢化钠等。
它们可以提供氢原子给有机物分子,使其发生还原反应。
氢气是最常用的氢化物还原剂,它可以通过催化剂催化下的氢化反应得到。
2.3 还原等效物还原等效物是一种特殊的还原剂,它们可以提供一些特殊的还原机制,如还原活泼卤以及其他不同的还原反应。
3. 还原反应的机理还原反应的机理取决于所使用的还原剂和反应体系的特性。
下面是一些常见的还原反应机理:3.1 氢原子转移机理在氢气还原反应中,氢原子被转移给有机物分子,使其氧化态发生还原。
这种转移是通过氢气分子中的一个氢原子与有机物中的一个原子结合而实现的。
由于氢原子的活性较高,这种转移往往是非常快速的。
3.2 电子转移机理在金属还原剂还原反应中,金属原子会失去电子,从而将电子转移给有机物分子。
这种转移是通过金属原子与有机物中的一个原子结合而实现的。
金属原子的电子丰富性使其成为一种有效的还原剂。
3.3 氢氧化钠还原机理氢氧化钠是一种常用的还原剂,它可以通过提供氢离子和氧气离子来实现还原反应。
氢离子会与有机物分子中的氧离子结合,形成水分子。
这种反应的发生需要适当的反应条件和催化剂的存在。
3.4 还原活泼卤机理还原活泼卤是一种特殊的还原反应,它发生在有机物分子中活泼卤原子的位置。
这种反应通常需要高温或者光照等外界条件的刺激,以促进活泼卤原子的离去和有机物分子的还原。