初中化学还原反应.pptx
- 格式:pptx
- 大小:73.59 KB
- 文档页数:3


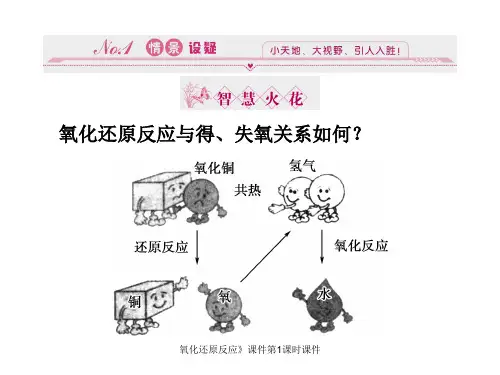
初中化学还原反应Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】还原反应一、C 还原氧化铜1、实验装置2、操作:(1)将炭和氧化铜混合均匀,放入大试管中高温加热(2)将生成的气体通入澄清石灰水(3)看到明显的现象后,先将导管移出石灰水,在停止加热(防止倒吸使试管炸裂)3、现象及化学方程式黑色固体逐渐变为红色大试管 C+2CuO====2Cu+CO2澄清石灰水变浑浊小试管CO 2+Ca(OH)2====CaCO 3+H 2O思考:1CO 2外,还可能有CO ,生成该气体的化学方程式: C+CO 22相关化学反应:2Fe 2O 32 2FeO+C====2Fe+CO 2 CO 2+C====2CO 二、H 2还原氧化铜实验装置:1、操作顺序:氢——灯——灯——氢(先通氢气的目的:排尽试管中的空气,防止加热时爆炸)2、现象:黑色粉末逐渐变为红色,试管内壁出现水雾3、实验结论:氢气和氧化铜加热条件下反应生成铜和水H 2+CuO====H 2O+Cu三、CO 还原氧化铜实验装置:1、操作步骤:先通CO 再加热(排尽试管内空气,防止加热时爆炸)。
看到明显现象后,先停止加热,再停止通入COA 、黑色固体逐渐变为红色:CO+CuO====CO 2+Cu2、现象及化学方程式B 、澄清石灰水变浑浊:CO 2+Ca(OH)2+H 2OC 、气体燃烧,产生蓝色火焰:2CO+O 2====2CO 2 3、结论:CO+CuO====CO 2+Cu还原性4、通过该实验可得到CO 的性质可燃性5、装置C 的作用:进行尾气处理(防止气体污染空气)。