物理化学原理在有机化学教与学中的应用(三)
- 格式:doc
- 大小:18.00 KB
- 文档页数:4


物理化学基本原理在环境工程专业的应用摘要:我国环境污染越来越严重,许多环境问题急需解决,而物理化学提供了许多基本原理,我们可以运用这些原理来解决环境问题,本文中介绍了几种处理环境问题的物理化学的基本原理以及介绍了物理化学对环境保护做出的贡献。
关键字:物理化学环境工程化学固化土壤淋洗动电修复贡献物理化学是在物理和化学两大学科基础上发展起来的。
它以丰富的化学现象和体系为对象,大量采纳物理学的理论成就与实验技术,探索、归纳和研究化学的基本规律和理论,构成化学科学的理论基础。
物理化学的水平在相当大程度上反映了化学发展的深度。
物理化学的研究内容大致可以概括为三个方面:化学体系的宏观平衡性质,以热力学的三个基本定律为理论基础,研究宏观化学体系在气态、液态、固态、溶解态以及高分散状态的平衡物理化学性质及其规律性。
在这一情况下,时间不是一个变量。
属于这方面的物理化学分支学科有化学热力学。
溶液、胶体和表面化学。
化学体系的微观结构和性质以量子理论为理论基础,研究原子和分子的结构,物体的体相中原子和分子的空间结构、表面相的结构,以及结构与物性的规律性。
属于这方面的物理化学分支学科有结构化学和量子化学。
化学体系的动态性质研究由于化学或物理因素的扰动而引起体系中发生的化学变化过程的速率和变化机理。
在这一情况下,时间是重要的变量。
属于这方面的物理化学分支学科有化学动力学、催化、光化学和电化。
随着学科的交叉,渗透与融合的不断深入,物理化学也显得越来越重要了,它不仅在化学,还在生命、材料、能源、环境等领域中也发挥着重要作用。
在此,我们介绍一些物理化学基本原理在环境方面的应用。
一,环境工程中的物理化学技术1,化学固化在重金属污染土壤修复技术中运用化学固化,固化的方法就是加入土壤添加剂改变土壤的理化性质,通过重金属的吸附或沉淀作用来降低其生物的有效性。
污染土壤中的毒害重金属被固定后,不仅可减少想土壤深层和地下水迁移,而且可能重建植被。

物理实验技术在有机化学研究中的应用引言有机化学是研究有机化合物的合成、结构、性质和反应等方面的学科。
在这个领域中,物理实验技术发挥着重要的作用。
本文将探讨物理实验技术在有机化学研究中的应用,并介绍其中的一些典型例子。
一、光谱技术光谱技术是物理实验技术中应用最广泛的一种。
在有机化学中,光谱技术可以用于分析和鉴定有机化合物的结构,帮助研究者了解有机分子的组成和空间结构。
例如,红外光谱可以用于确定有机化合物中含有的官能团,紫外可见光谱可以用于研究有机分子的电子结构,核磁共振(NMR)谱可以提供有机分子的结构信息。
二、热分析技术热分析技术包括差示扫描量热法(DSC)、热重分析法(TGA)等。
这些方法可以用来研究有机化合物的热力学性质,如热稳定性、熔点、燃烧性等。
通过热分析技术,可以对有机分子的热反应进行研究,揭示反应机理和反应动力学。
三、电化学技术电化学技术是有机化学中探索电子转移过程的重要工具。
例如,电化学合成可以通过电流作用下的还原和氧化反应来合成有机分子,电化学发光可以用来研究有机材料的光致发光性质。
电化学技术可以提供有机分子的电子行为信息,为有机化学研究提供重要参考。
四、质谱技术质谱技术可以确定有机化合物的分子式、分子量和结构等信息。
通过质谱技术,可以对有机分子的碎片进行分析,推断有机分子的结构,并通过检测离子峰的相对强度来提供定量分析。
质谱技术在有机化学研究中非常常用,为化学家们提供了快速准确的结构信息。
五、成像技术物理实验技术的另一个重要应用领域是成像技术。
有机化学研究中的成像技术可以用来观察和研究有机分子的微观结构及其在材料中的排列方式。
例如,透射电子显微镜(TEM)和扫描电子显微镜(SEM)可以对有机分子进行表面形貌和纳米尺度结构的观察;原子力显微镜(AFM)可以研究有机分子的三维形貌和表面性质。
结语以上介绍了物理实验技术在有机化学研究中的应用。
这些技术为化学家们提供了深入研究有机化合物的手段,使得我们能够更好地理解有机物的性质和反应机理。
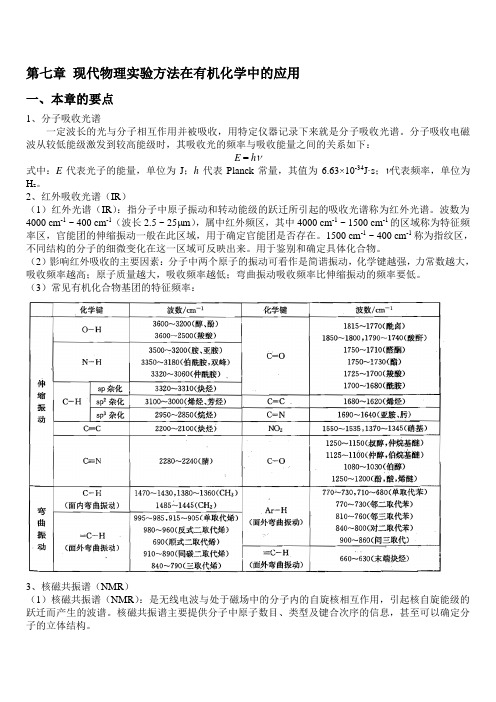
第七章现代物理实验方法在有机化学中的应用一、本章的要点1、分子吸收光谱一定波长的光与分子相互作用并被吸收,用特定仪器记录下来就是分子吸收光谱。
分子吸收电磁波从较低能级激发到较高能级时,其吸收光的频率与吸收能量之间的关系如下:E = hν式中:E代表光子的能量,单位为J;h代表Planck常量,其值为6.63×10-34J·s;ν代表频率,单位为H z。
2、红外吸收光谱(IR)(1)红外光谱(IR):指分子中原子振动和转动能级的跃迁所引起的吸收光谱称为红外光谱。
波数为4000 cm-1 ~ 400 cm-1(波长2.5 ~ 25μm),属中红外频区,其中4000 cm-1 ~ 1500 cm-1的区域称为特征频率区,官能团的伸缩振动一般在此区域,用于确定官能团是否存在。
1500 cm-1 ~ 400 cm-1称为指纹区,不同结构的分子的细微变化在这一区域可反映出来。
用于鉴别和确定具体化合物。
(2)影响红外吸收的主要因素:分子中两个原子的振动可看作是简谐振动,化学键越强,力常数越大,吸收频率越高;原子质量越大,吸收频率越低;弯曲振动吸收频率比伸缩振动的频率要低。
(3)常见有机化合物基团的特征频率:3、核磁共振谱(NMR)(1)核磁共振谱(NMR):是无线电波与处于磁场中的分子内的自旋核相互作用,引起核自旋能级的跃迁而产生的波谱。
核磁共振谱主要提供分子中原子数目、类型及键合次序的信息,甚至可以确定分子的立体结构。
(2)屏蔽效应和化学位移:分子中氢核周围存在价电子,在外加磁场作用下产生诱导电子流,从而产生与外加磁场相反的诱导磁场,使氢核受到外加磁场影响的强度减小,这种效应叫屏蔽效应。
由于分子中氢核周围电子云密度不同,产生的诱导磁场不同,这样使不同环境的氢核共振位置不同,这个表示不同位置的量叫化学位移。
化学位移用相对量表示,以TMS (四甲基硅烷)为参照物,用字母δ表示,δ越大,屏蔽效应越小,出现在低场。

物理化学原理在有机化学教与学中的应用(三)——燃烧焓与有机分子稳定性的关系侯文华;陈静【摘要】介绍燃烧焓在分析和讨论烷烃、环烷烃和烯烃分子稳定性中的应用.【期刊名称】《化学教与学》【年(卷),期】2010(000)001【总页数】3页(P6-8)【关键词】燃烧焓;烷烃;环烷烃;烯烃;异构体;稳定性【作者】侯文华;陈静【作者单位】南京大学化学化工学院,江苏,南京,210093;南京工业大学理学院应化系,江苏,南京,210009【正文语种】中文【中图分类】O642.1有机化学教与学中常常涉及化合物的稳定性判断,分析和讨论有机分子的稳定性是有机化学的重要内容之一,因为化合物的反应性与其稳定性是密切相关的。
可燃物质B的标准摩尔燃烧焓是指在标准压力下,反应温度时,单位量的物质B完全燃烧为同温下的指定产物时的标准摩尔焓变,用符号表示为ΔcHθm(B,相态,T),下标“c”和“m”分别表示燃烧和反应进度为1mol。
燃烧产物指定为:该化合物中 C变为 CO2(g),H变为H2O(l),S 变为 SO2(g),N 变为 N2(g),Cl成为 HCl(水溶液),金属成为游离状态。
燃烧焓可以很精确地测量,它是重要的热化学数据。
本文以烷烃、环烷烃和烯烃的稳定性为例,介绍燃烧焓在有机化学中的应用。
烷烃和所有其他碳氢化合物一样,都是可燃的。
烷烃完全燃烧,生成 CO2(g)和 H2O(l),并放出大量的热:燃烧焓的测定数据表明:直链烷烃分子每增加一个CH2,其燃烧焓数值的增加基本上是一个定值,即约为-658.6 kJ·mol-1。
例如,甲烷、乙烷、丙烷和丁烷标准摩尔燃烧焓分别为-890.3 kJ·mol-1、-1 559.8 kJ·mol-1、-2 219.9 kJ·mol-1 和-2 878.2 kJ·mol-1。
利用烷烃异构体燃烧焓的大小可以推测烷烃异构体的相对热化学稳定性。

化学中的物理化学和有机化学化学是一门极其繁复的科学,其中就包括物理化学和有机化学两个分支。
本文就来探讨一下这两个分支的基本原理和应用。
一、物理化学物理化学是研究物质的宏观性质和微观结构与其化学反应规律之间的关系的学科。
其中包括热力学、化学热力学、化学动力学、电化学、量子化学等分支。
1. 热力学热力学是一门研究物质和能量相互关系的科学,也是物理化学中最基础的分支之一。
其中包括热力学定律、热力学函数等概念。
热力学的应用非常广泛,在环保、能源、材料等领域都能发挥很大的作用。
2. 化学热力学化学热力学是研究化学反应热力学行为的科学。
它主要涉及到反应焓、反应熵、反应自由能等概念。
化学热力学的应用非常广泛,尤其是在药物合成、材料研究等领域都有很大的用武之地。
3. 化学动力学化学动力学是研究化学反应速率及其影响因素的科学。
其研究对象主要是反应机理和反应速率。
化学动力学的应用非常广泛,包括药物合成、工业生产等。
4. 电化学电化学是研究化学反应和电能之间相互关系的学科。
其研究对象包括电解、电化学反应等。
电化学的应用非常广泛,包括电池、电容器、电解制氢等。
5. 量子化学量子化学是研究原子、分子等微观粒子的运动规律和能级变化的科学。
其研究对象主要是量子力学在化学中的应用,如化学键、反应动力学等。
二、有机化学有机化学是研究有机物质的结构、性质及其反应规律的学科。
有机化学的研究对象主要是碳元素的有机化合物。
有机化学是一门非常广泛的学科,其研究对象包括天然产物、生命体系中的分子以及各种药物、材料等。
1. 有机化合物的命名有机化合物的命名方法是有机化学中非常基础的一块知识,其通过对化合物分子结构的描述来确定其分子式和命名。
2. 有机反应有机反应是指有机化合物之间或有机化合物与其他化合物相互作用产物的过程。
有机反应可分为加成反应、消除反应、取代反应、重排反应等多种类型。
3. 手性化学手性化学是研究化学物质中存在的对映异构体结构与性质的学科。
探究物理化学里的科学方法在教学中的应用太原科技大学化学与生物工程学院武银桃摘要:本文结合物理化学教学的实践与研究提出,在基础理论的教学中,教师在传授给学生科学知识的同时,更为重要的是传授给学生科学方法。
应该从对科学方法意识淡漠转变为自觉应用科学方法于科研和教学中,进而启发学生举一反三的意识,提高学生的创新能力。
关键词:物理化学科学方法古人云,授人以鱼,不如授之以渔。
谈到大学教学,尤其是基础理论的教学,教师在传授给学生科学知识的同时,更为重要的是传授给学生科学方法。
当今科学发展非常快,知识的使用周期越来越短,大学生在大学阶段学习的知识,可能若干年后就没用了[1]。
所以,大学阶段教给大学生什么?怎样教?是非常关键的。
任何基础理论课程的教学内容均由普遍性原理和科学方法组成[2]。
教学中,教师往往只重视知识(普遍性原理)的传授,不重视方法的教育,使学生在学习中举一反三的能力不强,工作中的创新能力不足。
本文结合物理化学理论和实验教学的实践与研究,提出了一点想法,供商榷。
在教学过程中,传授(掌握)知识和传授(掌握)方法同样重要,而传授(掌握)正确的科学方法尤为重要。
1.科学方法在物理化学教学中的重要性所谓科学方法是指人们在认识和改造世界中遵循或运用的、符合科学一般原则的各种途径和手法,包括在理论研究、应用研究、开发推广等科学活动过程中采用的思路、程序、规则、技巧和模式。
1.1科学方法的重要性科学方法的价值往往被低估,许多科学家对自己的科研成果的价值津津乐道,甚是清楚,而对自己的科学方法的价值往往搞不清楚。
科学发展史上的实例也屡见不鲜。
以众所周知的元素周期表为例。
由于发现了化学元素周期律的俄国化学家门捷列夫和德国化学家迈尔于1882年同时获得了英国皇家学会颁发的戴维勋章。
但为什么叫做门捷列夫元素周期表呢?1868年迈尔根据原子体积的变化是各元素原子量的函数的原理,绘制了一张曲线图,直观地表示出个元素原子体积的变化的周期性,1869年又制作了一个化学元素周期表,明确指出元素的性质是它的原子量的函数,迈尔的化学元素周期表偏重于原子量和物理性质之间的关系。
物理化学在化工中的应用废弃物处理废弃物的处理方法一般分为4种1场分离过程法输入能量强化各中梯度场,是被分离物之间产生移动速度差,从而使物质的到分离的方法成为场分离法也称速度差分离法。
2平衡分离过程法输入能量使原混合物系形成新的界面的方法,即利用相间平衡关系进行分离的方法叫平衡分离法3平衡分离过程法输入能量使原混合系形成新的相界面的方法,即利用相间平衡关系进行分离的方法称为平衡分离法。
4反应分离过程法输入能量促进反应进行的方法称为反应分离法废水的处理方法依据胶体化学的观点,不管来源如何让都是可视为分散介质的分散体系。
因此在废水的处理过程中需要下面的几种方法组合一级处理:主要利用筛滤、沉淀的物理处理方法二级处理:除去废水中呈胶体和溶解状态的有机污染物主要采用各种生物的处理方法三级处理:主要采用混凝、过滤、离子交换、反渗透、超滤的方法处理难降解的有机物、磷、氮等营养性物质废气的处理方法1重力沉降法重力沉降法与上面所说的废水处理的沉淀池法类似,是利用重力作用使粉尘自然沉降的最简单的除去气体中颗粒物的方法。
2吸附法(不做讲解)在固体废物处理中的应用利用浮选法分离固体废物利用浮选使固体颗粒彼此分离。
是界面化学的一个重要应用。
这一方法对矿石等回收利用有重要意义,它可以用来大规模、经济的处理破碎了的矿石,以使有用的矿石与脉石或矿石中的杂质分离。
废旧物品清洗利用(以纤维织物为例)从洗涤机理分析,一种好的洗涤剂应是能吸附在织物/水和污垢/水界面上的。
通常表面活性剂也能吸附在水/气界面上,使表面自由能降低,有利于形成泡沫。
值得指出的是泡沫多不表示洗涤剂必然是一种好的洗涤剂,因此根据泡沫多少判断洗涤剂的好坏是人们的一种误解。
1、微生物腐蚀特点1)硫酸盐还原菌又称产硫化物细菌,是一类在自然界分布很广的厌氧性微生物,也是一个主要的环境污染生物指标,常见的有脱硫弧菌属( desulfovibrio)和脱硫肠状菌属等,往往引起点蚀等局部腐蚀,腐蚀产物多是黑色且带有恶臭味的硫化物。
物化原理在化学中的应用1. 分子间相互作用力的应用•静电相互作用力:在化学反应中,静电相互作用力起着重要的作用。
例如,在离子化合物的形成中,阴阳离子之间的静电吸引力促使它们结合成稳定的化合物。
此外,静电相互作用力也影响了分子之间的溶解性和物理性质。
•范德瓦尔斯力:范德瓦尔斯力是一种分子间的弱吸引力。
在化学反应和分子间相互作用中,范德瓦尔斯力起着重要的作用。
例如,在液体和气体中,范德瓦尔斯力促使分子团结在一起,同时也决定了物质的挥发性和流动性。
2. 动力学原理在化学反应中的应用•反应速率:动力学原理揭示了化学反应速率的规律。
根据反应物的浓度、温度、催化剂等因素对反应速率的影响进行研究,可以帮助我们控制和优化化学反应过程。
例如,在工业生产中,研究反应速率可以确定最佳反应条件,以提高产率和降低能源消耗。
•化学平衡:动力学原理也适用于化学平衡的研究。
通过分析反应前后各组分的浓度变化规律,可以确定平衡常数和平衡浓度,从而帮助我们理解和控制化学平衡的过程。
例如,酸碱中和反应的平衡常数可以用于计算酸碱溶液的pH值。
3. 热力学原理在化学反应中的应用•反应热和焓变:热力学原理研究了化学反应中能量的转化和热的释放。
利用热力学原理,我们可以计算化学反应的焓变和熵变,从而了解反应的热效应和热力学稳定性。
例如,在燃烧和燃料电池等能源转换过程中,热力学原理可以帮助我们优化能量利用效率。
•自由能变化:热力学原理还可以通过计算自由能变化来预测化学反应的可逆性和驱动力。
自由能变化为负意味着反应是可逆的和自发的,反之则为不可逆或需要外界驱动力。
例如,在电化学反应和生化反应中,自由能变化的研究对于理解反应机制和确定反应方向具有重要意义。
4. 量子力学原理在化学中的应用•分子结构预测:量子力学原理通过计算分子的电子结构和分子轨道来预测和研究分子的性质。
例如,通过量子化学计算,我们可以预测分子的几何结构、键长、键角以及电子云密度分布等信息,从而帮助我们理解和设计化学反应。
物理化学原理在有机化学教与学中的应用(三)
作者:侯文华陈静
来源:《化学教与学》2010年第01期
摘要:介绍燃烧焓在分析和讨论烷烃、环烷烃和烯烃分子稳定性中的应用。
关键词:燃烧焓;烷烃;环烷烃;烯烃;异构体;稳定性
文章编号:1008-0546(2010)01-0006-03中图分类号:O 642.1文献标识码:A
doi:10.3969/j.issn.1008-0546.2010.01.002
有机化学教与学中常常涉及化合物的稳定性判断,分析和讨论有机分子的稳定性是有机化学的重要内容之一,因为化合物的反应性与其稳定性是密切相关的。
可燃物质B的标准摩尔燃烧焓是指在标准压力下,反应温度时,单位量的物质B完全燃烧为同温下的指定产物时的标准摩尔焓变,用符号表示为ΔcHθm(B,相态,T),下标“c”和“m”分别表示燃烧和反应进度为1mol。
燃烧产物指定为:该化合物中C变为CO2(g),H变为H2O(l),S变为SO2(g),N变为N2(g),Cl成为
HCl(水溶液),金属成为游离状态。
燃烧焓可以很精确地测量,它是重要的热化学数据。
本文以烷烃、环烷烃和烯烃的稳定性为例,介绍燃烧焓在有机化学中的应用。
一、烷烃同分异构体的相对热化学稳定性
烷烃和所有其他碳氢化合物一样,都是可燃的。
烷烃完全燃烧,生成CO2(g)和H2O(l),并放出大量的热:
CnH2n+2+O2(g)→n CO2(g) + (n+1)H2O(l) ΔrHθm(T)=ΔcHθm(CnH2n+2,T)
燃烧焓的测定数据表明:直链烷烃分子每增加一个CH2,其燃烧焓数值的增加基本上是一个定值,即约为-658.6 kJ·mol-1。
例如,甲烷、乙烷、丙烷和丁烷标准摩尔燃烧焓分别为-890.3 kJ·mol-1、-1 559.8 kJ·mol-1、-2 219.9 kJ·mol-1和-2 878.2 kJ·mol-1。
利用烷烃异构体燃烧焓的大小可以推测烷烃异构体的相对热化学稳定性。
在烷烃的同分异构体中,支链烷烃的燃烧焓比直链烷烃大。
支链越多,燃烧焓越大。
实验数据表明:在烷烃异构体中,支链最多的燃烧焓最大,也最稳定。
烷烃异构体燃烧时生成的产物相同,均为CO2(g)和
H2O(l),反应消耗O2(g)的量和生成产物的量也相同。
燃烧焓的不同,实际上说明了反应物烷烃分
子能量的高低。
燃烧热大,说明分子具有的能量低,结构稳定。
因此,通过燃烧焓的大小,可以了解分子的稳定性。
表1给出了正辛烷及其同分异构体在298.15 K时的标准摩尔燃烧焓。
由表可知,2,2,3,3-四甲基丁烷的燃烧焓最大,为-5 455.4 kJ·mol-1,故最稳定;而正辛烷的燃烧焓最小,为-5 474.2 kJ·mol-1,故最不稳定。
从分子能量上讲,2,2,3,3-四甲基丁烷比正辛烷稳定18.8 kJ·mol-1。
根据表1中燃烧焓的数据,C8烷烃异构体的相对稳定性次序
为:(CH3)3CC(CH3)3>(CH3)3C(CH2)3CH3>(CH3)2CH(CH2)4CH3 >CH3(CH2)6CH3。
二、环烷烃稳定性的理解
由环烷烃的化学性质可知,环烷烃的稳定性与环的大小有关。
三元和四元的小环化合物不
稳定,易发生开环反应,而五元、六元和七元环烷烃即使在相当强烈的条件下也不开环。
环烷烃的稳定性次序为:三元环
在化学上讲某化合物不稳定,意思是说分子的能量较高,易起化学反应。
小环烷烃能量较高,故不稳定。
这可以从其燃烧焓数据得到证实。
前已交待,对于开链烷烃,无论其中含碳原子数目多少,每个CH2的燃烧焓都接近-658.6 kJ·mol-1。
环烷烃可以看作是由数量不等的CH2单元连接起来的化合物。
如果将环烷烃的燃烧焓除以环内碳原子的数目n,即ΔcHθm/n,就可得到各种环烷烃中每一个亚甲基的燃烧焓,从而可以进行分子稳定性的比较。
环烷烃在298.15 K时的标准摩尔燃烧焓见上表。
由表可知,环烷烃的燃烧焓随碳原子数目的增加而更负,但不如开链烷烃那样有规律,即不同环烷烃中每一个亚甲基的燃烧焓(即ΔcHθm/n)随着环的大小不同而有着明显的差异。
大多数环烷烃中每一个亚甲基的燃烧焓比开链烷烃中每一个亚甲基的燃烧焓(-658.6 kJ·mol-1)更负。
这表明环烷烃比开链烷烃具有更高的能量,这高出的能量叫张力能。
例如,环丙烷的燃烧焓为-2 091 kJ·mol-1,其中每一个亚甲基的燃烧焓为-697.1 kJ·mol-1, CH2的平均张力能为(697.1-658.6)kJ·mol-1= 38.5 kJ·mol-1,环丙烷分子的总张力能为
3×38.5 kJ·mol-1=115.5 kJ·mol-1。
不同的环烷烃分子其张力能不同(见上表)。
环烷烃分子中的张力愈大,能量愈高,分子就愈不稳定。
环丙烷中每个亚甲基的平均摩尔燃烧焓比环丁烷中每个亚甲基的平均摩尔燃烧焓来得更负,说明环越小时能量越高。
同时由表中
数据可知,环丙烷和环丁烷的张力能比其他的环烷烃都大很多,分别为115.5 kJ·mol-1和109.6 kJ·mol-1,故它们最不稳定,易发生开环反应。
环戊烷和环庚烷的张力能分别为27.0 kJ·mol-1和26.2 kJ·mol-1,不是很大,因此比较稳定。
环己烷及其C12以上的大环化合物的张力能很小或等
于零,因此是很稳定的化合物。
值得注意的是,环己烷中每个亚甲基的燃烧焓与开链烷烃中每个亚甲基的燃烧焓相等,均为 -658.6 kJ·mol-1,故环己烷分子中的张力能为零。
因此,环己烷是一个没有张力的环状分子。
但按照拜尔的张力学说,应该是环戊烷最稳定,而六元环以上的化合物应该是不稳定的,即张力学说不能解释环己烷比环戊烷稳定的事实。
根据张力学说,由于环烷烃中的碳为sp3杂化,理想C-C-C
键角应为109°28’,即此时环烷烃最为稳定。
在所有的环烷烃中,环戊烷中的C-C-C键角为108°,最为接近109°28’,故环戊烷最稳定。
而环丙烷中的C-C-C键角为60°,与109°28’偏离最多,故最不稳定。
后来发展起来的构象理论,解决了这方面的矛盾。
张力学说中有关小环中由于角张力的存在,导致小环容易发生开环的解释是正确的,也得到了普遍承认。
但由于其他环烷烃中碳原子均不在同一平面上,其对分子稳定性的推断就错误了。
事实也确实如此,环己烷分子中碳原子不是在同一平面上的(参见下图1)。
进一步的解释还可以从环烷烃的结构得到证实。
从近代价键理论的观点来看,两个原子轨道重叠越多则形成的键越稳定。
烷烃分子中的碳为sp3杂化,键角为109°28’;而在环丙烷分子中,键角为60°,故sp3杂化轨道很难头对头重叠,即重叠程度较少,形成的键也就不稳定,易开环。
根据量子化学计算,环丙烷分子中的C-C键是弯曲的,键角为105.5°,形状如香蕉,故又称香蕉键。
从图2可见,杂化轨道不仅重叠程度较少,且电子云分布在C-C键连线外侧,易受试剂进攻而起开环反应。
三、烯烃同分异构体的相对稳定性
含相同数目碳原子的烯烃异构体燃烧时生成相同的产物。
如上所述,也可以根据烯烃异构体的燃烧热来比较它们的相对稳定性。
表3给出了C4烯烃及其同分异构体在298.15 K时的标准摩尔燃烧焓。
根据表中数据可知,C4烯烃的稳定性次序为:异丁烯>反-2-丁烯>顺-2-丁烯>1-丁烯,即对于含相同数目碳原子的烯烃异构体,与烯键碳原子直接相联的烷基数目多的较稳定,而在顺、反异构体中,反式较顺式稳定。
当然,对于烯烃的稳定性还可以用超共轭效应来解释。
在2-丁烯中,有六个C-H键与C=C双键发生超共轭效应;而在1-丁烯中,仅有两个C-H键与C=C双键发生超共轭效应,故2-丁烯比1-丁烯稳定。
至于顺、反异构体的稳定性差异,其原因是两个较大体积的基团挤在一起,存在较大的张力,它们之间的范氏斥力使分子的能量升高。
基团愈大,其张力愈大。
在2-丁烯中,由于其所连甲基不是太大,故顺、反异构体的ΔcHθm差值仅为3 kJ·mol-1。
在1,2-二叔丁基乙烯中,由于与烯键碳原子所联的叔丁基体积较大,故顺、反异构体的ΔcHθm分别为-6 634 kJ·mol-1和-6 590 kJ·mol-1,即相差达44 kJ·mol-1。
参考文献
[1]傅献彩,沈文霞,姚天扬,侯文华.物理化学[M].第5版(上册). 北京:高等教育出版社,2006
[2]邢其毅,徐瑞秋,周政,裴伟伟.基础有机化学[M].第2版(上册). 北京:高等教育出版社,1994
[3]王积涛,张宝申,王永梅,胡青梅.有机化学[M].第2版. 北京:南开大学出版社,2008
[4]徐寿昌.有机化学[M].第2版.(上册).北京:高等教育出版社,1993
[5]胡宏纹.有机化学[M].第2版.(上册). 北京:高等教育出版社,1990。