化学工艺学 第九章-2电解食盐水溶液制烧碱
- 格式:doc
- 大小:99.00 KB
- 文档页数:7




第九章电化学反应过程和氯化过程9.2电解食盐水溶液制烧碱一、基本概念1.法拉第电解定律法拉第在1834年提出的电解定律可表示为:在电解中,96500C(即1法拉第)的电量产生1克当量物质的化学变化。
G= (M/nF)*It=K*QM:物质的相对原子量,n:物质的原子价(电极反应中的电子数)Q=It F=96500C=26.8Ah电化当量:为1Ah电量析出的物质克数。
K= M/nF例如:电解食盐水的反应整个阴极反应总反应:在阳极极上析出C12的电化当量为:在阴极生成的烧碱的电化当量:K=40/26.8=1.4925(g/Ah)2.分解电压、过电压和电压效率a分解电压:对于化学反应:此反应的逆反应需要的电压即为理论分解电压。
化学反应达到平衡时,理论分解电压为:还可以通过阴极、阳极半反应的能斯特方程计算。
Er =φ(阳极)-φ(阴极),φ表示半反应的平衡电位,E 表示实际电位,Er 表示理论分解电位。
如,298.15K ,阳极液中NaCl 265kg/m 3,阴极液中NaOH 100 kg/m 3时, φ(Cl )=1.332V φ(H )=-0.840VEr =φ(阳极)-φ(阴极)=1.332+0.840=2.172Vb 过电压实际反应的电极电位与理论分解电压的差称为该电极的过电压。
影响过电压的因素:电极材料、电极表面状态、电流密度、温度、电解时间、电解质的性质和浓度以及电解质中的杂质等。
气体电极过程,产生的过电压相当大,而析出金属则除Fe 、Co 和Ni 外,产生的过电压一般均很小。
电极表面粗糙,电解的电流密度降低以及电解液的温度升高,可以降低电解时的过电压。
其中,电极材料对过电压的影响最大。
如:石墨阳极上析出氯气、析出氧气的实际电位(1000A/cm 2, NaCl 265kg/m 3) E (Cl )=φ(Cl )+E o (Cl )=1.332+0.25=1.582V E (O )=φ(O )+ E o (O )=0.814+1.09=1.904Vc 槽电压和电压效率电解槽两极上所加的电压称为槽电压,即实际分解电压, E (实)=Er +Eo +△E (降) △E (降):电流通过电解液、电极、导线、接点等的电压降 电压效率(ηE )3. 电流效率、电流密度和电能效率电流效率I η:在实际生产过程中,由于有一部分电流耗于电极上产生的副反应和漏电现象,电流不能100%被利用,所以不能按前述的法拉第电解定律来精确计算所需的电量。
高二化学选修4 电解原理的应用---电解食盐水制烧碱、氯气、氢气【学习目标】通过运用电解的原理分析食盐水的电解,了解较复杂体系中所发生的反应以及电解的实用价值,掌握阴阳离子的放电顺序,正确判断电极产物。
【重点难点】教学重点:电解食盐水的原理教学难点:离子放电顺序和电极产物判断。
【教学过程】复习:电解池的构成、电解熔融氯化钠的原理。
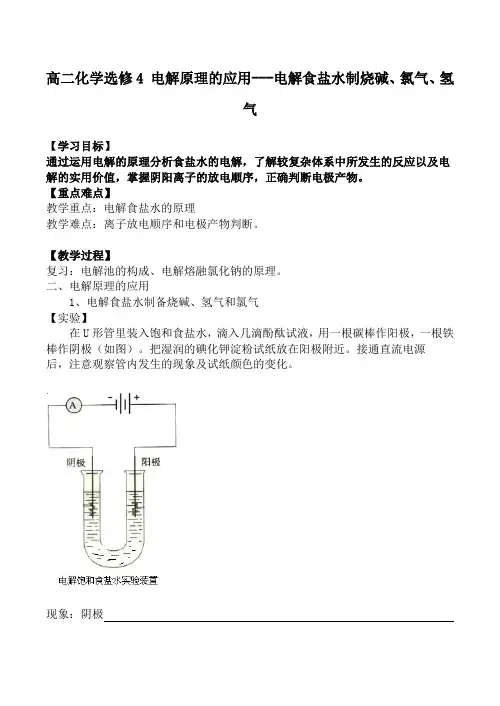
二、电解原理的应用1、电解食盐水制备烧碱、氢气和氯气【实验】在U形管里装入饱和食盐水,滴入几滴酚酞试液,用一根碳棒作阳极,一根铁棒作阴极(如图)。
把湿润的碘化钾淀粉试纸放在阳极附近。
接通直流电源后,注意观察管内发生的现象及试纸颜色的变化。
现象:阴极阳极电极产物:阴极阳极电解食盐水的总反应方程式为:电极反应:阳极阴极工业上利用这一反应原理,制取NaOH、Cl2和H2。
注意在上面的电解饱和食盐水的实验中,电解产物之间能够发生化学反应,如NaOH溶液和Cl2能反应生成NaClO,H2和Cl2混合遇火能发生爆炸。
在工业生产中,为避免这几种产物混合,需要使反应在特殊的电解槽中进行。
[分析讨论]①食盐水中存在的离子(注意水的电离):阳离子阴离子②结合实验分析这些离子的得失电子能力(放电能力)的大小。
③总结常见阳离子和阴离子的放电顺序阳离子放电顺序:(得电子能力)阴离子放电顺序:(失电子能力)(OH-放电时电极反应式为4OH--4e-=O2↑+2H2O)④电极产物的判断(1)阳极产物判断首先看,如果是电极(指金属活动顺序表Ag以前的金属电极),则电极材料失电子,电极被氧化,溶液中的阴离子不能失电子。
如果是电极(Pt、Au、石墨),则要再看溶液中的阴离子的失电子能力,此时根据阴离子放电顺序加以判断。
⑵阴极产物的判断直接根据顺序进行判断。
【小结】。
【反馈练习】1、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使C1被完全吸收制得有较强杀毒能力的消毒液,设计了如右图2所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )A、a为正极,b为负极;NaClO和NaClB、a为负极,b为正极;NaClO和NaClC、a为阳极,b为阴极;HClO和NaClD、a为阴极,b为阳极;HClO和NaCl↑,关于此2、若某池(电解池或原电池)的总反应离子反应式是Cu+2H+==Cu2++H2电池的有关说法正确的是()A、该池可能是原电池,也可能是电解池B、该池只能是原电池,且电解质溶液为硝酸C、该池只能是电解池,且金属铜为该电解池的阳极D、该池只能是电解池,电解质溶液只能是硝酸3、图中X、Y分别是直流电源的两极,通电后发现 a 极板质量增加,b 极板处有无色无臭的气体放出,符合这一情况的是 ( )4、甲、乙两个容器中,分别加入0.1mol/LNaCl 溶液与0.1mol/LAgNO 3溶液后,以Pt 为电极进行电解时,(1) 写出电极名称和电极反应式:ABCD(2)在A 、B 、C 、D 各电极上生成物的物质的量之比为:_____________5、如下图装置中,a 、b 都是惰性电极,通电一段时间后,a 极附近溶液呈红色。



电解食盐水制烧碱的化学方程式(一)电解食盐水制烧碱1. 引言在化学实验中,电解是一种常用的制取化合物的方法。
电解食盐水制烧碱是一种常见的实验,通过电解食盐水可以制取氢氧化钠(NaOH),即常见的烧碱。
本文将介绍电解食盐水制烧碱的相关方程式,并通过示例对其进行解释说明。
2. 电解食盐水制烧碱的方程式电解食盐水制烧碱的反应方程式如下:2 NaCl(aq) + 2 H2O(l) -> 2 NaOH(aq) + H2(g) + Cl2(g)3. 方程式解释说明以上方程式表示了电解食盐水制烧碱的整个过程。
下面对方程式的各个部分进行解释说明:•NaCl(aq):食盐水,即氯化钠在水中的溶液。
氯离子(Cl-)和钠离子(Na+)在溶液中游离。
•H2O(l):水,在电解过程中起到溶剂的作用。
•NaOH(aq):氢氧化钠溶液,即烧碱。
•H2(g):氢气,在电解过程中从阴极释放出来的气体。
•Cl2(g):氯气,在电解过程中从阳极释放出来的气体。
方程式中的系数表示了反应物和生成物的化学计量关系。
根据方程式可以得知,在电解食盐水的过程中,每2个氯化钠分子会生成2个氢氧化钠分子、1个氢气分子和1个氯气分子。
4. 解释示例假设有一槽中装有食盐水,并连接到电解池的阴极和阳极。
当通电后,根据上述方程式,反应会开始进行。
在阴极上,水分子(H2O)将被还原,释放出氢气(H2)。
在阳极上,氯化钠(NaCl)分解成氯气(Cl2)和钠离子(Na+)。
随着反应进行,氯离子(Cl-)会与水分子(H2O)反应生成氯气(Cl2)和氢氧化钠(NaOH)。
最终,在槽中会生成氢氧化钠溶液(烧碱)、氢气和氯气。
5. 总结电解食盐水制烧碱是一种常见的实验方法,通过电解食盐水可以制取氢氧化钠(烧碱)。
通过上述方程式和示例,我们可以更好地理解这一实验过程。
电解食盐水实验不仅有助于学习电化学原理,还能够锻炼实验技巧和实验操作能力。
以上是关于电解食盐水制烧碱的相关方程式和解释说明。

教学设计一、课标解读与教材分析内容标准:体验化学能与电能相互转化的探究过程,了解电解池的工作原理,能写出电极反应和电解池反应方程式。
本节教材是继学生在必修中学习了电解质水溶液可以导电之后,探究电解的原理。
本课时是在上一课时以单一物质的熔融体系为研究对象的基础上来进一步学习、探究较为复杂的水溶液体系中离子的放电顺序。
强化电解、电解池、阳极、阴极、电极反应等概念,能够分析出在电极上放电的微粒,熟练电极反应式的书写、电解池反应式的书写,进一步理解电解原理在工业生产中的重要应用——电解饱和食盐水。
二、学情分析学生在初中化学中学过电解水的反应,并做过电解水的实验;在高中《化学1》(必修)中学习了电解质,知道电解质在水溶液或熔融态可以导电;在《化学2》(必修)初步了解了原电池的原理,知道化学能可以转化为电能,而且课本中也简单提到“电能也可以转化为化学能,如化工生产中通过电解饱和食盐水来制备烧碱、氢气和氯气利用的就是电能向化学能的转化。
”但学生对电解饱和食盐水等电解知识仅处于只知其然而不知其所以然的状态。
三、教学目标1. 知识与技能(1)通过运用电解的原理分析食盐水的电解,了解较复杂体系中所发生的反应,能正确书写电极反应式和电解方程式。
(2)了解电解在工业生产中的实用价值。
2. 过程与方法(1)通过学生实验培养学生观察、分析、推理、归纳总结能力及动手能力。
(2)从微观角度认识化学反应的过程,体会科学的研究方法。
3. 情感态度与价值观通过对电解原理的研究,体验化学科学的奥秘,从能量的角度理解化学科学的重要性。
四、教学重难点重点:较复杂电解池中的电解原理难点:正确书写电极反应式和电解方程式五、教学过程六、板书设计第二节电能转化为化学能——电解电解原理的应用——电解食盐水制烧碱、氢气和氯气1. 电极反应式:阳极:2Cl--2e- = Cl2↑阴极:2H++2e- = H2↑电解方程式:通电2NaCl+2H2O 2NaOH+H2↑+Cl2↑2. 工业电解食盐水装置分析阳离子交换膜的作用七、课堂巩固练习1. 石墨做电极电解下列电解质溶液请写出电极反应式、总反应式,并判断电解一段时间后,电解质溶液的浓度如何变化?怎样恢复到原浓度?CuCl2、Na2SO4、CuSO42. 铜做电极电解硫酸铜溶液,请写出电极反应式。

工业上制取烧碱的化学方程式烧碱,我们也称之为氢氧化钠,是一种重要的化学物质,它广泛应用于化工、制纤、造纸、电子、制药等行业。
制取烧碱的方法有很多种,其中常用的有电解法、氨法、卤化物法等。
下面我们将介绍电解法制取烧碱的化学方程式。
电解法制取烧碱的化学方程式如下:
在电解槽中,向溶液中通入稀盐酸,使其电离成H+和Cl-,同时在阳极上通入直流电流,使Cl-被氧化成Cl2释放出来。
2Cl- → Cl2 + 2e-
在阴极上反应发生了还原反应,也就是水被还原成氢气和氢氧化物。
2H2O + 2e- → H2 + 2OH-
氢氧化物会和钠离子结合成氢氧化钠。
因为氢氧化钠是强碱,因此电解槽中的溶液就变成了烧碱溶液。
Na+ + OH- → NaOH
以上的反应方程式就是电解法制取烧碱的过程。
需要注意的是,在电解过程中,电解槽需要使用钛制成的负极和钢制成的阳极,因为氢氧化钠会腐蚀许多金属,而钛和钢可以抵御腐蚀。
电解法制取烧碱是目前应用最广泛的方法之一,主要因为此法产品成本较低,而且生产规模灵活,可以很好地满足市场需求。
此法虽然转化效率较低,但由于阳极与阴极设置的比例可以灵活调整,可以在一定程度上控制反应速率,从而实现更大规模的制碱生产。
总之,电解法制取烧碱的化学方程式为:
2Cl- → Cl2 + 2e-
2H2O + 2e- → H2 + 2OH-
Na+ + OH- → NaOH
烧碱的制取从根本上改变了许多行业的生产方式,有助于提高生产效率和降低成本,同时也推动了化工行业的快速发展。

烧碱生产工艺流程
烧碱是一种重要化工原料,在工业生产中有广泛的应用。
下面为大家介绍一下烧碱的生产工艺流程。
烧碱生产主要是通过氯碱法进行的,主要原料是盐水。
首先,将盐水进行预处理,去除杂质,提高盐水的纯度。
预处理主要包括盐水过滤、净化等步骤。
接下来,将预处理过的盐水注入电解槽中,电解槽是烧碱生产的核心设备。
电解槽内部设置有阳极和阴极,阳极和阴极之间隔开一定距离。
盐水在通入电解槽后,经过电解作用分解成氯气和氢气。
然后,将产生的氯气和氢气分离。
氯气通常是通过氯气收集罩收集起来,氢气则通过设备捕集,以免造成安全隐患。
在氯气得到收集以后,进行下一步的处理。
氯气可以用于生产各种氯化物化合物,也可以通过氯碱反应产生氢氧化钠。
氢气主要是通过回收再利用的方式来减少资源浪费和环境污染。
常用的回收方式是通过氢气制取氨、氢氧化钠等反应。
最后,将已经经过电解产生的氢氧化钠溶液经过浓缩、结晶等步骤,得到固体的烧碱。
整个烧碱生产工艺涉及到多个步骤和设备,还需要注意一些操
作规程和安全要求。
比如,在操作电解槽时,需要控制好各项参数,如电流密度、温度等,以保证反应的进行。
此外,在收集氯气和氢气时,也需要进行安全措施,避免泄露和引起火灾。
总结起来,烧碱生产工艺流程主要包括预处理、电解、氯气与氢气的分离、氢气的回收再利用以及烧碱的浓缩结晶等步骤。
通过这些步骤,可以生产出高质量的烧碱产品,满足不同领域对烧碱的需求。
电解饱和食盐水制备氢氧化钠化学方程式When preparing sodium hydroxide through the electrolysis of saturated salt solution, it is important to understand the chemical reaction involved in this process. The electrolysis of salt water produces sodium hydroxide, chlorine gas, and hydrogen gas. This reaction occurs at the electrodes where oxidation and reduction take place.当通过电解饱和食盐水制备氢氧化钠时,了解这一过程中涉及的化学反应非常重要。
盐水电解产生氢氧化钠、氯气和氢气。
这种反应发生在电极处,氧化和还原在这里发生。
During the electrolysis process, the sodium ions (Na+) and the hydroxide ions (OH-) are attracted to the cathode where reduction occurs. At the cathode, water molecules are reduced to form hydrogen gas and hydroxide ions. The hydroxide ions then combine with sodium ions to produce sodium hydroxide.在电解过程中,钠离子(Na+)和氢氧根离子(OH-)被吸引到阴极处,还原在这里发生。
在阴极处,水分子被还原形成氢气和氢氧根离子。
氢氧根离子然后与钠离子结合形成氢氧化钠。
Meanwhile, at the anode, chloride ions (Cl-) are oxidized to produce chlorine gas and release electrons. The released electrons then flow through the external circuit to the cathode, where they participate in the reduction reaction. The overall reaction can be represented by the equation 2NaCl + 2H2O → 2NaOH + Cl2 + H2.与此同时,在阳极处,氯离子(Cl-)被氧化产生氯气并释放电子。
nacl生产烧碱的方法NaCl是氯化钠的化学式,也是常见的食盐。
然而,NaCl还可以用于生产烧碱,下面将介绍一种常见的方法。
烧碱,化学式为NaOH,是一种强碱。
它在工业生产中广泛应用于制造肥皂、造纸、清洁剂等。
NaCl生产烧碱的方法主要是通过电解盐水来实现。
需要准备盐水溶液。
盐水是由NaCl和水按一定比例混合而成。
为了确保反应的高效进行,通常选择浓度较高的盐水。
在制备过程中,应注意控制溶液的浓度和温度,以提高反应的产率。
接下来,将准备好的盐水溶液注入电解槽。
电解槽是一个容器,内部有两个电极,分别是阳极和阴极。
通常采用钢制电极,因其耐腐蚀性能好。
阳极和阴极之间需要保持一定的距离,以充分发挥电解效果。
然后,通过外部电源施加电压。
正极连接阳极,负极连接阴极。
通电后,电解槽中的盐水会发生电解反应。
NaCl分解为Na+离子和Cl-离子。
Na+离子在阴极处被还原成Na金属,而Cl-离子在阳极处被氧化成Cl2气体。
Na+离子与OH-离子结合生成NaOH,这就是烧碱的生成过程。
NaOH会以溶液的形式存在于电解槽中。
为了保持反应的连续进行,需要定期补充盐水溶液,以补充被电解消耗的原料。
从电解槽中收集NaOH溶液。
收集到的NaOH溶液可以进行进一步的处理和提纯,以获得高纯度的烧碱产品。
需要注意的是,NaCl生产烧碱的电解过程是一个消耗能量的过程。
电解槽需要连续供电,以维持电解反应的进行。
同时,电解过程也会产生氯气,这是一种有害气体,需要进行处理和处理。
NaCl生产烧碱的方法是通过电解盐水来实现。
该方法具有成本低、生产效率高等优点,广泛应用于工业生产中。
通过控制反应条件和提纯过程,可以获得高纯度的烧碱产品,满足各种需求。
教学设计一、课标解读与教材分析内容标准:体验化学能与电能相互转化的探究过程,了解电解池的工作原理,能写出电极反应和电解池反应方程式。
本节教材是继学生在必修中学习了电解质水溶液可以导电之后,探究电解的原理。
本课时是在上一课时以单一物质的熔融体系为研究对象的基础上来进一步学习、探究较为复杂的水溶液体系中离子的放电顺序。
强化电解、电解池、阳极、阴极、电极反应等概念,能够分析出在电极上放电的微粒,熟练电极反应式的书写、电解池反应式的书写,进一步理解电解原理在工业生产中的重要应用——电解饱和食盐水。
二、学情分析学生在初中化学中学过电解水的反应,并做过电解水的实验;在高中《化学1》(必修)中学习了电解质,知道电解质在水溶液或熔融态可以导电;在《化学2》(必修)初步了解了原电池的原理,知道化学能可以转化为电能,而且课本中也简单提到“电能也可以转化为化学能,如化工生产中通过电解饱和食盐水来制备烧碱、氢气和氯气利用的就是电能向化学能的转化。
”但学生对电解饱和食盐水等电解知识仅处于只知其然而不知其所以然的状态。
三、教学目标1. 知识与技能(1)通过运用电解的原理分析食盐水的电解,了解较复杂体系中所发生的反应,能正确书写电极反应式和电解方程式。
(2)了解电解在工业生产中的实用价值。
2. 过程与方法(1)通过学生实验培养学生观察、分析、推理、归纳总结能力及动手能力。
(2)从微观角度认识化学反应的过程,体会科学的研究方法。
3. 情感态度与价值观通过对电解原理的研究,体验化学科学的奥秘,从能量的角度理解化学科学的重要性。
四、教学重难点重点:较复杂电解池中的电解原理难点:正确书写电极反应式和电解方程式五、教学过程六、板书设计第二节电能转化为化学能——电解电解原理的应用——电解食盐水制烧碱、氢气和氯气1. 电极反应式:阳极:2Cl--2e- = Cl2↑阴极:2H++2e- = H2↑电解方程式:通电2NaCl+2H2O 2NaOH+H2↑+Cl2↑2. 工业电解食盐水装置分析阳离子交换膜的作用七、课堂巩固练习1. 石墨做电极电解下列电解质溶液请写出电极反应式、总反应式,并判断电解一段时间后,电解质溶液的浓度如何变化?怎样恢复到原浓度?CuCl2、Na2SO4、CuSO42. 铜做电极电解硫酸铜溶液,请写出电极反应式。
第九章电化学反应过程和氯化过程
9.2电解食盐水溶液制烧碱
一、基本概念
1.法拉第电解定律
法拉第在1834年提出的电解定律可表示为:在电解中,96500C(即1法拉第)的电量产生1克当量物质的化学变化。
G= (M/nF)*It=K*Q
M:物质的相对原子量,n:物质的原子价(电极反应中的电子数)
Q=It F=96500C=26.8Ah
电化当量:为1Ah电量析出的物质克数。
K= M/nF
例如:电解食盐水的反应
整个阴极反应
总反应:
在阳极极上析出C12的电化当量为:
在阴极生成的烧碱的电化当量:
K=40/26.8=1.4925(g/Ah)
2.分解电压、过电压和电压效率
a分解电压:对于化学反应:
此反应的逆反应需要的电压即为理论分解电压。
化学反应达到平衡时,理论分解电压为:
还可以通过阴极、阳极半反应的能斯特方程计算。
Er =φ(阳极)-φ(阴极),φ表示半反应的平衡电位,E 表示实际电位,Er 表示理论分解电位。
如,298.15K ,阳极液中NaCl 265kg/m 3,阴极液中NaOH 100 kg/m 3时, φ(Cl )=1.332V φ(H )=-0.840V
Er =φ(阳极)-φ(阴极)=1.332+0.840=2.172V
b 过电压
实际反应的电极电位与理论分解电压的差称为该电极的过电压。
影响过电压的因素:电极材料、电极表面状态、电流密度、温度、电解时间、电解质的性质和浓度以及电解质中的杂质等。
气体电极过程,产生的过电压相当大,而析出金属则除Fe 、Co 和Ni 外,产生的过电压一般均很小。
电极表面粗糙,电解的电流密度降低以及电解液的温度升高,可以降低电解时的过电压。
其中,电极材料对过电压的影响最大。
如:石墨阳极上析出氯气、析出氧气的实际电位(1000A/cm 2, NaCl 265kg/m 3) E (Cl )=φ(Cl )+E o (Cl )=1.332+0.25=1.582V E (O )=φ(O )+ E o (O )=0.814+1.09=1.904V
c 槽电压和电压效率
电解槽两极上所加的电压称为槽电压,即实际分解电压, E (实)=Er +Eo +△E (降) △E (降):电流通过电解液、电极、导线、接点等的电压降 电压效率(ηE )
3. 电流效率、电流密度和电能效率
电流效率I η:在实际生产过程中,由于有一部分电流耗于电极上产生的副反应和漏电现象,电流不能100%被利用,所以不能按前述的法拉第电解定律来精确计算所需的电量。
工业上常用同一电量所得实际产量与理论计算所得量之比来表示电流利用效率ηI 。
电流密度。
电极面上单位面积通过的电流强度,单位为A/m2。
在实际生产中,为了控制分解电压,需采用合理的电流密度。
电能效率η:为电压效率与电流效率的乘积,
E I ηηη=
例计算生产1t烧碱的理论耗电量和实际电量。
已知,电解时理论分解电压为2.16V,槽电压3.5V,电流效率96%。
一、电解过程的副反应
1.阳极副反应
阳极生成的Cl2溶解在水中,生成次氯酸和盐酸
当阴极生成的碱,由于扩散或电迁移等原因进入阳极溶液中时,HClO被中和,生成易解离的次氯酸盐:
C1O-在阳极上氧化,生成C1O-3并放出O2
HClO的歧化反应
上述反应使阳极生成的氯,阴极生成的碱,都由于副反应而白白消耗掉,这不仅降低了电流效率,而且降低了产品的纯度。
阴极副反应
由于阳极处合有少量的次氯酸钠和氯酸钠,它们会迁移到阴极附近,并和由阴极上产生的新生态[H]发生如下反应:
生产中采用隔膜(或离子膜)将阴、阳极隔开,阻止Cl-或OH-迁移及采用较高操作温度降低Cl2在水中的溶解度,以减少氯气与烧碱的作用等,提高电能的利用和保证产品质量。
二、食盐水电解制氯气和烧碱工艺和生产方法
三种方法:①隔膜法;②汞阴极法;②高于交换膜法。
隔膜法生产的烧碱约占烧碱总量的50%左右,汞阴极法占39%,离子交换膜法占11%。
中国隔膜法占90%以上,汞阴极法占6%,离于交换膜法占4%左右。
隔膜法经过技术改造,仍可占重要地位;汞阴极法因存在汞的环境污染问题,所占份额将会明显下降;离子交换模法因具有能耗低,产品质量高,运输管理容易,安全性能好等优点,已成为当代氯碱生产发展方向。
1.隔膜法工艺过程
利用电解槽内隔膜将阳极产物(氯气)和阴极产物(氢气和烧碱)分开的电解生产工艺称为隔膜电解法。
电解原理:精盐水进入阳极室产生氯气,Na+及剩余的NaCl溶液以一定流速(至少要大于OH-向阳极的迁移速度)通过隔膜进入阴极室以保持阴极室的电中性。
由阴极室流出的是NaOH 和的NaCl的稀碱液。
阳极材料:
石墨
金属阳极(DSA):纯钛上镀上RuO2-TiO2。
与石墨阳极相比,金属阳极具有析氯过电压低,耐氯腐蚀,氯气纯度高,电流效率高,使用寿命长以及电解槽密封性能好等优点。
隔膜:
(1)石棉隔膜:由石棉纤维和碱溶液混合形成的浆液,借助真空吸附在铁阴极网袋上制成。
(2)改性隔膜:上述浆液中添加适量氟树脂(如四氟乙烯、聚多氟偏二氯乙烯、聚全氟乙烯—丙烯等)和少量非离子型表面活性剂改性。
工艺流程:
分为盐水精制、电解、氯气和氢气处理、液氯、碱浓蒸发以及固碱制造等工序。
(1)盐水精制:粗盐水中的SO42-、Ca2+、Mg2+等杂质在电解时生成难溶性的沉淀,与机械杂质一起堵塞隔膜的孔隙。
盐水精制包括化盐、精制、澄清、过滤、重饱和、预热、中和、盐泥洗涤等过程。
(2)氯气:由电解指引出的氯气冷却后,用浓硫酸脱水干燥,然后压送往液氯工序或其他氯产品生产工序。
(3)碱蒸发:由电解槽流出的稀碱液,含有大量NaCl,在稀碱液蒸发浓缩工序中,NaCl 呈结晶析出,经分离后制成盐泥浆供盐水重饱和使用。
稀碱液经浓缩可得得含NaoH30%和50%的浓碱商品。
(4)杂质去除:由电解槽流出的稀碱中含有NaClO3,它不仅影响产品质量,而且会腐蚀蒸发设备。
脱除的方法是在稀碱液中加入联氨:
2. 水银法
又称汞阴极法,由电解和解汞两部分组成。
由于电解和解汞分开,电解室中不产生氢和氢氧化钠,消除了C12和NaOH相互作用的机会、也避免了H2和Cl2的混合。
此外解汞可以直接得到纯度高的浓度为45%一50%的液体烧碱。
水银法电解室中的主要反应;
在阳极上的反应与隔膜法相同、是Cl-放电并析出Cl2。
在汞阴极上的反应是Na+的放电:
若盐水溶有C12时,生成HCl和HClO,发生以下副反应;
解汞时的主反应和副反应:
进入解汞室的钠汞齐若带有Hg2Cl2灰色固体,在解汞室中会发生以下副反应:
3.离子膜电解法:
离子交换膜(简称EEM或IM)是对于溶液中离子有选择性透过特性的高分子材料膜。
氯碱电解槽选用的是阳离子交换膜。
它能使Na+通过,而排斥Cl-离子。
因此该法可以使阴极室得到不含NaCl、纯度甚至超过水银法的烧碱溶液。
与隔膜法和水银法对比,离子交换膜法的优点为:
能耗低;投资少;电解液质量好,碱液、氢、氯的质量接近或等于水银法而不含汞,优于隔膜法,电解所得碱液含盐小0.005%,只有隔膜法的1/200。
碱液浓度可控制在含NaOH大于20%,甚至可达40%;没有汞污染等公害。
(1)电解原理
(2)离子交换膜
四氟乙烯同具有离子交换朗的全氟乙烯基醚单体的共聚物。
制成膜后,再用配四氟乙烯织物增强。
离子交换基因有:磺酸基团、羧酸基因、季酸基团、磺酰胺基因(S02NHR)和磷酸基团。
精制盐水:含有较多的多价阳离子(如Ca2+、Mg2+、Al3+、Fe3+等),由于它们很容易占有多个磺酸基因,增加了精制盐水中的Na+进行离子交换以及渗过微孔的难度。
因此,在工业上常将食盐水作二次精制处理,以将多价阳离于除至允许含量以内。
4.电解方法的比较。