实验6_水、饱和氯化钠溶液的电解
- 格式:doc
- 大小:73.00 KB
- 文档页数:5

教案:水的电解教学目标:1. 了解水的电解过程及其产物。
2. 掌握电解水的实验方法和注意事项。
3. 理解水的组成和分子结构。
4. 培养学生的实验操作能力和观察能力。
教学重点:1. 水的电解过程及其产物。
2. 电解水的实验方法和注意事项。
教学难点:1. 水的电解产物的判断。
2. 电解水的实验操作。
教学准备:1. 实验室用具:电解器、电源、试管、玻璃棒、氢氧化钠溶液。
2. 实验试剂:氢氧化钠溶液、硫酸铜溶液、食盐水。
3. 教学课件。
教学过程:一、导入(5分钟)1. 引导学生思考:水是由什么组成的?水分子是由哪些原子构成的?2. 学生回答后,教师总结:水是由氢元素和氧元素组成的,水分子是由两个氢原子和一个氧原子构成的。
二、探究水的电解(15分钟)1. 介绍电解水的实验设备和试剂。
2. 演示电解水的实验过程,并解释实验现象。
3. 学生分组进行实验,观察并记录实验现象。
三、分析实验结果(15分钟)1. 学生汇报实验结果,教师引导学生分析实验现象。
2. 学生通过实验现象,得出水的电解产物是氢气和氧气。
3. 教师解释水的电解原理,即水分子在电解过程中分解成氢离子和氧离子,氢离子在阴极还原成氢气,氧离子在阳极氧化成氧气。
四、总结与反思(10分钟)1. 学生总结水的电解过程及其产物。
2. 学生反思实验操作中的注意事项,如安全使用电源、正确连接电解器等。
五、拓展与应用(10分钟)1. 学生讨论:电解水产生的氢气和氧气在实际应用中的作用。
2. 学生思考:如何利用电解水的方法制取氢气?教学反思:本节课通过实验探究,使学生了解了水的电解过程及其产物,掌握了电解水的实验方法和注意事项。
在实验过程中,学生积极参与,动手操作,培养了实验操作能力和观察能力。
同时,通过分析实验结果,学生深入理解了水的组成和分子结构。
但在教学过程中,要注意引导学生正确使用实验设备,确保实验安全。

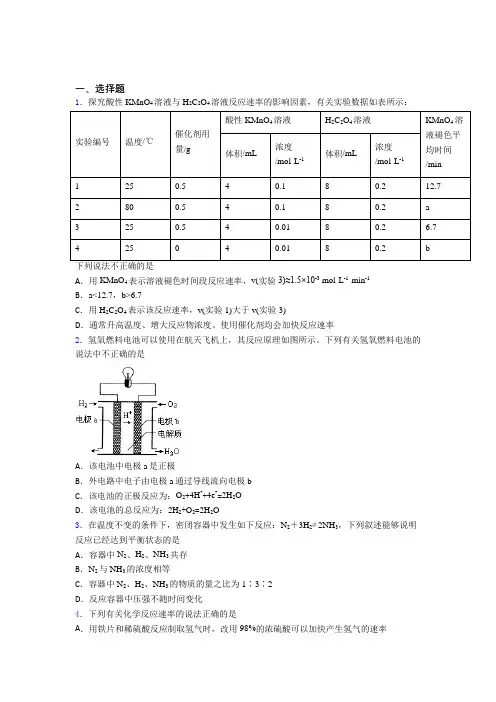
一、选择题1.探究酸性KMnO4溶液与H2C2O4溶液反应速率的影响因素,有关实验数据如表所示:实验编号温度/℃催化剂用量/g酸性KMnO4溶液H2C2O4溶液KMnO4溶液褪色平均时间/min 体积/mL浓度/mol·L-1体积/mL浓度/mol·L-11250.540.180.212.7 2800.540.180.2a 3250.540.0180.2 6.7 425040.0180.2b下列说法不正确的是A.用KMnO4表示溶液褪色时间段反应速率,v(实验3)≈1.5×10-3 mol·L-1·min-1B.a<12.7,b>6.7C.用H2C2O4表示该反应速率,v(实验1)大于v(实验3)D.通常升高温度、增大反应物浓度、使用催化剂均会加快反应速率2.氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。
下列有关氢氧燃料电池的说法中不正确的是A.该电池中电极a是正极B.外电路中电子由电极a通过导线流向电极bC.该电池的正极反应为:O2+4H++4e-=2H2OD.该电池的总反应为:2H2+O2=2H2O3.在温度不变的条件下,密闭容器中发生如下反应:N2+3H2⇌2NH3,下列叙述能够说明反应已经达到平衡状态的是A.容器中N2、H2、NH3共存B.N2与NH3的浓度相等C.容器中N2、H2、NH3的物质的量之比为1∶3∶2D.反应容器中压强不随时间变化4.下列有关化学反应速率的说法正确的是A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变C.NH3的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应速率不变5.如图所示,铜片、锌片和石墨棒用导线连接后插入西红柿里,电流计中有电流通过,下列说法中正确的是A.锌片是正极B.两个西红柿都形成原电池C.石墨是阴极D.两片铜片上都发生还原反应6.反应2NO2(g)O2(g)+2NO(g),一定条件下,将NO2置于恒容密闭容器中发生上述反应。

一、选择题1.下列说法正确的是A.镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的反应速率不变B.在密闭容器中发生反应A(g)+B(g)C(g)+D(g),保持恒温恒容,充入气体He增大压强,化学反应速率加快C.恒温恒容条件下,发生反应NH2COONH4(s)2NH3(g)+CO2(g),达到平衡的标志可以是混合气体的平均摩尔质量不再发生变化D.任何可逆反应在给定条件下的进程都有一定的限度,化学反应的限度决定了生成物在该条件下的最大产率2.氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。
下列有关氢氧燃料电池的说法中不正确的是A.该电池中电极a是正极B.外电路中电子由电极a通过导线流向电极bC.该电池的正极反应为:O2+4H++4e-=2H2OD.该电池的总反应为:2H2+O2=2H2O3.在2A+B3C+4D反应中,表示该反应速率最快的是A.v(A)=0.5mol/(L·s)B.v(B)=0.3mol/(L·s)C.v(C)=0.8mol/(L·s)D.v(D)=1mol/(L·s)4.将5.6 g铁粉投入盛有100mL 2mol/L稀硫酸的烧杯中,经2min反应完全。
如果反应前后浓液的体积不变,则该反应的平均反应速率可表示为A.v(Fe)=0.5mol/(L·min)B.v(H2SO4)=1mol/(L·min)C.v(FeSO4)=0.5mol/(L·min)D.v(H2)=0.5mol/(L·min)5.某同学用下图所示装置探究原电池的工作原理,并推出下列结论,正确的是A.Cu质量减少B.Zn用作负极C.电子由Cu并经导线流向Zn D.该装置将电能转换为化学能6.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。
下列叙述中不正确的是A.通过图甲实验产生气泡的快慢能比较Fe3+和Cu2+对H2O2分解的催化效果B.用图乙装置判断反应速率的大小,可测定反应产生相同气体体积所需的时间C.图乙实验中,如t s内针筒收集到V mL气体,则用O2表示的反应速率为VtmL/sD.为检查图乙装置的气密性,可关闭A处活塞,将注射器活塞推进一定距离后松开活塞,观察活塞是否回到原位7.pH相同的盐酸和醋酸溶液分别与Zn反应,若最终Zn完全溶解且得到的H2的质量相等。

实验九氯化钠溶液饱和蒸气压测定实验一、实验目的测定不同温度下氯化钠溶液的饱和蒸气压数据,采用Antoine方程进行关联,得出模型参数。
测定体系:质量分数15%的 NaCl-H2O二、实验原理本实验是采用动态沸点法,当液体的蒸气压与外界压力相等时,液体就会沸腾。
沸腾时的温度就是液体的沸点,对应的外界压力就是液体的蒸气压。
在不同的外压下,测定液体的沸点,从而得到液体在不同温度下的饱和蒸气压。
动态法的测压范围多为常压以下,适用于高沸点液体蒸气压的测定。
实验系统简单,安装方便,测量简单、迅速。
实验时,先将体系抽气至一定的真空度,测定此压力下液体的沸点,然后逐次往系统放入空气,增加外界压力,并测定相应的沸点。
Antoine方程是最基础的蒸气压关联方程。
其适用范围在3~200kPa,超出此范围所得的压力值一般偏低。
对于混合物而言,Antoine方程的具体形式如下∑=-+=niiiiwCTBAp)100)}](/(1000{[lg式中,p——溶液的饱和蒸气压,单位kPa;T——温度,单位K;w——溶质NaCl的质量分数;A i、B i——Antoine方程中的参数,利用溶液的蒸气压数据回归得到。
已知当溶剂为水时,C=43.15。
关联数据时要求n=3。
三、仪器该装置采用动态沸点法测定溶液饱和蒸气压,具有快速、准确等优点。
该装置由两口烧瓶(500ml)、恒温油浴槽、强磁力搅拌器、回流冷凝器、低温箱、隔膜真空泵、压力数据采集器、温度数据采集器、大气压力表等部分组成。
实验时,烧瓶中放入待测溶液约250ml,装置中所有玻璃管和玻璃管的连接处均涂有真空硅脂,玻璃管和橡胶管之间均涂有真空泥,以确保系统的密封性能。
四、药品氯化钠(99.5%)去离子水五、操作步骤(1)将待测溶液(质量分数为15%的NaCl水溶液)约250ml置入烧瓶中,搭建好测定装置。
(2)开启低温箱,在冷凝器中通入-4℃的冷却乙醇(低温箱控制水温)。
(3)开启磁力搅拌器。


氯化钙的溶解度氯化铅在氯化钠和氯化钙水溶液中之溶解度氯化粉在氯化纳和氯化钙水落液中之溶解度冶金系研究生辣泊鲁用水冶法、理各仲扮生崖过巢实际中,, a h浸出过得常遇到氛化过程和氛化程所接。
的半度品和某些含始的多金屡碳(特, l是氧j,: : 2 因此研究N a c 一p b C 一c a C 一H 0 l I I燃的系:) 之工杭对我俐是有实际意义的关龄Pb C II C 或c a C 水溶液中之溶解度舍有人研究过I a l c 在N a 水溶液中之溶解度和八M 叼班推叹。
. A C l a 。
刀对p b C I x P b 1 2 〔2 )〔〕3 〕的溶解度研究桔果列出以供参考(圆圆在辈镯的Na:.,c o 现将八e M a c 对艺.,..在Caa水溶液中,之曰p夕加介护平交丫义食卜犷.0!笋刀1. 1户赓一乙伟、在叁蒸. d李巾Jx口口妙协.1少. p. ‘口..如, 。
‘才和口一峪口J即矛.户心叹喊Tb 依衣‘ 少小‘、肠才几瓜‘ 峨客水中识林今反.谁应杠H.叫瓦最近苏联莫斯科四德列也夫化学工落所的HP b C 1 一N2K y 肠从朋班x 和B,几叭班P 邢曾研究过OaCI一C a C I一H O:,1 系统〔〕其桔果中之一部分列货圆3,同4食忿仪呀含‘.落矛. 口徽曲挂13‘乃峨石叨一么砚一,一从。
户奋卜心卿盏,:动. 曲筱2苏遥仲夕久1・一一23 5 6・・% N 厂1N, 755 % C aC I2 0 08 %C aI. 0 4%a , C CI . 花丫会粉夕肠产犷之-‘ 份理‘介一从口了舌,‘神峨;一呱此.-几是度,c决人茸曲挂福号: N aC 五%员必概1‘118.02 。
18 03・: C a C立%},0 。
s・1{18 2・・冰鑫赫4 6}4・‘ 7}5 63・: : 从过去的一些研究抬果和圆2 圆3 圆4 都可看出溶剂中G a C 立的含量增加脸促使P b G 皿的: 榕解度加大但在外H K y 3 b M H 树X 和从H B 江a 及只M 班p o a 的研究工作所探用C a c 幸浪度较. B : 2 : : 为盛得对P b C 召具有更高溶解能力的溶剂低淮行含C a C 夕浪度更高的P b C 立一C a C 互一, , , ,・,。

然顿市安民阳光实验学校2.2发展中的化学电源(1)1、人造地球卫星用到的一种高能电池﹣﹣银锌蓄电池,其电池的电极反应式为:Zn+2OH﹣﹣2e﹣═ZnO+H2↑,Ag2O+H2O+2e﹣═2Ag+2OH﹣.据此判断氧化银是()A.负极,被氧化 B.正极,被还原C.负极,被还原 D.正极,被氧化【答案】B【解析】根据化合价可知,电极反应中银的化合价降低,被还原;原电池中较活泼的金属做负极,另一电极作正极,发生还原反应,所以氧化银为正极,得电子被还原.故选B.2、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是()A.Ag B.Zn(OH)2C.Ag2O D.Zn【答案】D【解析】在银锌二次电池中,根据反应:2Ag+Zn(OH)2Ag2O+Zn+H2O,放电时为原电池,活泼金属做负极,失电子发生氧化反应,根据电极反应应为锌.故选D.3、如图是干电池构造示意图,下列说法错误的是()A.最早使用的化学电池是锌锰电池,它是一次性电池B.电池使用过程中,锌会逐渐溶解:Zn=Zn2++2e﹣C.锌锰电池即使不用,放置过久,也会失效D.锌锰干电池内的电解质NH4Cl可以换成HCl溶液【答案】D【解析】A.锌锰电池不能反复充电放电,是一次性电池,故A正确;B.Zn在负极失电子,逐渐溶解,则电池使用过程中,锌会逐渐溶解:Zn=Zn2++2e ﹣,故B正确;C.干电池中的电解质溶液易与锌反应减小电解质的量和电极材料的量,所以锌锰干电池即使不用,长久放置也会失效,故C正确;D.HCl溶液的酸性较强,能与Zn反应,把电解质NH4Cl可以换成HCl溶液会使锌桶被腐蚀,故D错误.故选D.4、燃料电池是一种高效、环境友好的发电装置,它的原理是原电池原理,可进行能量的转换。
以CH4为燃料时,另一极通入氧气,以KOH为电解质溶液,产物为碳酸钾和水,二氧化碳的排放量比常规发电减少40%以上。

初中化学水电解教案主题:水电解目标:了解水电解的过程及相关原理。
一、引言水电解是指利用电流使水分解成氧气和氢气的化学反应。
在这个实验中,我们将学习如何进行水电解实验,以及水电解背后的化学原理。
二、实验步骤1. 准备实验器材:玻璃容器、导线、电源、电极(铂电极)、坩埚。
2. 将两根电极(铂电极)插入玻璃容器中,确保电极不相互接触。
3. 将玻璃容器中注满适量的水。
4. 将导线连接电源,将电源接通。
5. 观察水电解反应过程中产生的气体。
6. 记录实验现象及观察结果。
三、实验现象1. 在阴极产生气泡,气泡中气体通常为氢气。
2. 在阳极也产生气泡,气泡中气体通常为氧气。
3. 氢气燃烧时,会“啪啪”作响,氧气则会助燃。
四、实验原理1. 水分子(H2O)在电流作用下分解为氢离子(H+)和氧离子(O2-)。
2. 在阳极发生反应:4OH- -> 2H2O + O2 + 4e-。
3. 在阴极发生反应:4H+ + 4e- -> 2H2。
五、实验总结通过水电解实验,我们可以看到水在电流作用下分解产生氢气和氧气。
水电解是一种重要的电化学反应,对于理解化学反应原理有一定的帮助。
在实验中要注意安全,正确操作实验器材。
六、拓展延伸1. 采用不同电极材料,观察水电解反应产物是否有变化。
2. 了解工业上水电解的应用及相关技术。
通过这次实验,我们对水电解有了更深入的了解,同时也学习到了电化学反应的基本原理。
希望大家可以进一步探索相关知识,加深对化学原理的理解。
愿大家在学习中有所收获!。

氯化钠溶液的电解一、实验原理水的电解阴极反应:2H++2e→H2↑阳极反应:4OH - 4e→2H2O +O2↑总反应:2H2O = 2H2↑+O2↑饱和 NaC l 溶液的电解阴极反应:2H++2e→H2↑阳极反应:2Cl - 2e→Cl2↑总反应:2NaCl + 2H2O = H2↑+Cl2↑+2NaOH二、仪器、材料与药品直流低压电源、具支U形管、石墨电极、铁电极、导线、烧杯、玻璃棒;酚酞试液、淀粉KI试纸、NaCl饱和溶液。
三、实验操作过程与实验现象如图,向具支U形管中滴加饱和NaCl溶液至支管以下约2cm处,并从两管口各滴加2滴酚酞试液,装上铁阴极和石墨阳极,接通低压直流电源(6-12V)。
可看到电极附近有大量气泡。
2NaCl + 2H2O = H2↑+Cl2↑+2NaOH实验现象:在阴极区,溶液变红,在阳极区上方,用润湿的KI淀粉试纸试之,变蓝。
(本实验现象:阴极区,溶液变红,将湿润的淀粉KI试纸移至阳极区支管口,其变蓝)。
四、实验注意事项1、电解用饱和氯化钠溶液在使用之前一定要精制,这样可除去其中的Ca2+、Mg2+,以避免在阴极附近出现白色浑浊现象。
方法是:给盛有36gNaCl的烧杯中加入蒸馏水,边加热边搅拌,制成饱和溶液。
待稍冷却,滴入2滴酚酞试液,再注入含有NaOH和Na2CO3各2g的混合溶液至碱性。
静置数小时,待沉淀形成后过滤,将滤液加热至沸腾,稍冷后滴加盐酸至酚酞刚好变为无色为止。
2、电解NaCl时,在滴入酚酞的溶液表面有时会出现一层白色胶体,这是由于酚酞在饱和溶液中溶解度变小的缘故。
五、相关文献与重点文献综述实验装置的改进Cl2的检验与处理将饱和食盐水倒入到装置3的U形管中,在阳极支口1处轻轻塞入一张湿润的KI淀粉试纸,再接一尖嘴玻璃管通入2mol.L-1氢氧化钠溶液的烧杯中。
接通电源进行电解,1分钟左右湿润的KI淀粉试纸开始有少量蓝色出现,并逐渐变深,但2分钟之后颜色不在变深,再继续电解,试纸颜色反而变浅,5分钟后蓝色完全褪去。

Cl--35.5 Br--80 I--127一、氯、溴、碘及其化合物一、氯、溴、碘的提取(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。
海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。
2NaCl + 2H2O =通电= 2NaOH + H2↑+Cl2↑氯碱工业面临问题:①产品对设备腐蚀严重、环境污染显著。
②电能消耗量大。
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl②向含溴单质的水溶液中通热空气和水蒸汽,使溴从溶液挥发,冷凝得到粗溴,精致后得到高纯度的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl2 == I2+2NaCl③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途(一)氯气(chlorine gas)的性质和用途①实验室制氯气:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O②装置:固液加热型③收集:向上排空气法④验满:湿润的淀粉-碘化钾试纸(将试纸靠近瓶口,若试纸变色说明已搜集满)等⑤尾气吸收:NaOH溶液(排饱和食盐水)。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。
能溶于水,有毒。
2、化学性质:氯原子易得电子,氯是活泼的非金属元素。
氯气与金属、非金属等发生氧化还原反应,一般作氧化剂。
与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。
与金属的反应:Cu+Cl2=点燃=CuCl2现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色。
2Na+Cl2=点燃=2NaCl(白烟)2Fe+3Cl2=点燃=2FeCl3现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈黄色。
常温下,干燥氯气或液氯不与铁反应,所以可用钢瓶储存氯气。
化学教学论实验——电解质溶液实验报告学院:化学化工学院班级:10级化教班组:第八组组员:王红梅(12010240089)汪婷(12010240059)魏琼(12010240076)单晓燕(12010240088)电解质溶液一、实验目的1、了解电解质溶液的化学原理,电极发生的氧化还原反应及其产物;2、掌握离子迁移、电解水、电解饱和食盐水与电解氯化铜的实验演示技能;3、以及探究浓度、电压、电极对电解质溶液电解速率的影响。
二、实验原理电解质溶液在直流电场的作用下,溶液中的离子发生定向移动,即阴离子向阳极方向移动,阳离子向阴极方向移动。
可以利用某些有色离子(如Cu2+ ,MnO4-等)的迁移来演示说明溶液中离子的迁移。
氯化钠溶液在直流电场作用下,阳离子(即Na+和H+)移向阴极,阴离子(即Cl-和OH-)移向阳极。
阳极反应:2Cl- - 2e==Cl2↑(氧化反应)阴极反应:2H+ + 2e==H2↑(还原反应)总化学反应式:2NaCl+2H2O==2NaOH+H2↑+Cl2↑电解水的原理:阴极:4H﹢+4e﹣=2H2↑阳极:4OH﹣-4e﹣=O2↑+2H2O电解氯化铜溶液就是电解氯化铜本身:阳极:2Cl--2e-==Cl2↑阴极:Cu2++2e-==Cu总反应方程式为:CuCl2=Cu + Cl2↑三、实验用品仪器和材料:自制H形管(具支的滴定管)、小烧杯、U形管、漏斗、量筒、尖嘴玻璃管、滴定管、直流稳压电源、铁架台及附件、铁钉电极、回形针电使其高度各约为4cm左右。
2、在距离分界面1cm 处插入碳棒电极,接通电源,电压调至25V, 10min 后,观察U形管中的现象。
现。
阳极区液面聚合大量的水合铜离子。
阴极区聚合大量的MnO-46、硫酸铜溶液易水解,配制硫酸铜溶液时要酸化。
电解饱和食盐水1、在U形管中注入饱和食盐水约50ml,分别插入铁钉,碳棒做电极,铁钉与电源负极相连,碳棒与电源正极相连,电解前在阴极区滴入两滴酚酞溶液,用于检验阴极区的产物。
电解饱和食盐水一、实验原理在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着na+、h+、cl-、oh-四种离子。
当接通直流电原后,带负电的oh-和cl-移向阳极,带正电的na+和h+移向阴极,在这样的电解条件下阳极(c):2cl--2e-===cl2↑阴极(fe):2h++2e-===h2↑由于h+在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,水分子继续电离成h+和oh-,h+又不断得到电子,结果溶液里oh-的数目相对地增多了。
因而阴极附近形成了氢氧化钠的溶液。
电解总反应式:2nacl+2h2o2naoh+h2↑+cl由原理可知,本次实验中用到的仪器和试剂有:具支u型管、玻璃棒、铁架台(带铁圈)、碳棒、粗铁钉、导线、直流电源(含电流表)饱和食盐水、淀粉碘化钾试纸、酚酞试液、蒸馏水。
二、实验操作过程与实验现象电解nacl水溶液装置(1)向具支u形管中碱液饱和状态nacl溶液至支管以下约2cm处为。
(2)从两管口各滴加2滴酚酞试液。
(3)装上铁阴极和石墨阳极,拨打扰动直流电源(6-12v)。
(1)电极附近有大量气泡。
(2)在阴极区,溶液变白,在阳极区上方,用润湿的ki淀粉试纸先行之,试纸变蓝。
三、实验应注意的事项1、电解用饱和状态nacl溶液在采用前一定必须精制,这样可以除去其中的ca2+、mg2+,以防止在阴极附近发生白色浑浊现象。
方法就是:给盛有36gnacl的烧杯中重新加入蒸馏水,边冷却边烘烤,做成饱和溶液。
等待稍加热,倒入2几滴酚酞试液,再转化成所含naoh和na2co3各2g的混合溶液至碱性。
静置数小时,等待结晶构成后过滤器,将滤液冷却至融化,稍热后碱液盐酸至酚酞刚好变成无色年才。
2、电解nacl过程中,在滴入酚酞的溶液表面有时会出现一层白色胶体,这是由于酚酞在饱和溶液中溶解度变小之故。
3、电源电压为12v,例如短路,按一下登位键即可。
4、具支u型管用铁架台固定。
5、具支u型管挑食盐水不要太多,没有过电极即可。
一、选择题1.下列有关化学反应速率的说法正确的是A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变C.NH3的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢D.在一定温度下固定容积的容器中,发生SO2的催化反应,充入He,反应速率不变2.已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解分两步基元反应:H2O2+I- →H2O+IO- 慢 H2O2+IO- → H2O+O2+I- 快;下列有关该反应的说法正确的是A.v (H2O2)=v (H2O)=v (O2) B.IO-是该反应的中间产物C.反应活化能为98 kJ·mol-1D.反应速率由IO-浓度决定3.某同学用下图所示装置探究原电池的工作原理,并推出下列结论,正确的是A.Cu质量减少B.Zn用作负极C.电子由Cu并经导线流向Zn D.该装置将电能转换为化学能4.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。
下列叙述中不正确的是A.通过图甲实验产生气泡的快慢能比较Fe3+和Cu2+对H2O2分解的催化效果B.用图乙装置判断反应速率的大小,可测定反应产生相同气体体积所需的时间C.图乙实验中,如t s内针筒收集到V mL气体,则用O2表示的反应速率为VtmL/sD.为检查图乙装置的气密性,可关闭A处活塞,将注射器活塞推进一定距离后松开活塞,观察活塞是否回到原位5.已知:①S(g) +O2(g)= SO2(g) △H1②S(s)+O2(g)=SO2(g) △H2,下列说法正确的是A.硫燃烧过程中将化学能转化全部为热能B.相同条件下,1 mol S(s) 比l mol S(g) 燃烧更剧烈C.两个过程的能量变化可用下图表示,△H1<△H2<0D.两个反应中反应物的总键能都比生成物的总键能小6.下列实验方案不能达到相应实验目的的是实验目的实验方案A制备CuSO4用稀硫酸、过氧化氢和铜粉反应B 加快酸性KMnO4与H2C2O4溶液的反应速率加入一粒黄豆大的MnSO4固体C 除去NaC1固体表面的少量KC1杂质用饱和NaC1溶液洗涤D 探究浓度对反应速率的影响向盛有同体积、不同浓度NaHSO3溶液的试管中同时加入同体积、同浓度NaC1O溶液,观察现象A.A B.B C.C D.D7.已知X(g)+3Y (g)2W(g)+M (g) △H=-a kJ·mol-1(a>0)一定温度下,在体积恒定的密闭容器中,加入1 mol X(g)与3mol Y (g),下列说法正确的是()A.充分反应后,放出热量为a kJB.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2C.若增大Y的浓度,正反应速率增大,逆反应速率减小D.当X的物质的量分数不再改变,表明该反应已达平衡8.下列有关说法正确的是A.水分子间的氢键是一个水分子中氢原子与另一个水分子中的氧原子间形成的化学健B.Na与水反应时,增加水的用量可以明显加快化学反应速率C.纯碱溶液清洗油污时,加热可以增强其去污力D.向海水中加入净水剂明矾可以使海水淡化9.古代的很多成语、谚语都蕴含着科学知识,下列对成语、谚语的解释正确的是A.“冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高B.“玉不琢,不成器”“百炼方能成钢”发生的均为化学变化C.“爆竹声中除旧岁”爆竹爆炸发生的是分解反应,吸热反应D.“火树银花”中的焰火实质上是金属元素的焰色反应10.如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应,各物质浓度随时间的变化。
2023届高考化学一轮训练题—化学反应原理综合题1.(2022·河南南阳·高三期中)SO2是产生酸雨的主要原因,研究SO2等大气污染物的治理具有重要的意义。
(1)工业上回收SO2制取硫酸,该过程中涉及的反应如下:①2SO2(g)+O2(g)2SO3(g) △H1=-196.6kJ•mol-1①SO3(g)+H2O(l)H2SO4(aq) △H2=-130.2kJ•mol-1则2SO2(g)+O2(g)+2H2O(l)2H2SO4(aq) △H=____kJ•mol-1。
(2)工业上根据反应:2CO(g)+SO2(g)S(1)+2CO2(g) △H=-37.0kJ•mol-1,可利用CO处理SO2并回收硫。
已知在一定温度下,向甲、乙两个起始体积相同的密闭容器中分别充入2molCO和1molSO2。
一段时间后达到平衡,则SO2的转化率:α(甲)____α(乙)(填“>”“<"或“=”,下同)、混合气体的平均相对分子质量:M(甲)____M(乙)。
(3)在容积相等的三个密闭容器中分别按投料比n(CO):n(SO2)=1:1、2:1、3:1投料,发生反应:2CO(g)+SO2(g)S(g)+2CO2(g) △H=+8.0kJ•mol-1,测得SO2的平衡转化率与温度的关系如图所示。
①曲线III代表的投料比为____。
①在密闭容器中按曲线II对应的投料比投料,若初始压强为p0,在a点对应的温度下,该反应的平衡常数K p=____(K p为用分压表示的平衡常数,分压=总压×物质的量分数)。
2.(2022·重庆南开中学高三阶段练习)随着我国碳达峰、碳中和目标的确定,二氧化碳的综合利用倍受关注。
(1)CO2催化加氢合成甲烷的反应为:22421CO (g)+4H (g)=CH (g)+2H O(g)ΔH已知:-12222CO (g)+H (g)=CO(g)+H O(g)ΔH =+41kJ mol ⋅-12423CO(g)+3H (g)=CH (g)+H O(g)ΔH =-205kJ mol ⋅①则1ΔH =_______,该反应在_______(填“高温”、“低温”或“任意温度”)下能自发进行。
饱和氯化钠溶液的电解409070522009级化学一班第四实验小组电话一、实验原理饱和NaCl溶液的电解阴极反应:2H++2e-→H2↑ 阳极反应:2Cl--2e-→Cl2↑总反应:2NaCl+2H2O 通电H2↑+Cl2↑+2NaOH二、实验操作过程与实验现象1.饱和氯化钠溶液的电解:如图所示,向具支U形管中滴加饱和NaCl溶液至支管以下约2cm处,并从两管口各滴加2滴酚酞试液,装上铁阴极和石墨阳极(铁电极和石墨电极使用时,要想进行预处理,用砂纸打磨铁电极,除去铁锈,用硫酸浸泡铁电极和石墨电极),接通低压直流电源(12~24V)。
可以看到电极附近有大量气泡产生。
在阴极区,溶液变红,说明阴极区溶液呈碱性;在阳极区上方,用润湿的KI淀粉试纸试之,变蓝,说明在阳极区有Cl2生成。
电解氯化钠溶液的装置2.探究实验:(1)不换溶液在上述实验的基础上反接阴极和阳极,发现在铁电极的一侧出现白色絮状沉淀,并且沉淀向下移动,在具支U型管底部慢慢变为灰绿色。
取少量灰绿色的沉淀于试管中,加少量稀硫酸酸化,加硫氰化钾溶液,可观察到试管中的溶液变为血红色。
可知灰绿色的沉淀是Fe(OH)2被氧化生成的F e(O H)3。
(2)换新的饱和氯化钠溶液,直接反接(铁电极做阳极,石墨电极做阴极),电解时发现阴极变为红色,电极附近没有Fe(OH)2絮状沉淀生成,看见铁电极附近溶液变黄,且黄色渐渐向下移动,在具支U形管底部生成灰绿色沉淀。
同样取少量灰绿色沉淀于试管中,加少量稀硫酸酸化,加硫氰化钾溶液,可观察到溶液变为血红色。
该过程为:电解产生的Fe2+被向阴极移动与向阳极移动的OH-反应,生成Fe(OH)2,溶液中的氧化性物质会将Fe(OH)2氧化成Fe(OH)3,所以底部有灰绿色沉淀生成。
(3)换新的饱和氯化钠溶液,正接电极(石墨电极做阳极,铁电极做阴极),但将连接石墨的铁丝也浸没在氯化钠溶液中。
接通电源可观察到,两个电极上均有气泡产生,阳极产生的气体能使湿润的碘化钾试纸变蓝,阴极变红,产生能燃烧的氢气。
水、饱和氯化钠溶液的电解
一、目的与要求
1、 掌握演示电解水和电解饱和食盐水实验操作技能;
2、初步掌握这两个实验的讲解方法;
3、探索、设计电解水器的代用装置。
二、实验原理
水的电解:
阴极反应:
+
-H 2↑ 阳极反应:4OH --4e -→2H 2O+O 2↑
总反应:2H 22↑+O 2↑
饱和NaCl 溶液的电解
阴极反应:2H ++2e - 阳极反应:2Cl --2e -→Cl 2↑
总反应:2NaCl+2H 22+Cl 2↑+2NaOH
三、主要仪器、材料与药品
霍夫曼电解水器、直流低压电源、具支U 形管、带刻度试管、石墨电极、铁电极、导线、烧杯、玻璃棒;
固体NaOH 、酚酞试液、淀粉KI 试纸、NaCl 饱和溶液。
四、实验内容
1.水的电解
用霍夫曼电解水器电解水
1、检查气密性 关闭霍夫曼电解水器(图6-8)上部的两个旋钮,然后向贮液器中加入水,观察贮液器中水面的变化,若无变化,证明气密性良
好,若下降了,则应在活塞处涂抹凡士林或将下部电极处的塞子塞紧(本实验中的现象:贮液器中水的页面并没有下降,证明气密性良好);
2、打开霍夫曼电解水器上部两个旋钮,由贮液器加5%的NaOH溶液到刻度中最高刻度处,赶尽气泡后关闭旋钮,连接导线与直流低压电源;
3、接通电源,调节电压为20V时,可看到刻度管内有大量气泡,约10min,可看到阴极产生的气体的体积为阳极的2倍(本实验现象:阴极产生的气体约为阳极的2倍);
4、打开阴极旋钮,用溶液把气体压进小试管,点燃,发生爆鸣,证明
是H
2。
再打开阳极旋钮,用同法收集气体,余烬试之,复燃,说明是O
2。
(本
实验中的现象:收集阴极产生的气体,点燃后发生爆鸣,将带火星的火柴梗移至阳极管口,带火星的火柴梗复燃)。
图6-8 霍夫曼电解水器
2.饱和NaCl溶液的电解
如图6-10,向具支U形管中滴加饱和NaCl溶液至支管以下约2cm处,并从两管口各滴加2滴酚酞试液,装上铁阴极和石墨阳极,接通低压直流电源(6-12V)。
可看到电极附近有大量气泡。
在阴极区,溶液变红,在阳极区上方,用润湿的KI淀粉试纸试之,变蓝。
(本实验现象:阴极区,溶液变红,将湿润的淀粉KI试纸移至阳极区支管口,其变蓝)。
图6-10 电解NaCl水溶液装置
五、注意事项
1.用霍夫曼电解水器时,电解液为5%的H2SO4或5%的NaOH溶液。
2.实验完毕,一定要用水冲洗净霍夫曼电解水器中残留的酸碱液,以免旋钮被“卡住”。
3.电解水时,加入的电解质并不参与电极反应,主要是为了增加导电性。
浓度过低,达不到效果,以10%以上为宜。
若有低压直流电源,调高电压,可缩短演示时间,通常调在12~24V之间。
若用干电池,可4节串联为6V使用。
4.电解用饱和NaCl溶液在使用前一定要精制,这样可除去其中的Ca2+、Mg2+,以避免在阴极附近出现白色混浊现象。
方法是:给盛有36g NaCl的烧杯中加入蒸馏水,边加热边搅拌,制成饱和溶液。
待稍冷却,滴入2滴酚酞试液,再注入含有NaOH和Na2CO3各2g的混合溶液至碱性。
静置数小时,待沉淀形成后过滤,将滤液加热至沸腾,稍冷后滴加盐酸至酚酞刚好变为无色为止。
5.电解饱和NaCl过程中,在滴入酚酞的溶液表面有时会出现一层白色胶体,这是由于酚酞在饱和溶液中溶解度变小之故。
6、电解饱和NaCl时,一定注意将铁电极连在电源的负极。
7、电解饱和NaCl的过程中,阴极是铁而不是惰性电极的原因,是为了突出金属不能做阳极。
六、思考与讨论
1.电解水时,产生气体体积比和理论上的2∶1不一致,主要由于以下几个方面的原因:①气体溶解度不同。
20℃、1kPa时,O2为31mL.L-1,H2为18.2 mL.L-1;②电极材料与O2发生了反应。
如NaOH 中含有的少量NaCl,阳极放出的氧原子与Cl-生成ClO-;③电极上的其他副反应。
2.电解水时对电极材料的选择是:酸性溶液用铂、铅或电工用保险丝;碱性溶液用铂、镍或不锈钢丝。
无论酸性或碱性溶液,都不宜用铜或石墨作电极。
前者在电解时其阳极不断被溶解,减少O2的生成量;后者的超电压高,且对气体有吸附作用,产生气体速率慢。
3.检验离子定向移动的装置:将长约5cm、宽约3cm的滤纸预先用1mol.L-1 Na2SO4溶液浸泡,平铺在玻璃片上。
向滤纸中央放置几粒KMnO4晶体,在对称于晶体约2cm处各放置一石墨电极,用鳄鱼夹将石墨、滤纸、玻璃片夹在一起,调节直流电压至12V后接通电源,即可看到紫红色斑点向正极移动。
七、实验反思
1、讲解实验时,注意不能过于密集的提出问题;
2、作为一名教师,在给同学讲解实验原理时,一定要讲的清楚
明了;讲解仪器时一定要将其用法和注意事项讲清楚,尤其
是学生第一次接触到的仪器;
3、作为一名化学教师,一定要注意规范的化学用语。