27--化学理论(反应热与热化学方程式)
- 格式:docx
- 大小:221.06 KB
- 文档页数:5

焓变热化学方程式一、焓变1.焓变和反应热(1)反应热:化学反应中□01吸收或放出的热量。
(2)焓变:生成物与反应物的内能差,ΔH=H(生成物)-H(反应物)。
在恒压条件下化学反应的热效应,其符号为□02ΔH,单位是□03kJ·mol-或kJ/mol。
2.吸热反应与放热反应(1)从能量守恒的角度理解ΔH□08生成物的总能量-□09反应物的总能量。
(2)从化学键变化角度理解ΔH□12反应物的总键能-□13生成物的总键能。
(3)常见的放热反应和吸热反应①放热反应:大多数化合反应、□14中和反应、金属与□15酸的反应、所有的燃烧反应。
②吸热反应:大多数分解反应、盐的□16水解反应、Ba(OH)2·8H2O和NH4Cl 反应、C与H2O(g)反应、C与CO2反应。
二、热化学方程式1.概念:表示参加反应□01物质的量和□02反应热的关系的化学方程式。
2.意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的□03能量变化。
例如:H2(g)+12O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1,表示在25 ℃和1.01×105 Pa下,1 mol氢气和0.5 mol氧气完全反应生成1 mol液态水时放出285.8 kJ的热量。
3.热化学方程式的书写三、燃烧热与中和热能源1.燃烧热2.中和热(1)中和热的概念及表示方法(2)中和热的测定①装置②计算公式ΔH=-4.18m溶液(t2-t1)n水kJ·mol-1t1——起始温度,t2——终止温度。
(3)注意事项①泡沫塑料板和碎泡沫塑料(或纸条)的作用是□09保温隔热,减少实验过程中的热量散失。
②为保证酸完全中和,采取的措施是□10使碱稍过量。
3.能源1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)物质发生化学变化都伴有能量的变化。
(√)错因:_________________________________(2)放热反应不需要加热就能反应,吸热反应不加热就不能反应。

化学反应热的计算知识点
化学反应热的计算主要涉及到几个关键知识点:
反应热的概念:化学反应的热效应,通常称为反应热,其符号为Qp。
当反应在恒压下进行时,反应热称为等压热效应。
反应热的计算公式:Qp = △U + p△V = △U + RT∑vB。
其中,△U表示反应产物的内能减去反应物的内能,p是压力,△V是反应产物的体积减去反应物的体积,R是气体常数,T 是绝对温度,∑vB(g) = △n(g)/mol,即发生1mol反应时,产物气体分子总数与反应物气体分子总数之差。
焓的定义:由于U、p、V都是状态函数,因此U+pV也是状态函数,我们将其定义为焓,符号为H。
于是,反应热可以表示为:Qp = △H = H终态- H始态。
反应热的测量与计算:反应热可以通过实验测量得到,也可以通过化学反应方程式和比热容公式进行计算。
另外,反应热与反应物各物质的物质的量成正比。
利用键能计算反应热:通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,键能通常用E表示,单位为kJ/mol。
反应热等于反应物的键能总和与生成物键能总和之差,即△H = ΣE(反应物) - ΣE(生成物)。
由反应物和生成物的总能量计算反应热:△H = 生成物总能量- 反应物的总能量。
也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。
[投影][讲]根据图示从山山的高度与上山途径无关及能量守衡定律来例证盖斯定律。
[活动]学生自学相关内容后讲解[板书]1、盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
[讲]盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。
[板书]2、盖斯定律在生产和科学研究中有很重要的意义[科学探究]对于反应:C(s)+ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案反应的ΔH。
[师生共同分析]我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g) =CO2(g);ΔH=-393.5 kJ/molCO(g)+ O2(g)=CO2(g);ΔH=-283.0 kJ/mol[投影][讲]根据盖斯定律.可以很容易求算出C(s)+ O2(g)=CO(g)的ΔH。
∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5 kJ/mol即:C(s)+ O2(g)=CO(g)的ΔH=-110.5 kJ/mol[投影][点击试题]例1、通过计算求的氢气的燃烧热:可以通过两种途径来完成如上图表:已知:H2(g)+O2(g)=H2O(g);△H1=-molH2O(g)=H2O(l);△H2=-mol根据盖斯定律,则△H=△H1+△H2=-mol+(-mol)=-mol[点击试题]例2、实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=·mol-1 (1)C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1 (2)H2(g)+O2(g)=H2O(l);ΔH3=·mol-1 (3)C(石墨)+2H2(g)=CH4(g);ΔH4(4)[投影][讲]利用盖斯定律时,可以通过已知反应经过简单的代数运算得到所求反应,以此来算得所求反应的热效应。

专题27 热化学反应方程式书写1.(2009·重庆高考真题)下列热化学方程式正确的是(注:△H的绝对值均正确)A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ(中和热)C.S(s)+O2(g)=SO2(g);△H=-269.8kJ/mol(反应热)D.2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)【答案】C【解析】A.燃烧热是25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时的水应为液体,因此反应热不是燃烧热,错误;B.△H的单位是kJ·mol-1,错误;C.符合书写热化学反应方程式的要求,正确;D.没有写上状态,错误;答案:C。
2.(2014·海南高考真题)标准状态下,气态分子断开1 mol化学键的焓变称为键焓。
已知H—H、H—O 和O=O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。
下列热化学方程式正确的是A.H2O(g)==H2+1/2O2(g)ΔH=-485 kJ·mol-1B.H2O(g)==H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1C.2H2(g)+O2(g)==2H2O(g) ΔH=+485 kJ·mol-1D.2H2(g)+O2(g)==2H2O(g) ΔH=-485 kJ·mol-1【答案】D【解析】化学反应的实质是旧化学键的断裂和新化学键的形成过程,断裂化学键需要吸收能量,形成化学键需要释放能量,根据H2O(g)=H2(g)+1/2O2(g),该反应的能量变化为2×463kJ/mol-436kJ/mol-495kJ /mol=+242.5kJ/mol,化学反应逆向进行,反应热数值不变,符号相反,化学方程式系数加2倍,反应热加倍,则2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol,答案选D。


高二化学知识点:化学反应原理复习下面是小编给大家整理的一份高二化学知识点:化学反应原理复习资料,希望能够帮助大家学习化学这门功课,考出一个好成绩。
高二化学知识点:化学反应原理复习【知识讲解】第1章、化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收。
一、化学反应的热效应1、化学反应的反应热(1)反应热的概念:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
用符号Q表示。
(2)反应热与吸热反应、放热反应的关系。
Q>0时,反应为吸热反应;Q<0时,反应为放热反应。
(3)反应热的测定测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:Q=-C(T2-T1)式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。
实验室经常测定中和反应的反应热。
2、化学反应的焓变(1)反应焓变物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。
反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。
(2)反应焓变ΔH与反应热Q的关系。
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。
(3)反应焓变与吸热反应,放热反应的关系:ΔH>0,反应吸收能量,为吸热反应。
ΔH<0,反应释放能量,为放热反应。
(4)反应焓变与热化学方程式:把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1书写热化学方程式应注意以下几点:①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。
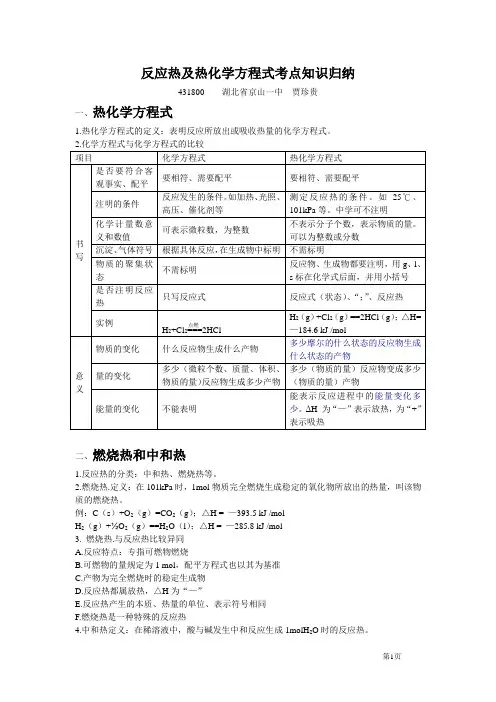
反应热及热化学方程式考点知识归纳431800湖北省京山一中贾珍贵一、热化学方程式1.热化学方程式的定义:表明反应所放出或吸收热量的化学方程式。
二、燃烧热和中和热1.反应热的分类:中和热、燃烧热等。
2.燃烧热.定义:在101kPa时,1mol物质完全燃烧生成稳定的氧化物所放出的热量,叫该物质的燃烧热。
例:C(s)+O2(g)=CO2(g);△H = —393.5 kJ /molH2(g)+½O2(g)==H2O(l);△H = —285.8 kJ /mol3. 燃烧热.与反应热比较异同A.反应特点:专指可燃物燃烧B.可燃物的量规定为1 mol,配平方程式也以其为基准C.产物为完全燃烧时的稳定生成物D.反应热都属放热,△H为“—”E.反应热产生的本质、热量的单位、表示符号相同F.燃烧热是一种特殊的反应热4.中和热定义:在稀溶液中,酸与碱发生中和反应生成1molH2O时的反应热。
如:H+(aq)+OH—(aq)===H2O(l);△H = —57.3 kJ /molNaOH(aq)+½H2SO4(aq)===½Na2SO4(aq)+H2O(l);△H = —57.3 kJ /molA.内涵①测定条件:在稀溶液中;②反应特点:中和反应,且只有氢离子和氢氧根离子浓度减少;③测定标准:生成1molH2O时的反应热;④配平标准:以生成1molH2O为标准配平其他物质的化学计量数;⑤表示形式:稀溶液用“aq”表示,水为液态(“l”表示)。
B.外延①若酸、碱是固体或浓溶液,则反应放出的热量较多(浓的强酸或强碱稀释会放热);②若生成的水多于或少于1mol,则放出的热量多于或小于57.3kJ ;③若生成物中除1molH2O外,还有其他难溶或难电离的物质生成时,反应热不是中和热;④若有弱酸或弱碱参加反应生成1molH2O时,则放出的热量一般小于57.3kJ(多数电离吸热,但HF电离放热);⑤任何配平的中和反应都有反应热,但只有只生成1molH2O的中和反应的反应热叫中和热。

化学反应中的热效应1.化学反应的热效应:化学反应中普遍伴随着热量变化,人们把反应时所放出或吸收的热量叫做反应的热效应。
2.放热反应:释放热量的反应叫做放热反应,如2H2+O2—点燃→2H2O3.吸热反应:吸收热量的反应叫做吸热反应,如C+CO2—高温→2CO4.在放热反应中,生成物的总能量低于反应物的总能量。
(也可从化学键的键能的角度分析)∴放热反应,反应物释放出能量后转变为生成物。
5.在吸热反应中,生成物的总能量高于反应物的总能量。
(也可从化学键的键能的角度分析)∴吸热反应中,反应物必须吸收外界提供热量才能转变为生成物。
6.反应热:反应物具有的能量和与生成物具有的能量总和的差值,即为反应热。
Q反应热= ∑Q反应物—∑Q生成物,若Q为正值,反应为放热反应;若Q为负值,反应为吸热反应。
7.常见的放热反应:①大多数化合反应,②可燃物的燃烧反应,③酸碱中和反应,④金属跟酸的置换反应,⑤物质的缓慢氧化。
8.常见的吸热反应:①大多数分解反应,如碳酸钙的分解反应,②盐的水解和弱电解质的电离,③Ba(OH)2·8H2O与NH4Cl的反应,④C和水蒸气、C和CO2的反应,⑤一般用C、CO 和H2还原金属氧化物的反应。
9.热化学方程式:表示化学反应所放出或吸收能量的化学方程式。
热化学方程式不仅表明了一个反应中的反应物和生成物,还表明了一定量物质在反应中放出或吸收的热量。
10.书写热化学方程式的要领:(1)热化学方程式中的化学计量数表示物质的量,所以可用整数,也可用分数,但必须配平。
(2)反应热的数值与物质的聚集状态有关,书写时必须标明物质的状态。
(3)热量的数值与反应物的物质的量相对应。
(4)当反应逆向进行时,其反应热与正向反应的反应热数值相等,但符号相反。
(5)热化学方程式之间可进行加减。
(6)反应热的数据与反应条件有关,未指明反应条件的通常是指25℃,1.01×105Pa。
11.燃烧热:1mol可燃物充分燃烧生成稳定化合物时放出的热量称为燃烧热。



反应热热化学方程式考点1 反应热焓变核心总结:1、任何化学反应在发生物质变化的同时都伴随着能量的变化,物质变化和能量变化是化学反应的两大特征,化学反应中的能量变化通常表现为热量变化,即放出热量或吸收热量,可表示为:质量守恒定律能量守恒定律2、化学反应中,当生成物回到反应物的起始温度时,所放出或吸收的热量成为化学反应的反应热,化学反应的反应热可以通过试验测得。
3、焓(H)是与内能有关的物理量。
焓变(△H)是指生成物与反应物的焓值差,它是恒压条件下化学反应的反应热,决定了某一反应吸收或放出热量的多少。
焓变的符号是△H,单位:kJ·mol-1或kJ/mol注意:同一条件下的统一化学反应,若化学计量系数不同,△H肯定不同,即使化学计量系数相同,若反应物或生成物的状态不同,△H也不同。
例题:1、下列说法正确的是()A 物质发生化学反应都伴随着能量变化B 伴有能量变化的物质变化都是化学变化C 反应热的单位kJ·mol-1表示1mol物质参加化学反应时的能量变化D 只有化学反应才有焓变,在一个化学反应中,反应物的总焓与生成物的总焓一定不同考点2 放热反应和吸热反应一个化学反应是放热反应还是吸热反应是有反应物与生成物所具有的能量决定的,是由键的形成和断裂的能量变化所决定的,与反应条件和反应类型没有关系。
放热反应形成原因:反应物所具有的总能量大于生成物所具有的总能量反应物的键能之和<生成物的键能之和Q(吸)<Q(放) △H<0 体系能量降低(能量越低,物质越稳定)。
常见的放热反应:燃烧、中和、铝热、活泼金属与酸或水反应、大多数化合反应。
吸热反应刚好相反常见的吸热反应:大多数分解反应、水解反应、Ba(OH)2·8H2O与NH4Cl例题:2、下列说法正确的是()A 高温条件下进行的反应一定是吸热反应,常温下就能进行的反应一定是放热反应B 所有的氧化还原反应都是放热反应,所有的分解反应都是吸热反应C 反应物总能量低于生成物总能量的反应是吸热反应D 当反应物总能量高于生成物总能量时,反应可能放热也可能吸热3、在下列反应中,属于氧化还原反应且△H<0的是()A 氨水与稀盐酸的反应B Ba(OH)2·8H2O与NH4Cl晶体的反应C 灼热的碳与CO2的反应D 甲烷在O2 中燃烧4、在下列反应中,生成物总能量高于反应物总能量的是()A 碳酸钙受热分解B 乙醇燃烧C 铝粉与氧化铁粉末反应D 氧化钙溶于水考点3 热化学方程式的书写书写原则及要求①必须在化学方程式的右边标明反应热△H的符号、数值和单位②书写热化学反应方程式时应注明△H的测定条件。
反应热的计算与热化学方程式1.引言反应热是热化学中的重要概念,用于描述化学反应的热效应。
它可以是吸热反应(吸收热量)或放热反应(释放热量)。
反应热的计算是热化学方程式的重要应用之一、本文将详细介绍反应热的计算方法以及热化学方程式的编写。
2.反应热的计算方法(1)实验测量法实验测量法是通过实验测定反应前后的温度变化来计算反应热。
其中最常用的方法是使用量热器(或称称量热仪)进行测量。
量热器由两个绝热容器组成,反应发生在内部容器中。
通过测量反应前后量热器中的温度变化,可以计算反应热。
实验测量法的计算公式为:ΔH=q/m其中,ΔH为反应热,q为测量得到的热量变化,m为反应物的摩尔数。
(2)热化学计算法热化学计算法是通过化学方程式和反应物的标准生成焓进行计算。
该方法适用于无法实验测量反应热的情况,或需要进行理论计算的情况。
热化学计算法的步骤如下:Step 1:编写化学方程式。
根据反应物和生成物的摩尔比,编写化学方程式。
Step 2:计算反应物的标准生成焓。
反应物的标准生成焓是指在标准状态下,单位摩尔的反应物生成一摩尔产物时释放或吸收的热量。
Step 3:计算反应热。
根据热化学方程式的适当系数,将反应物的标准生成焓相加,减去生成物的标准生成焓。
热化学计算法的计算公式为:ΔH=Σ(H生成物)-Σ(H反应物)3.热化学方程式的编写热化学方程式用于描述化学反应的热效应。
它的基本形式为:aA+bB→cC+dD其中,a、b、c、d分别为反应物和生成物的化学计量系数。
编写热化学方程式的关键是保持热效应平衡。
即,反应物和生成物的热效应之间应该满足热平衡的关系。
反应热ΔH的计算取决于反应物和生成物之间热效应的差异。
例如,考虑以下反应:2H2(g)+O2(g)→2H2O(l)该反应产生的反应热可以通过热化学计算法进行计算。
首先,需要确定反应物和生成物的标准生成焓。
ΔH(H2) = -286 kJ/mol (标准生成焓)ΔH(O2) = 0 kJ/mol (标准生成焓)ΔH(H2O) = -286 kJ/mol (标准生成焓)根据热化学计算法的公式,可得:ΔH=(2×ΔH(H2O))-[(2×ΔH(H2))+(1×ΔH(O2))]= (2 × -286 kJ/mol) - [(2 × -286 kJ/mol) + (1 × 0 kJ/mol)] = -572 kJ/mol + 572 kJ/mol= 0 kJ/mol因此,该反应为放热反应,反应热为0 kJ/mol。
焓变、热化学方程式1.反应热(焓变)(1)概念:在恒压条件下进行的反应的热效应。
符号:ΔH。
单位:kJ·mol-1或kJ/mol。
(2)表示方法吸热反应:ΔH>0;放热反应:ΔH<0。
2.放热反应和吸热反应的判断(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)从反应热的量化参数——键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
3.理解反应历程与反应热的关系4.热化学方程式(1)概念表示参加反应物质的量和反应热的关系的化学方程式。
(2)意义表明了化学反应中的物质变化和能量变化。
如:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1表示:2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。
(3)书写要求①注明反应的温度和压强(25 ℃、101 kPa下进行的反应可不注明)。
②注明反应物和生成物的状态:固态(s)、液态(l)、水溶液(aq)、气态(g)。
③热化学方程式中各物质的化学计量数只表示物质的物质的量,而不表示分子个数(或原子个数),因此可以写成分数。
④热化学方程式中不用“↑”和“↓”。
⑤由于ΔH与反应物的物质的量有关,所以热化学方程式中物质的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
当反应向逆反应方向进行时,其反应热与正反应的反应热数值相等,符号相反。
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应(×)(2)物质发生化学变化都伴有能量的变化(√)(3)吸热反应在任何条件下都不能发生(×)(4)活化能越大,表明反应断裂旧化学键需要克服的能量越高(√)(5)吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量(√)(6)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同(×)解析焓变与反应条件无关。
反应热与热化学方程式1、了解化学反应中能量变化的实质,知道化学能与热能的转化是化学反应中能量转化的主要形式。
2、认识能源是人类生存和发展的重要基础,知道节约能源、提高能量利用效率的实际意义。
3、了解焓变与反应热涵义。
明确ΔH = H (反应产物)-H (反应物)。
4一、反应热与热化学方程式1、反应热:反应热用符号△H 表示,单位是kJ/mol 或(kJ·mol -1)。
放热反应的△H 为“-”,吸热反应的△H 为“+”。
反应热(△H )的确定常常是通过实验测定的。
注意:在进行△H 的大小比较中,要区别正与负。
2H 2(g)+O 2(g)=2H 2O(g);△H 1=-a kJ·mol -12H 2(g)+O 2(g)=2H 2O(l);△H 2=-b kJ·mol -1a 与b 比较和△H 1与△H 2的比较是不一样的。
2、影响反应热大小的因素①反应热与测定条件(温度、压强等)有关。
不特别指明,即指25℃,1.01×105Pa (101kPa )测定的。
中学里热化学方程式里看到的条件(如:点燃)是反应发生的条件,不是测量条件。
②反应热的大小与物质的集聚状态有关。
③反应热的大小与物质的计量数有关。
在反应:2H 2(g)+O 2(g)=2H 2O(g) △H 1=-a kJ·mol-1中,2molH 2燃烧生成气态水放出的热量a kJ ,该反应的反应热是-a kJ·mol -1,注意单位的区别。
3、书写热化学方程式注意事项:a. 注明△H 的“+”与“-”,放热反应为“-”,吸热反应为“+”。
b. △H 写在方程式右边c. 必须标明物质的聚集状态(气体用“g”,液体用“l”,固体用“s”,溶液用“aq”)。
若用同素异形体要注明名称。
d. 各物质前的计量系数不表示分子数目只表示物质的量的关系。
△H 与计量数成正比关系。
同样的反应,计量系数不同,△H 也不同,例如:2H 2(g)+O 2(g)=2H 2O(g) △H =-483.6kJ·mol -1H 2(g)+21O 2(g)=H 2O(g) △H =-241.8kJ·mol -1上述相同物质的反应,前者的△H 是后者的两倍。
反应热及热化学方程式1.概念:能表示反应热的化学方程式称为热化学方程式。
例如:h2(g)+cl2(g)=2hcl(g);△h=-184.6 kj/mol2.意义:它既表示化学反应中的物质变化,也表示化学反应中的能量变化。
要点诠释:(1)热化学方程式必须标明能量变化。
(2)热化学方程式中必须注明反应物和产物的聚集状态,因为反应热与反应物和产物的聚集状态以及物质的量有关。
(3)热化学方程式中各物质的化学计量数只表示物质的量,所以可以用分数,但要注意反应热也是相应变化的。
3.注意事项:(1)一般化学方程式仅表示化学反应中的物质变化;化学方程式是表示反应释放或吸收的热量的化学方程式。
它不仅表示化学反应中的物质变化,还表示化学反应中的能量变化。
(2)△h只能写在标有反应物和生成物状态的化学方程式的右(后)边,即只有在热化学方程式中出现。
若为放热反应,△h为“-”;若为吸热反应,△h为“+”。
△h的单位一般为kj/mol。
(3)反应热△h与测定条件(温度、压强等)有关。
书写热化学方程式时,应注明△h的测定条件(温度、压强),未指明温度和压强的反应热△h,指25℃(298k)、101kpa时的反应热△h(绝大多数反应热△h是在25℃、101kpa时测定的)。
(4)物质本身具有的能量与物质的聚集状态有关。
反应物和生成物的聚集状态不同,反应热△h的数值以及符号都可能不同。
因此,必须注明物质(反应物和生成物)的聚集状态(气体:g 液体:l 固体:s 稀溶液:aq),才能完整地体现出热化学方程式的意义。
热化学方程式中,不用“↑”和“↓”。
(5)普通化学方程式中,各物质化学式前的化学计量数可以表示物质的分子数、物质的量等含义;但是在热化学方程式中,只表示该物质的物质的量,所以可以是整数、分数、或小数。
对相同化学反应,化学计量数不同,反应热△h也不同。
如:(6)相同条件(温度、压强),相同物质的化学反应(互逆反应,不一定是可逆反应),正向进行的反应和逆向进行的反应,其反应热△h数值相等,符号相反。
成都市第二十中学校高2017届化学第三轮复习检测(8) ----27题化学理论(反应热与热化学方程式)1.化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。
下列有关说法正确的是()A.该合成中所有的电能和热能全部转化为化学能B.该合成氨过程不属于氮的固定C.空气、水、太阳能均为可再生资源D.断裂N2中的N≡N键会释放出能量2.反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。
下列有关叙述正确的是()A.E2表示反应X―→C的活化能B.X是反应A+B―→C的催化剂C.反应A+B―→C的ΔH<0D.加入催化剂可改变反应A+B―→C的焓变3.关于如右图所示转化关系(X代表卤素),说法不正确的是()A.2H(g)+2X(g)=2HX(g)ΔH3<0B.生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多D.生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定4.下列说法正确的是()A.甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1B.已知H2O(l)=H2O(g)ΔH=+44 kJ·mol-1,则2 g H2(g)完全燃烧生成液态水比生成气态水多释放22 kJ的热量C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同5.H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)ΔH=-a kJ·mol-1。
已知:下列说法正确的是()A.H2、I2和HI分子中的化学键都是非极性共价键B.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJC.相同条件下,1 mol H2(g)和1 mol I2(g)的总能量小于2 mol HI(g)的总能量D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ6.下列各组热化学方程式的ΔH 前者大于后者的是( )①S(s)+O 2(g)=SO 2(g) ΔH 1S(g)+O 2(g)=SO 2(g) ΔH 2②2H 2(g)+O 2(g)=2H 2O(g) ΔH 32H 2(g)+O 2(g)=2H 2O(l) ΔH 4③CaCO 3(s)=CaO(s)+CO 2(g) ΔH 5CaO(s)+H 2O(l)=Ca(OH)2(s) ΔH 6A .只有①③B .只有①②C .只有②③D .①②③7.已知:H 2(g)+12O 2(g)=H 2O(g)ΔH 1=-241.8 kJ·mol -1 C(s)+12O 2(g)=CO(g) ΔH 2=-110.5 kJ·mol -1。
由此可知焦炭与水蒸气反应的热化学方程式为C(s)+H 2O(g)=CO(g)+H 2(g) ΔH 3,则ΔH 3为( )A .+131.3 kJ·mol -1B .-131.3 kJ·mol -1C .+352.3 kJ·mol -1D .-352.3 kJ·mol -18.下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K 时的稳定状态)。
下列选项中不正确的是( )A .Mg 与F 2反应的ΔS <0B .MgF 2(s)+Br 2(l)=MgBr 2(s)+F 2(g) ΔH =+600 kJ·mol -1 C .MgBr 2与Cl 2反应的ΔH <0D .化合物的热稳定性顺序:MgI 2>MgBr 2>MgCl 2>MgF 29.在一定条件下,S 8(s)和O 2(g)发生反应依次转化为SO 2(g)和SO 3(g)。
反应过程和能量关系可用如图简单表示(图中的ΔH 表示生成1 mol 含硫产物的数据)。
由图得出的结论正确的是( )A .S 8(s)的燃烧热ΔH =-8(a +b ) kJ·mol -1 B .2SO 3(g)2SO 2(g)+O 2(g) ΔH =-2b kJ·mol -1 C .S 8(s)+8O 2(g)=8SO 2(g) ΔH =-a kJ·mol -1D .由1 mol S 8(s)生成SO 3的反应热ΔH =-(a +b ) kJ·mol -110.已知:CH 3OH(g)+32O 2(g)=CO 2(g)+2H 2O(g) ΔH =-a kJ·mol -1 CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(g) ΔH =-b kJ·mol -1 CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l) ΔH =-c kJ·mol -1 则下列叙述正确的是( )A .由上述热化学方程式可知b >cB .甲烷的燃烧热为b kJ·mol -1 C .2CH 3OH(g)=2CH 4(g)+O 2(g) ΔH =2(b -a )kJ·mol -1D .甲醇和甲烷物质的量之比为1∶2的混合物完全燃烧生成CO 2和H 2O(l)时,放出的热量为Q kJ ,则该混合物中甲醇的物质的量为Q a +2bmol 11.保护环境已成为当前和未来的一项全球性重大课题。
为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃烧循环使用的构想,如下图所示:过程Ⅰ可用如下反应表示:①2CO 2=====光能2CO +O 2 ②2H 2O=====光能2H 2↑+O 2↑③2N 2+6H 2O=====光能4NH 3+3O 2 ④2CO 2+4H 2O ――→光能2CH 3OH +3O 2⑤2CO +4H 2O ――→光能________+3O 2请回答下列问题:⑴过程Ⅰ的能量转化形式为________能转化为________能。
⑵请完成第⑤个反应的化学方程式:________________________________________。
⑶上述转化过程中,ΔH 1和ΔH 2的关系是______________________________________。
⑷断裂1 mol 不同化学键所需的能量见下表:常温下,N 2与H 2O 反应生成NH 3的热化学方程式为___________________________。
12.⑴已知:①TiO 2(s)+2Cl 2(g)=TiCl 4(l)+O 2(g) ΔH =+140 kJ·mol -1 ②2C(s)+O 2(g)=2CO(g) ΔH =-221 kJ·mol -1 写出TiO 2和焦炭、Cl 2反应生成液态TiCl 4和CO 气体的热化学方程式:________________________________________________________________________。
⑵有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是A .CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g) ΔH =+49.0 kJ·mol -1B .CH 3OH(g)+32O 2(g)=CO 2(g)+2H 2O(g) ΔH =-676.7 kJ·mol -1 由上述方程式可知,1 mol CH 3OH 完全燃烧生成H 2O(l)时放出的热量________(填“大于”“等于”“小于”或“不能确定”)676.7 kJ 。
已知水的汽化热为 44 kJ·mol -1,则表示H 2燃烧热的热化学方程式为________________________________。
13.氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产和生活中有着重要作用。
Ⅰ.1 mol NO 2(g)和1 mol CO(g)反应生成1 molCO 2(g)和1 mol NO(g)过程中的能量变化如图所示:请写出该反应的热化学方程式:。
Ⅱ.在容积恒定的密闭容器中,进行如下反应:N 2(g)+3H 2(g)2NH 3(g) ΔH <0,其平衡常数K 与温度T 的关系如表所示:请回答下列问题:⑴试判断K 1________K 2(填“>”“<”或“=”)。
⑵NH 3(g)燃烧的方程式为4NH 3(g)+7O 2(g)=4NO 2(g)+6H 2O(l),已知:①2H 2(g)+O 2(g)=2H 2O(l) ΔH =-483.6 kJ·mol -1 ②N 2(g)+2O 2(g)=2NO 2(g) ΔH =+67.8 kJ·mol -1 ③N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.0 kJ·mol -1则NH 3(g)的燃烧热为________kJ·mol -1。
14.请参考题中图表,已知E 1=134 kJ·mol -1、E 2=368 kJ·mol -1,根据要求回答下列问题: ⑴图Ⅰ是1 mol NO 2(g)和1 mol CO(g)反应生成CO 2和NO 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E 1的变化是______(填“增大”“减小”或“不变”,下同),ΔH的变化是_____________________________________。
请写出NO 2和CO 反应的热化学方程式:________________________________。
⑵甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下: ①CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g)ΔH =+49.0 kJ ·mol -1②CH 3OH(g)+12O 2(g)=CO 2(g)+2H 2(g)ΔH =-192.9 kJ ·mol -1 又知③H 2O(g)=H 2O(l) ΔH =-44 kJ ·mol -1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________________________________________________________。
⑶下表所示是部分化学键的键能参数:x =________kJ ·mol -1(用含a 、b 、c 、d 的代数式表示)。