(病理生理学)酸碱平衡计算
- 格式:ppt
- 大小:226.50 KB
- 文档页数:3



化学反应的酸碱平衡常数化学反应中,酸碱平衡是一种重要的化学性质。
酸碱平衡常数(Ka或Kb)是用于描述酸碱反应中酸碱物质平衡的指标。
本文将介绍酸碱平衡常数的概念、计算方法以及其在化学反应中的应用。
1. 酸碱平衡常数的概念酸碱平衡常数是反映酸碱解离或结合能力的一个指标,用于描述反应中酸碱物质的平衡程度。
酸碱平衡常数通常用Ka表示酸的解离常数,用Kb表示碱的解离常数。
2. 酸碱平衡常数的计算方法对于酸碱反应中的酸,酸的解离常数Ka可以通过以下公式计算:Ka = [H3O+][A-] / [HA]其中,[H3O+]表示酸溶液中的氢离子浓度,[A-]表示酸的阴离子浓度,[HA]表示未解离的酸的浓度。
对于酸碱反应中的碱,碱的解离常数Kb可以通过以下公式计算:Kb = [OH-][B+] / [BOH]其中,[OH-]表示碱溶液中的氢氧根离子浓度,[B+]表示碱的阳离子浓度,[BOH]表示未解离的碱的浓度。
3. 酸碱平衡常数的意义和应用酸碱平衡常数描述了酸碱反应中物质的解离或结合程度,对于理解和预测反应的平衡性具有重要意义。
酸碱平衡常数可用于计算酸碱溶液的pH值,了解溶液的酸碱性质。
在化学实验和工业生产中,酸碱平衡常数的应用广泛。
例如,在酸碱滴定分析中,可以通过测定滴定终点时溶液中指示剂的颜色变化来确定溶液的酸碱平衡常数,从而计算出待测物质的浓度。
此外,酸碱平衡常数还可用于控制和调节反应条件。
例如,在酸碱催化剂反应中,可以通过调节催化剂的酸碱平衡常数来控制反应的速率和选择性。
4. 酸碱平衡常数的影响因素酸碱平衡常数受到温度、溶液浓度和离子强度等因素的影响。
温度升高会导致酸碱平衡常数的变化,而溶液浓度和离子强度的变化也会对酸碱平衡常数产生影响。
总结:酸碱平衡常数是描述化学反应中酸碱平衡的重要指标。
通过计算酸碱平衡常数,可以深入理解酸碱反应的平衡性质,并在实验和工业生产中应用酸碱平衡常数来分析、控制和调节反应条件。


酸碱平衡和pH值的计算和测定酸碱平衡是指液体或物质中酸性和碱性物质的平衡状态。
pH值是用来表示溶液酸碱性强弱程度的指标,它是负对数单位,用于衡量溶液中溶解的氢离子(H+)的浓度。
本文将介绍酸碱平衡的基本原理、pH值的计算公式以及测定方法。
一、酸碱平衡的基本原理酸碱平衡是化学中重要的概念,涉及到溶液中的离子浓度和化学反应。
在酸碱反应中,酸会失去氢离子,碱会失去氢氧根离子(OH-),形成水分子。
酸性溶液中,氢离子浓度高,碱性溶液中,氢氧根离子浓度高,而在中性溶液中,两者浓度相等。
酸碱反应可以使用化学方程式来表示,例如:酸 + 碱→ 盐 + 水其中,酸和碱发生中和反应,生成盐和水。
二、pH值的计算公式pH值用来表示溶液中的酸碱性强弱程度,其计算公式为:pH = -log[H+]其中[H+]代表溶液中的氢离子浓度。
计算pH值的步骤如下:1. 测量溶液的氢离子浓度[H+]。
2. 使用上述公式计算pH值。
三、pH值的测定方法1. pH试纸方法:将pH试纸浸入待测溶液中,根据试纸变色与标准色卡进行比较,可判断溶液的酸碱性。
2. pH计方法:使用pH计测量溶液中的氢离子浓度,然后使用上述公式计算pH值。
3. 酸碱指示剂方法:向待测溶液中加入少量酸碱指示剂,根据指示剂的颜色变化将溶液的酸碱性定性为酸性、碱性或中性。
四、酸碱平衡与人体健康酸碱平衡对于人体健康至关重要。
人体内的许多生理过程需要维持特定的酸碱平衡。
健康的酸碱平衡有助于维持正常的代谢功能,在饮食和生活中保持合适的酸碱平衡对身体健康至关重要。
饮食中的酸性食物和碱性食物可以影响人体内的酸碱平衡。
酸性食物如肉类、糖、咖啡等可以增加体内酸性物质的含量,而碱性食物如水果、蔬菜等可以帮助体内维持平衡。
结论酸碱平衡和pH值的计算和测定是化学中重要的知识点。
通过计算溶液的pH值,我们可以了解其酸碱性质。
酸碱平衡对于人体健康至关重要,我们应该注意饮食和生活方式,保持良好的酸碱平衡。


酸碱平衡及其PH值计算酸碱平衡是指维持体液、细胞内外环境的pH值在一定范围内的生理过程。
pH是衡量酸碱程度的指标,表示溶液中氢离子(H+)的浓度。
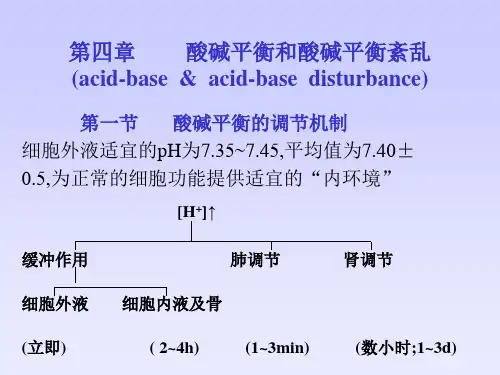
在生理环境中,人体液体的pH值一般在7.35-7.45之间,过高或过低都会对人体健康产生不良影响。
酸碱平衡调节机制主要包括呼吸调节和肾脏调节两种。
呼吸调节是通过调节血液中二氧化碳(CO2)的含量,控制碳酸氢盐(H2CO3)的浓度,进而影响pH值。
肾脏调节是通过排除酸性物质、吸收碱性物质,调节氢、氯离子(H+、Cl-)以及碳酸根离子(HCO3-)的浓度,从而维持酸碱平衡。
计算pH值可以根据酸碱溶液中反应物浓度的变化,应用酸碱反应方程或者Henderson-Hasselbalch方程来推算。
对于酸碱反应方程的计算,以强酸HCl(氯化氢)在水中的溶解为例:HCl(aq)+ H2O(l)→ H3O+(aq)+ Cl-(aq)在这个反应中,HCl完全离解,所以HCl的浓度等于H3O+的浓度。
根据质量浓度和容积(L)的定义,可以得到:[H3O+]=C(HCl)/V(溶液的体积)根据Henderson-Hasselbalch方程,可计算酸碱溶液的pH值。
该方程表示弱酸和弱碱的共轭体系的pH值与它们的浓度之间的关系:pH = pKa + log ([A-]/[HA])其中,pKa是酸性质(HA)溶液的负对数酸解离常数,[HA]和[A-]分别表示酸(HA)和共轭碱(A-)的浓度。
例如,乙酸(AcOH)和乙酸钠(NaAc)是一个共轭体系。
若已知乙酸和乙酸钠的浓度,可以计算pH值。
乙酸的pKa为4.76,那么:pH = 4.76 + log ([NaAc]/[AcOH])以上是酸碱平衡及其pH值计算的简单介绍。
酸碱平衡是人体内部稳态的基础,任何导致pH值偏离正常范围的因素都可能对人体健康产生不利影响。
因此,了解酸碱平衡的机制和计算pH值的方法对于维持身体健康至关重要。

第九版病理生理学第四章酸碱平衡和酸碱平衡紊乱考点剖析内容提要:笔者以王建枝主编的病理生理学第九版教材为蓝本,结合40余年的病理生理学教学经验,编写了第九版病理生理学各章必考的考点剖析,共二十章。
本章为第四章酸碱平衡和酸碱平衡紊乱。
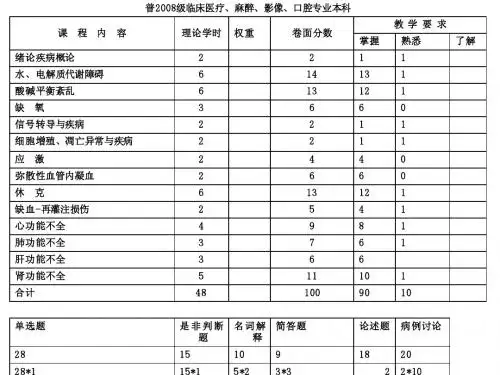
本章考点剖析有重点难点、名词解释(13)、简述题(10)、填空题(3)及单项选择题(22)。
适用于本科及高职高专临床、口腔、医学、高护、助产等专业等学生学习病理生理学使用,也适用于临床执业医师、执业助理医师考试人员及研究生考试人员使用。
目录第四章酸碱平衡和酸碱平衡紊乱第一节酸碱的概念及酸碱物质的来源第二节酸碱平衡的调节第三节酸碱平衡紊乱的类型及常用指标第四节单纯型酸碱平衡紊乱第五节混合型酸碱平衡紊乱第六节判断酸碱平衡紊乱的方法及其病理生理基础重点难点掌握:酸碱平衡紊乱的类型及常用指标、单纯型酸碱平衡紊乱的类型、概念及特征。
熟悉:酸碱的概念及酸碱物质的来源、酸碱平衡的调节。
了解:判断酸碱平衡紊乱的方法及其病理生理基础。
一、名词解释(13)1、酸碱平衡紊乱:是指在病理情况下,由于酸碱过多、不足或者酸碱平衡调节功能障碍,使体液酸碱度的相对稳定状态发生改变,称为酸碱平衡紊乱。
2、血pH:是血浆H+浓度的负对数,是直接反映血液酸碱度的指标,其大小取决于[HCO-3]/[H2CO3]的比值,比值越大,pH值也越大。
正常人[HCO-3]/[H2CO3]的比值约为20/1,此时血pH为7.4。
3、动脉血CO2分压:是血浆中物理溶解的CO2分子所产生的张力,其大小可反映血浆中H2CO3的量。
正常值为33 mmHg~46mmHg(4.39 kPa~6.25kPa)。
4、标准碳酸氢盐:是指全血标本在标准条件下(38℃、血氧饱和度为100%、PaCO2为40mmHg)所测得的血浆HCO-3的含量。
正常值为22mmol/L~27mmol/L。
5、实际碳酸氢盐:是指隔绝空气的血液标本在实际的PaCO2和血氧饱和度条件下所测得的血浆H2CO3的含量。

化学平衡中的酸碱平衡常数在化学平衡中,酸碱平衡常数扮演着至关重要的角色。
酸碱平衡常数是描述酸碱反应进行程度的一个定量指标,可以帮助我们了解反应的平衡位置和反应的强弱。
本文将介绍酸碱平衡常数的定义、计算方法以及影响平衡常数的因素。
一、酸碱平衡常数的定义在反应A + B ↔ C + D中,反应的酸碱平衡常数(Kc)定义为平衡态下反应物浓度的乘积与生成物浓度的乘积之比。
Kc = [C]c[D]d / [A]a[B]b其中,[A]、[B]、[C]和[D]分别表示反应物A、B和生成物C、D的浓度,a、b、c和d为反应物和生成物的系数。
二、酸碱平衡常数的计算方法通常情况下,平衡常数的计算需要利用已知浓度的数据和反应方程式。
以下将通过一个实例来演示平衡常数的计算方法。
假设有一个酸碱反应的平衡方程式:2HCl(aq) + Ca(OH)2(aq) ↔ CaCl2(aq) + 2H2O(l)步骤一:将已知浓度代入平衡常数的定义式中,得到Kc的表达式。
Kc = [CaCl2] × [H2O]^2 / [HCl]^2 × [Ca(OH)2]步骤二:根据实验条件,测定反应物和生成物的浓度值。
假设[HCl] = 0.1 M、[Ca(OH)2] = 0.2 M、[CaCl2] = 0.05 M,代入上述表达式中,即可求得Kc的数值。
三、影响酸碱平衡常数的因素1. 温度:酸碱平衡常数与温度密切相关。
一般来说,增加温度会使平衡常数增大,反应更偏向生成物的一方。
而降低温度则会使平衡常数变小,反应更偏向反应物的一方。
2. 压力:对于气相反应,在特定温度下,增加压力会导致平衡常数增大,而减小压力则会导致平衡常数减小。
但对于溶液中的酸碱反应,压力的变化对平衡常数没有显著影响。
3. 浓度:在溶液中,改变反应物浓度会影响平衡常数。
根据平衡常数的定义式可知,增加某个反应物的浓度会使平衡常数减小,反之亦然。
4. 催化剂:催化剂可以加速反应速率,但不会对平衡常数产生影响。