专题五金属和金属材料
- 格式:doc
- 大小:233.00 KB
- 文档页数:4

2023年中考化学人教版专题练习--金属和金属材料一、单选题1.下列有关金属的说法中正确的是()A.金属在自然界中都以单质形式存在B.地壳中含量最高的金属元素是铁元素C.武德合金熔点高,常用作保险丝D.黄铜(锌铜合金)比纯铜的硬度大2.下列实验方案中,设计合理的是A.实验室制取纯净的CO2:将木炭在纯O2中燃烧B.除去CuO中少量的C粉:将混合物隔绝空气高温加热C.鉴别H2O和H2O2溶液:取样,分别加入少量MnO2观察现象D.验证Cu比Ag金属活泼性强:将形状、大小完全相同的Cu丝和Ag丝同时放入稀盐酸中3.我国载人航天工程使用了液氢、煤油、新型镁铝合金等物质。
下列说法错误的是A.液氢和煤油都属于可再生能源B.可通过石油加热炼制得到煤油C.可用锌和稀硫酸反应制取氢气D.镁铝合金的硬度比镁、铝的大4.制取与贮存氢气是氢能源利用领域的研究热点。
如图是制取与储存氢气的一种方法,下列说法不正确的是(已知:MgH+2HCl=MgCl+2H )222A.图中涉及的反应类型只有分解反应B.反应Ⅲ中氩气(Ar)作保护气,防止合金被氧化C.理论上,每产生32gO2,需向体系中再补充1446gZnFe2O4D.11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为0.7g5.认识物质及其变化是化学研究的重点,下列变化体现的是化学变化的是A.干冰升华B.铁的生锈C.活性炭吸附色素D.石油分馏6.某兴趣小组在研究Zn﹣Cu合金、Zn﹣Fe合金、Fe﹣Al合金、Fe﹣Cu合金时,发现其中一种合金9g与足量稀盐酸充分反应产生了0.4g气体,该合金可能是()A.Zn﹣Cu合金B.Zn﹣Fe 合金C.Fe﹣Al合金D.Fe﹣Cu合金7.金属是人类重要的生产资源,下列属于物理变化的是A.钢管表面刷油漆B.湿法炼铜C.钢铁生锈D.铜表面产生铜绿8.下列实验装置不能达到相应实验目的的是A.测定空气中氧气含量B.探究水的组成C.验证质量守恒定律D.验证活动性顺序:铁>铜>银9.一次性口罩的鼻梁条通常由铝或铁块压制而成。



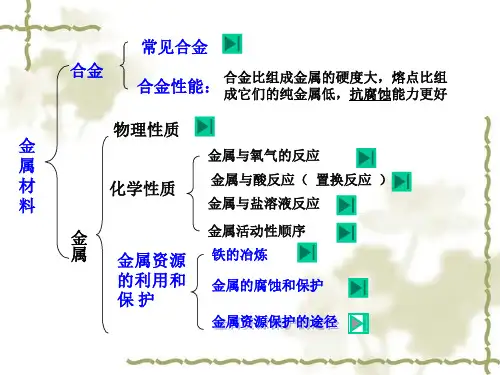
第八单元金属和金属材料考点1金属材料1.金属材料包括纯金属和合金两类。
金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。
2.金属制品是由金属材料制成的,铁、铜、铝及其合金是人类使用最多的金属材料。
考点2金属材料的发展史根据历史的学习,我们可以知道金属材料的发展过程。
商朝,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢;铜和铁一直是人类广泛应用的金属材料。
在100多年前,又开始了铝的使用,因铝具有密度小和抗腐蚀等许多优良性能,铝的产量已超过了铜,位于第二位。
考点3金属的物理性质1.共性:大多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、导热性,在室温下除汞为液体,其余金属均为固体。
2.一些金属的特性:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色;常温下大多数金属都是固体,汞却是液体;各种金属的导电性、导热性、密度、熔点、硬度等差异较大;银的导电性和导热性最好,锇的密度最大,锂的密度最小,钨的熔点最高,汞的熔点最低,铬的硬度最大。
考点4物质的性质与物质的用途之间的关系1.物质的性质决定物质的用途,而物质的用途又反映出物质的性质。
2.物质的性质很大程度上决定了物质的用途。
但这不是唯一的决定因素,在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环紧的影响等多种因素。
考点5合金1.合金:在金属中加热熔合某些金属和非金属,形成具有金属特性的物质。
注意:(1)合金是金属与金属或金属与非金属的混合物。
(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。
(3)日常使用的金属材料,大多数为合金。
(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。
2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。
3.合金与组成它们的纯金属性质比较。


2023年中考化学人教版专题训练--金属和金属材料一、单选题1.下列有关金属铁、铝及其化合物的叙述正确的是A.地壳中铁的含量比铝多B.铁和铝都能形成致密的保护膜C.生铁是合金,硬铝不是合金D.铁易锈蚀,在钢管表面镀锌可以防止腐蚀2.用镍钛合金制成的宇宙飞船自展天线,在低温下被折叠,进入太空后,在阳光照射下可重新展开,恢复成原状。
关于此天线制作材料的描述错误的是A.具有形状记忆功能B.具有良好的导电性C.具有良好的延展性D.具有很低的熔点3.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。
关于该滤渣和滤液有下列四种说法:① 向滤渣中加入稀盐酸,一定有气泡产生。
① 向滤液中加入稀盐酸,一定有沉淀产生。
① 滤渣中一定含有Ag。
① 滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3以上说法正确的个数为A.0个B.1个C.2个D.3个4.下列实验方案不能达到目的的是选项实验目的实验方案A区分白酒和白醋闻气味,通过气味区分B区分黄铜和纯铜相互刻画,通过划痕区分C区分铜粉和铁粉分别滴加稀盐酸,通过是否有气泡区分D区分碳粉和MnO2观察,通过颜色区分A.A B.B C.C D.D5.制取与贮存氢气是氢能源利用领域的研究热点。
如图是制取与储存氢气的一种方法,下列说法不正确的是(已知:MgH+2HCl=MgCl+2H )222A .图中涉及的反应类型只有分解反应B .反应①中氩气(Ar)作保护气,防止合金被氧化C .理论上,每产生32gO 2,需向体系中再补充1446gZnFe 2O 4D .11.2gMg 2Cu 完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为0.7g6.下列关于金属材料的说法正确的是( )A .金属的性质是决定其用途的唯一因素B .导电、导热性最好的金属是AuC .合金相对于纯金属,其硬度更大、熔点更高D .生铁和钢都是铁的合金,其中生铁含碳量比钢高7.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:2C+NiO 高温2Ni+CO ,下列说法错误的是A .反应中NiO 发生还原反应B .气体产物中可能有COC .该不锈钢中还含有铁和碳D .该不锈钢合金的硬度小于纯铁8.“十四五”规划提出:推动绿色发展,促进人与自然和谐共生。

专题五金属材料,金属资源的利用和保护命题点1金属材料、金属的物理性质与用途1. (2020南京)下列金属中,熔点最高的是()A. 铜B. 汞C. 钨D. 铝2. (2020河南)金属材料在生产、生活中使用广泛。
下列金属的用途利用了金属导电性的是()A. 铜制电线B. 铁制铁锅C. 金制项链D. 铝制饮料罐3. (2020南京)下列物质中,常温下呈黄色的是()A. 金B. 铁C. 碘D. 硫酸铜晶体4. (2020山西)东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。
其制作材料属于()第4题图A. 合成材料B. 天然材料C. 金属材料D. 复合材料5. (2020成都)下列成都出土的文物中,不属于金属材料的是()6. (2020益阳)国产飞机C919机壳采用了先进的铝锂合金材料。
下列有关说法错误的是()A. 铝锂合金密度小B. 铝锂合金的硬度比纯铝大C. 铝锂合金抗腐蚀性强D. 铝锂合金是合成材料7. (2020临沂改编)下列与金属材料有关的说法中,正确的是()A. 常温下所有的金属都是固体B. 钢是纯净物,生铁是混合物C. 钛合金可用来制造人造骨D. 银的导电性好,大多数电线都是用银作材料8. (2020株洲改编)青少年一定要爱护自己的眼睛,在光线不足时看书、写字要用照明工具。
如图是一种照明用台灯。
第8题图(1)如图所示的各部件中,由金属材料制成的是________________________。
(2)灯管后面的反光片为铝箔,铝块能形成铝箔是利用铝的_______性。
(3)废弃的电器需分类回收,请简述废旧金属回收的意义是____________。
9. 铝是地壳中含量最多的金属元素,铝的化合物种类繁多,氧化铝的熔点(2050 ℃)高于铝的熔点(660 ℃)。
硬铝(含铝、铜、镁、硅)是用途广泛的铝合金。
结合课本知识回答下列问题。
(1)硬铝片和纯铝片相互刻画,划痕较深的是________,硬铝含有的非金属元素是________。



人教版化学九年级第九单元金属和金属材料知识点归纳总结课题1:金属材料一、金属材料的发展与利用1、从化学成分上划分,材料可以分为金属材料、非金属材料、有机材料及复合材料等四大类。
2、金属材料包括纯金属和合金。
(1)金属材料的发展石器时代→青铜器时代→铁器时代→铝的应用→高分子时代(2)金属材料的应用①最早应用的金属是铜,应用最广泛的金属是铁,公元一世纪最主要的金属是铁②现在世界上产量最大的金属依次为铁、铝和铜③钛被称为21世纪重要的金属二、金属的物理性质1、金属共同的物理性质:常温下金属都是固体(汞除外),有金属光泽,大多数金属是电和热的良导体,有延展性,密度较大,熔沸点较高等。
2、金属的特性:①纯铁、铝等大多数金属都呈银白色,而铜呈紫红色,金呈黄色;②常温下,大多数金属都是固体,汞却是液体;③各种金属的导电性、导热性、密度、熔点、硬度等差异较大。
3、金属之最地壳中含量最多的金属元素—铝(Al)人体中含量最多的金属元素—钙(Ca)导电、导热性最好的金属——银(Ag)目前世界年产量最高的金属—铁(Fe ) 延展性最好的金属———金(Au ) 熔点最高的金属————钨(W ) 熔点最低的金属————汞(Hg ) 硬度最大的金属————铬(Cr ) 密度最小的金属————锂(Li ) 密度最大的金属————锇(Os ) 最贵的金属———— 锎k āi (Cf )4、金属的用途:金属在生活、生产中有着非常广泛的应用,不同的用途需要选择不同的金属。
【练习】(1)为什么菜刀、镰刀、锤子等用铁制而不用铅制?答:因为铁的硬度比铅大,且铅有毒。
(2)银的导电性比铜好,为什么电线一般用铜制而不用银制?答:银和铜的导电性相近,但银比铜贵得多,且电线用量大,经济上不划算。
(3)为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?答:因为钨的熔点(3410℃)高,而锡的熔点(232℃)太低。
如果用锡制的话,通电时锡易熔断,减少灯泡的使用寿命,还会造成极大浪费。
湛江市2009年高中阶段学校招生考试化学科总复习
专题五:金属和金属材料
班级:姓名:学号:成绩:
可能用到的相对原子质量:H-1 O-16 C-12 S-32 Mg-24 Ca-40 Al-27 Zn-65 Cu-64 Fe-56
一、单项选择题(本题包括15小题,每小题3分,共45分。
每小题只有一个选项符合题意)
1. (2008年苏州市)关于金属物品的使用正确的是( )
A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨
B.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波尔多液
C.铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡
D.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
2.(2008年贵港市)下列说法正确的是( )
A.铁在潮湿的空气中容易生锈
B.金属的活动性:Zn>Ag>Cu
C.合金属于纯净物
D.铝是地壳中含量最多的元素
3.(2008年临沂市)质量相同的下列金属,分别加入到足量的稀盐酸中充分反应,放出氢气最多的是( )
A.Mg
B.Al
C.Cu
D.Zn
4. (2008年攀枝花市) X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种
金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验)。
这四种金属的活动性顺序为( )
D.Y>W>Z>X
5. (2008年三明市)将洁净的铁丝浸入含有Ag(NO3)2和Zn(NO3)2和电镀废水中,一段时间后取出,铁
丝表面覆盖了一层物质,这层物质是( )
A.Ag、Zn
B.Ag
C.Zn
D.Ag、Fe
6. (2008年宜昌市)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后过滤。
以下判
断错误的是( )
A.滤纸上可能含有铜
B.滤液中可能含有硫酸铁
C.滤液中可能含有硫酸铜
D.滤纸上可能含有氧化铜
7.(2008年南通市)若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A.Mn + H2SO4 = MnSO4 + H2↑
B.Mg + MnSO4 = MgSO4 + Mn
C.Fe + MnSO4 = FeSO4 + Mn
D.Mn + CuSO4 = MnSO4 + Cu
8.下列物质能由金属与酸溶液直接反应制得的是( )
A.CuSO4
B.AgCl
C.FeCl3
D.Al2(SO4)3
9. (07河北)下列做法符合科学常识的是( )
A.电路中的保险丝熔断后,换用了更粗的保险丝
B.向燃着的酒精灯中添加酒精
C.用燃着的木条检验石油液化气是否泄漏
D.油罐车的尾部装有一条拖在地面上的铁链
10. (07山东)图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是( )
A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀
B.根据金属的熔点数据表,判断金属的导电性强弱
C.根据溶解度曲线图,选择从溶液中获得晶体的方法
D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量
11.(07济宁)等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确生产氢气质量与反应时间之间关系的是( )
13、有A、B两块等质量的铁,将A浸入稀硫酸中,同时将B浸入硫酸铜溶液中,过一会儿,同时取出晾干,两块铁的质量m A、m B应该是( )
A.m A<m B
B.m A>m B
C.m A=m B
D.m A≥m B
14.下列的有关规律的描述中正确的是( )
A、同种元素组成的物质性质一定相同
B、金属与酸反应后溶液的质量一定增加
C、含有碳元素的化合物一定是有机物
D、金属钾能与所有金属的盐溶液发生置换反应
15. (2008年山东省)向一定量的铁粉中逐滴加入稀硫酸至过量,下图是反应过程
中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示( )
A.消耗铁粉的质量
B.生成硫酸亚铁的质量
C.溶液的总质量D生成氢气的质量
二、填空与简答题(本题包括6小题,共47分。
)
16. (07汕头)(9分)人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
请回答:
(1)地壳中含量最多的金属元素是。
(2)根据下图的应用实例,试说出金属具有的两点物理性质: 、。
(3)人类每年从自然界提取大量的金属,其中提取量最大的是铁。
用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为。
(4)北京奥运会用到多种材料。
下列应用中使用金属材料的有(填序号) (2分)。
①使用金、银和铜等制作奖牌②使用纯羊毛和聚酯纤维制作“福娃,,
③使用新型钢材建造“鸟巢”④使用聚氟乙烯制造“水立方”外层膜
(5)金属矿物的储量有限,而且不能再生,所以保护金属资源尤为重要。
答出两条保护金属资源的有效
途径是、。
17. (07烟台)(6分)下图是同学们经常使用的铅笔示意图。
(1)在组成铅笔的各种材料中,能导电的是,含有有机物的是,燃烧时产物中有二氧化碳的是。
(每空只要求填一种,填序号)
(2)上图中④的主要成分是金属铝。
将一小片该金属放入稀盐酸中,观察到的现象是
,反应的化学方程式是。
18. (07重庆)(10分)每到冬天,市场上便有一种“热宝”出售,它是一个装有化学药品的小袋。
使用时,撕去它的保护膜贴在身体上,不久便会产生热量。
已知小袋中装有铁粉、碳粉和少量氯化钠。
(1)取小袋内物质,加入稀硫酸中,发生反应的化学方程式为:
(2)将袋内物质放在足量O2中燃烧,写出反应的化学方程式:
①
②
(3)将袋内物质加入一定量的CuSO4溶液中,充分反应后过滤,滤液中的溶质一定有
(填写化学式,2分),发生反应的化学方程式为:。
19.(2008年晋江市)(7分)兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R
做如下探究:
(1)将金属R投入稀盐酸中,金属表面有气泡冒出。
则该金属R在金属活动性顺序表中排在氢的
(选填“前面”或“后面”)。
(2)为了比较金属R与铁的活动性强弱,兴趣小组设计下列方案进行实验,请完成下表:
(3)
20.(2008年汕头) (7分)氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。
以下是印刷线路板的
生产及废液的处理过程:
请回答下列问题:
(1)步骤②中发生了两个反应:2FeCl3+Fe=3FeCl2和
(2)滤渣的成份有、,步骤③中发生反应的化学方程式是
(3)该流程中可以循环、回收利用的物质是:。
21. (8分)工业上以大理石和赤铁矿为主要原料可以制取B和G,其转化关系如右图所示,
已知C是一种能使澄清石灰水变浑浊的气体,D、G的主要成分为单质,E是有还原性的气体。
试回答下列问题:
方程式:。
三、计算题(本题包括1小题,共8分)
22.(08湛江) (8分)钢铁工业是国家工业的基础。
2007年我国粗钢产量接近5亿吨,居世界首位。
湛江
的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。
某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,计算此
钢样粉末中碳的质量分数(保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表
所示:
①计算硫酸溶液中溶质的质量g(保留到0.1)。
②求在实验3中溶液的溶质质量分数(写出详细计算过程,结果保留到0.1%)。