第2章 分散体系
- 格式:ppt
- 大小:1.25 MB
- 文档页数:27

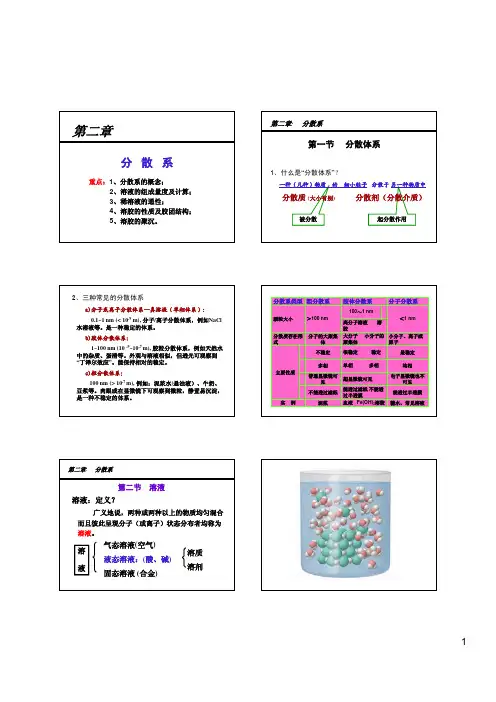







考点二分散系、胶体李仕才1.分散系(1)概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
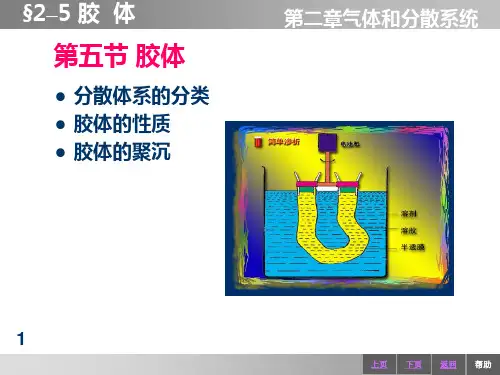
(2)分类:按照分散质粒子的大小(3)按照分散质和分散剂的状态分类烟属于气固分散系;雾属于气液分散系;悬浊液属于液固分散系;合金属于固固分散系。
2.胶体的性质及应用(1)丁达尔效应可见光束通过胶体时,会出现一条光亮的“通路”现象。
应用:鉴别溶液和胶体。
(2)聚沉胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。
使胶体聚沉的方法有:①加入电解质溶液;②加入与胶粒带相反电荷的胶体;③加热。
应用:三角洲的形成;明矾、铁盐溶液净水;盐卤制豆腐。
(3)电泳在电场作用下,胶体粒子在分散剂中作定向移动的现象。
如带正电荷的Fe(OH)3胶体粒子向阴极移动。
应用:工厂静电除尘。
(4)渗析 胶体粒子不能透过半透膜,溶液中的粒子可以透过半透膜。
应用:提纯胶体;血液透析。
3.Fe(OH)3胶体的制备向沸水中逐滴加入饱和FeCl 3溶液,继续煮沸至溶液呈红褐色,停止加热,即制得Fe(OH)3胶体,化学方程式为FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
判断正误(正确的打“√”,错误的打“×”)1.稀豆浆、硅酸、氯化铁溶液均为胶体。
( × )2.明矾溶于水产生Al(OH)3胶体:Al 3++3H 2O===Al(OH)3↓+3H +。
( × )3.丁达尔效应是胶体与溶液的本质区别。
( × )4.含0.1 mol FeCl 3的饱和溶液配制成胶体后,将得到胶体粒子0.1 mol 。
( × )5.FeCl 3溶液和Fe(OH)3胶体都呈红褐色。
( × )6.可用过滤的方法将胶体粒子与分散剂分开。
( × )7.沸水中滴加少量饱和FeCl 3溶液形成带电的胶体,导电能力增强。
( × )8.直径为20 nm 的纳米碳酸钙属于胶体。