2019年第一章分散体系.pps
- 格式:pps
- 大小:1.06 MB
- 文档页数:71









分散体系:分散相物质分散于分散介质中所形成的微不均匀体系胶体分散体系: 高度分散的分散体系,分散相颗粒大小通常为1nm~1μm 粗分散体系:分散相颗粒大小> 1μm 憎液胶体(lyophobic colloids)——溶胶 热力学不稳定亲液胶体(lyophilic colloids)——大分子溶液 缔合胶体(association colloids)——胶束等 热力学稳定数均直径-显微镜法 面均直径-吸附实验 体均直径-密度测量 dA / dn →多分散度数均分子质量-渗透压法 重均分子质量-光散射法 Z 均分子质量-沉降平衡法 Mw /Mn →多分散度胶体纳米粒子的特性表面效应 – 表面原子占大多数量子尺寸效应 - (1)金属费米能级附近的电子能级由准连续能级变为离散能级的现象;(2)半导体出现不连续的价带与导带能级并且二者间能隙变宽的现象。
小尺寸效应 - 随纳米粒子粒径减小,熔点降低,临界超导温度升高、磁有序态向磁无序态转变、等离子共振吸收峰发生移动、声子谱发生改变、构成的纳米块材力学性能改善宏观量子隧道效应、介电限域效应等得到稳定憎液胶体的条件:(1)分散相在介质中的溶解度很小 (2)有稳定剂存在制备方法:分散法:将大块物质分割为胶体粒子——用于制备粗分散体系1 机械研磨2 超声分散法 - 广泛用于制备乳状液3 电分散法 - 用于制备金属溶胶4 胶溶法 - 使新生成的胶体聚沉物重新转化为溶胶凝聚法 使分子或离子凝聚成胶体大小的粒子—用于制备胶体分散体系1 物理法 - 更换溶剂或改变温度使胶体粒子析出2 化学法 - 利用复分解、水解、氧化还原等反应形成不溶化合物 凝聚法制备溶胶原理:胶体粒子的形成分为两个阶段:晶核形成与晶体生长溶胶的纯化:渗析、超过滤单分散胶体的制备:均匀沉淀法 -要求稀溶液和较长反应时间(强制水解、沉淀剂受控释放、金属配合物分解或还原、醇盐水解法) 双注入沉淀法能够迅速合成相对较高浓度的均匀胶体凝胶-溶胶转化法 - 首先形成一个前体凝胶骨架,再以其作为反应介质和反应离子源转化成为致密的胶体粒子。
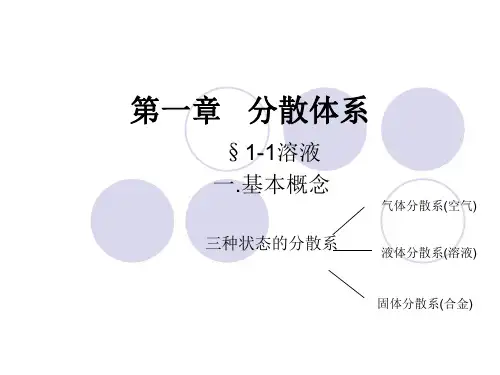
5.1.1分散体系概述•分散体系定义:一种或几种物质被分散在另外一种物质中时所形成的体系称为分散体系。
如:蔗糖水→蔗糖水被分散起分散作用分散质分散剂/分散介质分散体系分散体系分类分散体系分类(按分散质粒子大小)分散质粒子直径(m)分散质分散系类型性质特征<10-9原子、离子或分子分子/离子分散体系均相、热力学稳定10-9~10-6大分子胶体分散体系高分子溶液均相、热力学稳定胶粒(原子或分子的聚集体)胶体非均相、热力学相对稳定>10-6粗颗粒粗分散体系多相、热力学不稳定分散质粒子直径< 1nm(10-9m), 分子/离子分散体系,例如NaCl、CuSO4水溶液等。
是一种稳定的体系。
分子或离子分散体系分散质粒子直径在1~1000 nm (10 -9~10-6 m), 胶体分散体系,例如天然水中的杂质、蛋清等。
外观与溶液相似,但透光可观察到“丁达尔效应”。
能保持相对的稳定。
胶体分散体系分散质粒子直径>1000 nm (10-6 m), 例如:泥浆水(悬浊液)、牛奶、豆浆等。
肉眼或在显微镜下可观察到微粒,静置易沉淀,是一种不稳定的体系。
黄河入海口粗分散体系5.1.2 溶液1)溶液的定义和分类?什么是溶液•凡两种或多种物质混和形成的均匀、稳定的分散体系,叫做溶液。
其中分散质称为溶质,分散剂称为溶剂。
•溶液中,溶质是以分子或离子状态均匀的分散于溶剂之中——属于分散系中的分子分散系。
★特点:均匀、稳定、均相体系5.1.1 分散体系概述溶液的种类溶质溶剂实例气体气体气体液体气体固体液体液体固体液体固体固体空气溶解有二氧化碳的水吸附了氢气的金属钯乙醇的水溶液氯化钠溶的水溶液合金5.1.2 溶液2) 溶解过程与溶液的形成•溶质均匀分散于溶剂中的过程——溶解溶解是个既有化学变化、又有物理变化的复杂过程。
溶解的机理尚不很清楚,只有相似相溶的经验规律。
•常伴随:颜色变化、体积变化、能量变化。
5.1.2 溶液相似相溶原理:结构相似的物质之间容易相互溶解。
无机及化学分析Inorganic & Analytical Chemistry第一章分散体系Dispersed System本章学习要求1、了解分散体系的分类;2、掌握溶液浓度的定义及其相互换算;3、掌握稀溶液的依数性及其计算;4、掌握胶体的特性及胶团结构式的书写;5、掌握溶液的稳定性与凝结。
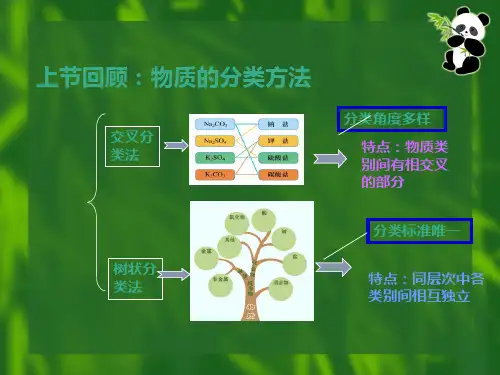
1.1分散系分类1.分散系的定义由一种或几种物质分散在另一种物质中所形成的体系。
分散质(相)(dispersion phase)被分散的物质分散剂(dispersed medium)起分散作用的物质细小水滴 + 空气→云雾 相 在体系内部物理性质和化学性质完全均匀的部分称为相。
分散系在自然界中广为存在: ▼▼ ▼ 金属化合物 + 岩石→ 矿石 二氧化碳 + 水 →汽水2.分散系的分类1) 按物质的聚集状态分类:分散质分散剂实例气气空气、液气云、雾固气烟、尘气液汽水、泡沫液液牛奶、豆浆、固液泥浆、溶液、气固泡沫塑料、馒头液固珍珠、肉冻、固固合金、有色玻璃2) 按分散质粒子直径大小分类:分散系直径/nm实例特征相系溶液<1 蔗糖水食盐水最稳定,不沉降、能透过滤纸单胶体1-100血液AgI 溶胶微浑浊半透明或不浑浊透明,有Tyndal尔现象多粗>100 牛奶泥浆不透明、不稳定不透过滤纸多1.2 溶液1.溶液 (Solutions)物质的量及其单位: 1) 物质的量n : 表示物质基本单元数目多少的物理量。
2) 单位: mol分散质以小分子、离子或原子为质点均 匀地分散在分散剂中所形成的分散系。
V /)B (n )B (c 一升溶液中所含溶质B 的物质的量2. 溶液浓度的表示方法电子及其它粒子的特定组合。
4) 摩尔质量: M B = m B /n B1) 物质的量浓度 c(B) ① 定义: ② 公式: ③ 单位: mol ·dm -3 (mol ·L -1)系统中组成物质的基本组分,可是分子、原子、离子、 3) 基本单元:一千克溶剂中所含溶质B 的物质的量 2) 质量摩尔浓度 b(B)① 定义: ② 公式:③ 单位: mol ·kg -1 与温度无关。
在极稀的水溶液中④.优点: c (B) ≈ b (B)例1. 500克水中溶解17.1克蔗糖, 求蔗糖溶液的质量摩尔浓度。
解: 11.050034210001.17)(1)()(-⋅=⨯⨯==kgmol kg B n B b某组分的物质的量与全部溶液的物质的量之比 。
BA BB B A AA n n n x n n n x +=+=3) 摩尔分数 x i① 定义: ② 公式:③ 量纲: 14) 质量分数ω用溶质的质量除以溶液的质量表 示浓度称为质量分数,用ω表示。
%100)()()(⨯=液m B m B ω① 定义: ② 公式:5)浓度的相互换算例2. 48%的硫酸溶液的密度为1.38g·ml-1,计算此溶液的(1)物质的量浓度;(2)质量摩尔浓度;(3)摩尔分数;解:()()()13)(76.6981038.1%48%-⋅=⨯⨯=⨯⨯⨯=Lmol L V M ml V B c B ρ(1) ()176.638.1/100100098/48-⋅=⨯==Lmol V n B c0.8510.1552/1848/9848/98B A B =-==+=x x x (3) ()1)()(42.910005298/481000-⋅=⨯=⨯=kgmol W n B b A B (2)1.3.稀溶液的依数性(colligative properties)1. 依数性:只与溶质所含粒子的数目有关,而与溶质的本性无关。
(稀溶液的通性)1)蒸气压下降Decrease of vapor pressure2) 沸点升高Boiling point elevation3) 凝固点下降Freezing point lowering4) 渗透压Osmotic pressure2. 溶液的蒸气压下降1)蒸气压vapor pressure当蒸发速率与凝结速率相等时,液体上方的蒸气所具有的压力称为液体的饱和蒸气压(简称蒸气压)。
pp p -=∆*蒸 发凝 聚2) 溶液的蒸气压下降在一定温度下,溶液的蒸 气压总是低于纯溶剂的 蒸气压,称为溶液的蒸 气压下降。
.Decrease of solution vapor pressure溶液蒸气压下降的原因:A.溶液表面溶剂分子数减少;B.形成溶剂化分子;pT0.1mol·kg -1 0.2mol·kg -1纯水3) Raoult (拉乌尔) 定理在一定温度下,稀溶液的蒸气压与溶液中溶剂的摩尔分数成正比.Ax p p ⋅=*1=+B A x x 对于两组分溶液B B x p p x p p ⋅-=-=**)1(*B x p p p p ⋅=-=∆**)(*)()(B b K m n M P P A B A ⋅=⋅⋅=∆∴ Raoult 定律又可表述为:在一定温度下,难挥发非电解质稀溶液的蒸气压下降,近 似地与溶质B 的质量摩尔浓度成正比,而与 溶质的本性无关。
例3.计算293K 时,17.1g 蔗糖溶于1000 g 水中,溶液的蒸汽压下降值。
解:293K 时,P *(H 2O)=2.33kPa4100.9)(-⨯=B x kPax P P B 3*101.2-⨯==∆或 kPa B b K P 3101.2)(-⨯=⋅=∆M(B)=342g.mol -1★ 只适用于难挥发非电解质的稀溶液3. 溶液的沸点升高 boiling point elevationT b p TT b * P 外 1) 沸点boiling point液体的沸点是该液体的蒸气压等于外界大气压时的温度T b 纯水蔗糖K b 为沸点升高常数 Ebullioscopic constant (1).计算溶液的沸点2) 溶液的沸点升高: 3)沸点升高的应用*(B)b b b b T T T K b ∆=-=溶液的沸点与纯溶剂的沸点之差◆ 它只与溶质的质量摩尔浓度成正比, 而与溶质的本性无关。
例4. 在100克水中溶解4.56克尿素, 计算此溶液的沸点.0.76mol/kg 10060.010004.56(B)=⨯⨯=b 解:bb b T T T ∆+=∴*KT b 39.076.0512.0=⨯=∆K39.37339.0373=+=例5.将0.40g葡萄糖溶于20.0g水中,测得溶液的沸点为100.056 ℃,计算葡萄糖的摩尔质量.解:0.40/M葡萄糖20/1000b葡萄糖=T b = 0.056 = K b·b葡萄糖M葡萄糖= 182.9 g·mol-1(2) 测定难挥发非电解质的摩尔质量4. 溶液的凝固点下降 freezing point lowering 1) 凝固点: freezing pointT fT f pT 液体的蒸气压与固体蒸气压相等, 两相平衡共存时 的温度。
* 纯水 蔗糖 冰(1) 溶液的凝固点: (T f )Kf 为凝固点下降常数.Cryoscopic constant T f =T f*- T f = K f·b(B)溶液的蒸气压与固态纯溶剂的蒸气压平衡时的温度。
(2) 溶液的凝固点下降:纯溶剂的凝固点与溶液凝固点之差◆它只与溶质的质量摩尔浓度成正比,而与溶质的本性无关。
2)沸点升高和凝固点下降的原因:溶液的蒸气压下降。
3)凝固点下降的应用:(1) 解释植物的抗旱性与耐寒性等现象;(2) 计算溶液的凝固点;(3) 测定难挥发非电解质的摩尔质量;解: 1000/20/40.0葡萄糖葡萄糖M b =例6. 将0.40g 葡萄糖溶于20.0g 水中,测得溶液的凝固点为-0.207 ℃,计算葡萄糖 的摩尔质量.()K207.0207.00=--=∆f T 20100040.086.1207.0⨯⨯⨯=∴葡萄糖M 1m ol 179.7g -⋅=葡萄糖M思考题:1. 0℃的水溶液中加入一块冰,有何现象?2. 蒸气压下降,沸点升高,凝固点降低均可用来测分子量,哪一何种方法最好?5.溶液的渗透压osmotic pressure1)渗透现象Osmosis溶剂分子通过半透膜进入溶液的自动扩撒过程。
2)渗透平衡在溶液上方施加一外压P, 使半透膜两边溶剂分子进出的速率相等时,体系所处的状态。
3)渗透压为了维持渗透平衡向溶液所施加的最小外压。
4)产生渗透现象的条件①有半透膜的存在;②膜两边的溶液存在浓度差;113113mol K dm 8.314kPa molK m 8.314Pa ----⋅⋅⋅=⋅⋅⋅=R )()(B b B c ≈稀水溶液中RTB b RT B c )()(≈=π5) Van’t Hoff 定律πV = nRTπ = nRT /V = cRT6) 高渗、低渗、等渗溶液植物的细胞7)渗透压的应用①解释动植物的生命现象.②计算高分子化合物的摩尔质量. 例7. 含有5g·L-1某可溶性多糖的水溶液, 在278 K时渗透压为3.24kPa.求该多糖的摩尔质量。
1B 113B1mol 3568g 278K mol K m 8.314Pa L 5g 3.24kPa----⋅=⨯⋅⋅⨯⋅=M M 解:C0.026L mol 101.43567513 =⨯=⋅⨯==∴--B f f B c K t c ∆故渗透压法测大分子的摩尔质量比凝固 下降法更灵敏。
例8. 293K时葡萄糖(C6H12O6)15g溶于200g 水中求该溶液的蒸汽压、沸点、凝固点和渗透压.已知293K时水的 p*=2333.14Pa。
解:b葡萄糖= n葡萄糖/0.2 =0.417 mol·kg-1n葡萄糖= 15/180=0.0833 moln水=200/18.02=11.10 molx葡萄糖=0.0833/(0.0833+11.10)0.0833/11.10=7.4×10-3p = p*x水= p*(1-x葡萄糖)=2333.14(1-7.5×10-3)=2315.90Pa ΔT b = K b·b(B)=0.512×0.417=0.21K T b =373+0.21=373.21KΔT f = K f·b(B)=1.86×0.417=0.78K T f =273-0.78=272.22Kπ= b(B)RT=0.417×8.314×293=1015.8kPa思考题:1 参天的大树,如何从土壤中获得水份?2 施肥过多,植物会烧死?3 淡水鱼游到海水中能活吗?1.4 胶体溶液colloid1.溶胶的基本特征1)溶胶是多相体系.2)分散度高,比表面大. S0 = A / VL=1cm n=1 S=6cm-2L=0.5cm n=8 S=12cm-2L=0.1cm n=1000 S=60cm-2 L=100nm=10-5cm n=1015 S=6·105cm-2L=1nm =10-7cm n=1021 S=6·107cm-2表面粒子比内部粒子的能量高,高出的那部分能量称为表面能。