第八章 主族金属元素
- 格式:ppt
- 大小:2.86 MB
- 文档页数:48
第七章金属元素本章要求1.掌握碱金属、碱土金属的性质、结构、存在状态、制备、用途之间的关系。
2.掌握碱土金属、碱金属氧化物,氢化物的性质以及氢氧化物的溶解度,碱性和盐类溶解度,热稳定性的变化规律。
通过对比锂、镁的相似性等了解对角线规则。
3.了解铝、锡和铅、锑和铋的一般制备方法和原理,认识其单质的主要反应。
掌握铝、锑、铋、锡和铅盐的水解性和溶解性;锡(Ⅱ)的还原性和锡(Ⅳ)氧化性;铋、(Ⅴ)的氧化性。
4.掌握铜锌的氧化物和氢氧化物的酸碱性及主要性质。
掌握过渡元素的结构和性质特点。
5.掌握铜、主要化合物的性质。
掌握锌、主要化合物的性质,掌握Hg(Ⅰ)和Hg(Ⅱ)间的转化关系。
6.掌握铬(Ⅲ)、铬(Ⅵ)化合物的性质。
特别是Cr2O72-与CrO42-间平衡,Cr2O72-在酸性介质中的强氧化性。
掌握高锰酸钾的性质。
7.掌握铁、钴、镍及其化合物的主要性质,熟练掌握Fe2+、Fe3+的性质和鉴定。
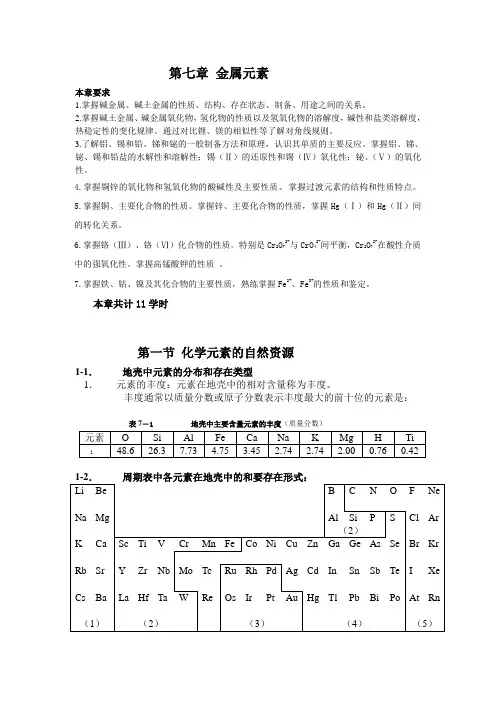
本章共计11学时第一节化学元素的自然资源1-1.地壳中元素的分布和存在类型1.元素的丰度:元素在地壳中的相对含量称为丰度。
丰度通常以质量分数或原子分数表示丰度最大的前十位的元素是:表7―1 地壳中主要含量元素的丰度(质量分数)图7–1 元素在地壳中的主要存在形式(1)以卤化物、含氧酸盐存在(2)以氧化物或含氧酸盐存在(3)主要以单质存在(4)主要以硫化物存在(5)以阴离子形式存在,有些也以单质存在1-3.元素资源的存在形式和提取、利用:1.化学矿物:自然界3000余种,可利用的仅150来种,目前我国已发现的可有矿物有136种。
分为金属矿物和非金属矿物。
2.天然含盐水:包括海水、盐湖水、地下卤水和气井水等。
3.大气:是游离是游离N2,O2和稀有气体的大本营。
4.农副产品:可以用来提取无机物。
5.工业废料:废水、废气和废渣含有大量的可用之物。
第二节碱金属2-1.碱金属元素概述:1.碱金属是周期表的是周期表的IA族,包括锂、钠、钾、铷、铯和钫2.电子层结构:ns13.金属性:同周期元素中,原子半径最大,电力能最低,表现出强烈的金属性。





元素周期表中的主族元素与过渡金属元素元素周期表是化学领域里最重要的工具之一,用于分类和组织已知的化学元素。
它根据元素的原子数和电子排布等特征将元素分为不同的类别。
其中,主族元素和过渡金属元素是两个重要的类别。
本文将对这两类元素进行详细介绍,并探讨它们的性质和应用。
一、主族元素主族元素又称为主族化学家族,包括了元素周期表中1A、2A、3A、4A、5A、6A和7A族的元素。
这些元素具有相似的化学性质,主要是由于它们拥有相似的电子排布。
1.1 原子结构和电子排布主族元素的原子结构和电子排布有一些共同特点。
它们的原子核周围的电子层分别填充有相同数量的电子。
例如,1A族的元素(氢、锂、钠等)具有一个电子在最外层(K层);2A族的元素(铍、镁、钙等)具有两个电子在最外层(L层);以此类推。
1.2 化学性质和应用主族元素的化学性质与其电子排布密切相关。
由于它们外层电子数量相对较少,主族元素通常表现出较低的电负性,并倾向于失去或共享电子,以达到稳定的电子结构。
主族元素在生活中有着广泛的应用。
例如,氧(O)是生命所必需的元素,广泛存在于空气和水中;氢(H)在燃料电池中被用作清洁能源;氯(Cl)和钠(Na)被用于制备食盐等。
此外,主族元素还在药品、化妆品、农药和材料科学等领域得到了广泛应用。
二、过渡金属元素过渡金属元素是元素周期表中位于3B至2B族的元素,它们的特点是较为复杂的电子排布和多样的化学性质。
2.1 原子结构和电子排布过渡金属元素的原子结构较复杂,其电子填充在d轨道中。
这些轨道能容纳不同数量的电子,因此过渡金属元素可以具有不同的氧化态,从而展现出多样的化学性质。
2.2 化学性质和应用过渡金属元素具有许多特殊的化学性质,例如良好的导电性、热稳定性和反应活性等。
这些性质使得过渡金属元素被广泛应用于许多领域。
过渡金属元素常用于催化剂的制备。
钯(Pd)和铂(Pt)等过渡金属催化剂在化学反应中具有高效率和选择性,广泛应用于化学工业和环境保护等领域。

一、实验目的1. 了解主族金属的基本性质,包括物理性质和化学性质。
2. 探究主族金属与酸、碱、盐溶液的反应规律。
3. 分析主族金属在化学反应中的行为特点。
二、实验原理主族金属是指元素周期表中s区和p区的金属元素。
它们具有相似的电子层结构,化学性质具有相似性。
本实验通过观察主族金属与酸、碱、盐溶液的反应,分析其性质,并总结出规律。
三、实验用品1. 金属:钠、钾、钙、镁、铝等主族金属。
2. 溶液:盐酸、硫酸、氢氧化钠、氢氧化钙、硫酸铜等。
3. 仪器:试管、烧杯、酒精灯、镊子、玻璃棒等。
四、实验步骤1. 物理性质观察将钠、钾、钙、镁、铝等主族金属分别放在试管中,观察其颜色、硬度、密度、熔点等物理性质。
2. 与酸反应(1)取一定量的盐酸溶液于试管中,将钠、钾、钙、镁、铝等主族金属分别加入试管中,观察反应现象。
(2)观察反应过程中气体产生速度、颜色变化等,记录实验数据。
3. 与碱反应(1)取一定量的氢氧化钠溶液于试管中,将钠、钾、钙、镁、铝等主族金属分别加入试管中,观察反应现象。
(2)观察反应过程中气体产生速度、颜色变化等,记录实验数据。
4. 与盐溶液反应(1)取一定量的硫酸铜溶液于试管中,将钠、钾、钙、镁、铝等主族金属分别加入试管中,观察反应现象。
(2)观察反应过程中气体产生速度、颜色变化等,记录实验数据。
五、实验结果与分析1. 物理性质观察钠、钾、钙、镁、铝等主族金属颜色分别为银白色、银白色、银白色、银白色、银白色;硬度分别为软、软、软、软、较硬;密度分别为0.97g/cm³、0.86g/cm³、1.55g/cm³、1.74g/cm³、2.70g/cm³;熔点分别为97.8℃、63.5℃、842℃、650℃、660℃。
2. 与酸反应钠、钾与盐酸反应剧烈,产生大量气泡,反应速度较快;钙、镁与盐酸反应较缓慢,产生少量气泡;铝与盐酸反应缓慢,几乎不产生气泡。


中考九年级化学第八章知识点总结第一节 金属材料金属材料:金属材料包括纯金属以及它们的合金。
金属的物理性质在常温下一般为固态(汞为液态),有金属光泽(大多数金属呈银白色,铜呈紫红色,金呈黄色);导电性、导热性、熔点较高、有延展性、能够弯曲、硬度较大、密度较大。
金属之最地壳中含量最多的金属元素——铝 人体中含量最多的金属元素——钙目前世界年产量最多的金属——铁(铁>铝>铜) 导电、导热性最好的金属——银(银>铜>金>铝) 熔点最高的金属——钨 熔点最低的金属——汞 硬度最大的金属——铬 密度最大的金属——锇 密度最小的金属——锂 金属的分类金属的应用物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素。
在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
铜、铝——电线——导电性好、价格低廉 钨——灯丝——熔点高 铬——电镀——硬度大 铁——菜刀、镰刀、锤子等 汞——体温计液柱 银——保温瓶内胆 铝——“银粉”、锡箔纸合金:由两种或两种以上的金属或金属与非金属经一定方法所合成的具有金属特性的物质。
合金是混合物。
金属氧化物不是合金。
目前已制得的纯金属只有90多种,而合金已达几千种。
合金的硬度一般比组成它的纯金属的硬度大,抗腐蚀性强。
合金的熔点一般比组成它的纯金属的熔点低。
黑色金属:通常指铁、锰、铬及它们的合金。
有色金属:通常是指除黑色金属以外的其他金属。
重金属:如铜、锌、铅等 轻金属:如钠、镁、铝等常见的合金:可用来造人造骨。
钛和钛合金的优点:①熔点高、密度小;②可塑性好、易于加工、机械性能好;③抗腐蚀性能好。
生铁和钢性能不同的原因:含碳量不同。
第二节金属的化学性质金属与氧气的反应镁、铝:在常温下能与空气中的氧气反应:2Mg+O22MgO 4Al+3O2=2Al2O3铝的抗腐蚀性能好的原因:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。

《无机化学》各章小结第一章绪论平衡理论:四大平衡理论部分原子结构1.无机化学,分子结构,晶体结构元素化合物2.基本概念:体系,环境,焓变,热化学方程式,标准态古代化学3.化学发展史:近代化学现代化学第二章化学反应速率和化学平衡1.化学反应速率υ=Δc(A)Δt2.质量作用定律元反应aA + Bb Yy + Zzυ = k c (A) c (B)a b3.影响化学反应速率的因素: 温度, 浓度, 催化剂, 其它.温度是影响反应速率的重要因素之一。
温度升高会加速反应的进行;温度降低又会减慢反应的进行。
浓度对反应速率的影响是增加反应物浓度或减少生成物浓度,都会影响反应速率。
催化剂可以改变反应速率。
其他因素,如相接触面等。
在非均匀系统中进行的反应,如固体和液体,固体和气体或液体和气体的反应等,除了上述的几种因素外,还与反应物的接触面的大小和接触机会有关。
超声波、紫外线、激光和高能射线等会对某些反应的速率产生影响4.化学反应理论: 碰撞理论, 过渡态理论碰撞理论有两个要点:恰当取向,足够的能量。
过渡态理论主要应用于有机化学。
5.化学平衡: 标准平衡常数, 多重平衡规则, 化学平衡移动及其影响因素(1)平衡常数为一可逆反应的特征常数,是一定条件下可逆反应进行程度的标度。
对同类反应而言,K值越大,反应朝正向进行的程度越大,反应进行的越完全(2)书写和应用平衡常数须注意以下几点a. 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。
生成物为分子项,反应物为分母项,式中各物质浓度或分压的指数,就是反应方程式中相应的化学计量数。
气体只可以用分压表示,而不能用浓度表示,这与气体规定的标准状态有关。
b.平衡常数表达式必须与计量方程式相对应,同一化学反应以不同计量方程式表示时,平衡常数表达式不同,其数值也不同。
c.反应式中若有纯故态、纯液态,他们的浓度在平衡常数表达式中不必列出。
在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必出现在平衡关系式中。

化学初中教材第八章无机化学与元素周期表化学是一门研究物质组成、性质和变化的科学。
在化学的学习中,无机化学是一个重要的分支,它主要研究无机物质的性质和反应。
无机化学的基础是元素周期表,它是化学的重要工具,用于系统地组织和分类所有已知的元素。
本文将介绍化学初中教材第八章关于无机化学与元素周期表的主要内容。
一、无机化学基础知识1. 元素与化合物元素是构成物质的基本单位,化合物由两种或两种以上的元素以固定比例组合而成。
初中阶段主要了解常见元素和化合物的基本性质。
2. 常见无机化合物的命名与化学式无机化合物的命名和化学式遵循一定的规则,掌握这些规则可以正确命名和书写无机化合物的化学式。
3. 离子与离子化合物离子是带电荷的原子或原子团,离子化合物由带正电荷的金属离子和带负电荷的非金属离子组成。
掌握离子与离子化合物的基本概念对于理解化学反应和平衡很重要。
4. 金属元素与金属性质金属元素的特点包括金属光泽、导电性、导热性、延展性和塑性等。
了解金属元素的性质可以帮助我们理解金属制品的应用和加工过程。
二、元素周期表元素周期表是由化学元素按照一定的规则组织起来的表格,根据各元素的原子序数、电子结构和化学性质等进行分类。
元素周期表的组织形式让我们能够直观地了解各元素的特性。
1. 元素周期表的组织结构元素周期表按照原子序数的递增顺序排列,同时根据元素的电子层的填充规律,将元素分成周期和族。
周期是水平排列的,族是垂直排列的。
2. 元素周期表中的主要部分元素周期表可以分为主族、过渡金属、稀土金属和放射性元素区等。
其中,主族元素和过渡金属元素是初中化学教材重点。
3. 元素周期表中的元素特性元素周期表中,元素的位置与其原子结构、性质及化学反应有关。
周期表上的元素位置可以帮助我们预测元素的性质和反应行为。
4. 元素周期表的应用元素周期表不仅仅是化学家研究元素的工具,它还在许多领域有实际应用。
如材料科学、能源产业、医药研发等方面。
三、元素与化学反应化学反应是指在给定条件下,物质之间发生化学变化,产生新物质的过程。