第三章:羟醛缩合
- 格式:ppt
- 大小:283.50 KB
- 文档页数:33


中学化学竞赛试题资源库——羟醛缩合A组1.以乙烯为初始反应可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。
下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分另跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。
(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):请运用已学过的知识和上述结出的信息写出由乙烯制正丁醇各步反应式。
2.醛可发生分子间的反应,生成羟基醛,如:烯烃分子在一定条件下会发生二分子聚合,如:(1)HOCH2CH(CH3)CHO可由与两种醛合成(填结构简式)(2)HOCH2CH(CH3)CHO转变成(CH3)2C=CH2须经过、、等较合理的反应过程(填反应类型名称)(3)将(CH3)2C=CH2经二分子缩合后的生成物与氢气进行加成反应,所得有机物按系统命名法称为。
B组3.有机物分子中,凡与官能团直接相连的碳原子称为α-碳原子,与α-碳原子连接的氢原子称为α-氢原子。
在一定条件下含有α-氢原子的醛(或酮)能与另一分子醛(或酮)发生反应,其实质是一个α-氢原子加在另一个醛酮的氧原子上,其余部分加在羰基上形成羟醛。
例如:同时,羟醛不稳定,受热可脱水生成烯醛。
请用已学过的知识和所给信息回答下列问题:(1)现有一化合物A,是由B、C两物质通过上述类型的反应生成的。
试根据A的结构简式写出B、C的结构式:A:B:C:(2)利用有关物质可合成肉桂醛(-CH=CHCHO)和乙酸丁酯。
请在下列合成路线的方框中填出有关物质的结构简式:4.肉桂醇是一种优质香精,由植物桂皮油中可分离出,也可以通过有机合成法制得,其结构简式为—CH=CH—CHO。
可通过下面的几步反应合成制得,下面式子中的A、B、C、D皆为有机物OH—CH2OH+HCl①A+H2O−−→−∆-/②—CH2OH−−→−氧化 B③B+C−−一定条件 D−→−④D−−一定条件—CH=CH—CHO+H2O−−→试回答(1)A的结构简式为;(2)①步反应类型,④步反应类型;(3)写出③步反应的化学方程式。

第3章羟醛缩合和有关的反应3.1 引言开链化合物的立体控制反应在现代有机化学中是一个备受关注的问题,已发展出许多有用的方法用于具有刚性构象的复杂分子(如大环内酯合多环醛抗生素)的立体控制合成。
醛醇缩合反应在生物合成中是一种基本的键形成反应,因而受到特别的注意。
醛醇反应,即亲核试剂与亲电的羰基基团(及类似基团)的缩合反应,是构建不对称C-C键的最简单的,同时能满足不对称有机合成方法学的最严格要求的一类化学转化。
在复杂分子的合成和在光学活性的小分子砌块的制备中,可以找到许多不对称醛醇缩合反应的实例[1].在复杂的天然产物的合成中,常常会遇到制备具有多个相邻的手性中心的中间体的任务。
这类化合物的最有效的合成策略,是那种在连接二个反应片断的同时又建立起毗邻立体中心的策略。
在每一个前述的策略中,希望对于相对的(syn/anti)以及绝对的(R/S)立体化学都能实行控制 . 已有许多研究者报道了非对映选择性(对映选择性)醛醇缩合反应的结果。
这些不对称醛醇缩合反应中的主要变化因素是金属抗衡离子、与这些离子键合的配体以及反应条件。
下述几种方法可用于对醛醇反应进行不对称控制:105(1)底物控制:非手性烯醇盐或烯丙基金属试剂对手性醛的加成(一般在α-位).在这种情况下,按照Cram-Felkin-Ahn规则由优势过渡态来决定非对映选择性[2].(2)试剂控制:手性烯醇盐或烯丙基金属试剂对非手性醛的加成.最通用的获得手性烯醇盐的方法是通过手性辅剂以酯、酰胺(噁唑啉)、酰亚胺(噁唑烷酮)或硼烯醇盐的形式结合;手性烯丙基金属试剂通常也与手性配体结合.(3)双不对称反应:手性烯醇盐或烯丙基金属试剂对手性醛的加成.当醛和试剂显示互补的面优先性(匹配对的情况)时,能够提高立体选择性;反之当它们的面优先性相反(错配对)时,立体选择性降低.当与合适的配体配位时,许多金属抗衡离于(诸如Li,Mg,Zr,B,AI,Sb,Si,Ti)在不对称醛醇缩合反应中能提供良好的立体选择性.锂或镁形成络台物,它们通过Cram-Felkin-Ahn规则或配位控制加成提供选择性.钛的应用得到了极巧妙的、多样性的好结果,它与手性配体络合提供对映选择性的转化.硼烯醇盐由于其高对映选择性的传递性质而被证明具有广泛的用途.杂双金属催化剂和双核中心催化剂既能活化亲核试剂又能活化亲电试剂,它们贯穿了本章的讨论内容.可以说,只是从20世纪80年代早期开始,本论题才获得显著的进展.在本章中,我们试图介绍金属烯醇盐和有关的烯丙基金属衍生物对碳基化合物的加成反应的一些最重要的进展,如图3.1中的途径A和途径B所示的。
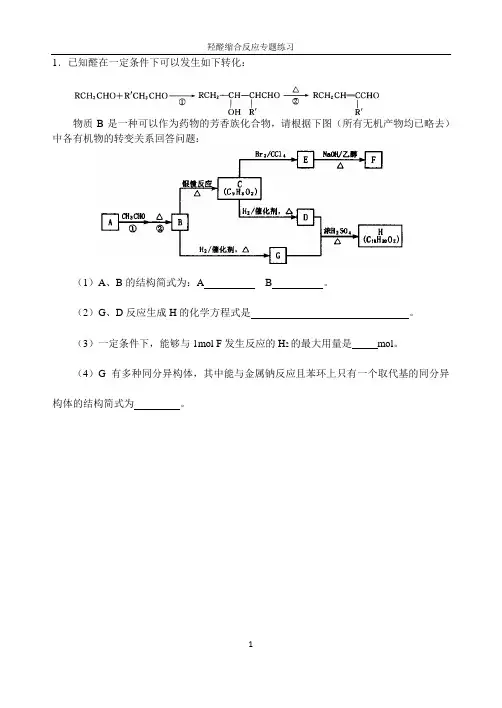
1.已知醛在一定条件下可以发生如下转化:物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题:(1)A、B的结构简式为:A B 。
(2)G、D反应生成H的化学方程式是。
(3)一定条件下,能够与1mol F发生反应的H2的最大用量是mol。
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为。
2. 有机化合物G是合成维生素类药物的中间体,其结构简式为:已知:G的合成路线如下:其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去请回答下列问题:(1)G的分子式是,G中官能团的名称是。
(2)第①步反应的化学方程式是。
(3)B的名称(系统命名)是。
(4)第②~⑥步反应中属于取代反应的有(填步骤编号)。
(5)第④步反应的化学方程式是。
(6)写出同时满足下列条件的E的所有同分异构体的结构简式。
①只含一种官能团;②链状结构且无—O—O—;③核磁共振氢谱只有两种峰。
3.软质隐形眼镜材料W 、树脂X 的合成路线如下:(1)A 中含有的官能团名称是 。
(2)甲的结构简式是 。
(3)B → C 反应的化学方程式是 。
(4)B 有多种同分异构体。
属于酯且含有碳碳双键的同分异构体共有 种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是 。
(5)已知F 的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同。
则F 还能发生的反应是(填序号) 。
a .加成反应b .氧化反应c .加聚反应d .水解反应 (6)写出树脂X 可能的结构简式(写出一种即可) 。
(7)E 的分子式为C 10H 14O 2,含三个甲基,苯环上的一溴代物有两种。
生成E 的化学方程式是 。
‖O 2OH XW )∣ ∣ R已知:H―C―H + R―CH 2―CHO CH 2―CH―CHO CH 2=C―CHO‖ OOH ∣ R -H 2O4.肉桂酸异戊酯G()是一种香料,一种合成路线如下:已知以下信息:①;②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。

羟醛缩合机理一、引言羟醛缩合是有机化学中一种重要的反应类型,也是生物大分子合成中最基本的反应之一。
本文将详细介绍羟醛缩合的机理。
二、羟醛缩合概述羟醛缩合是指在弱碱性条件下,甲醛或其他羰基化合物与具有活泼亲核性能的化合物(如胺、酚等)进行缩合反应,生成稳定的亚甲基或烷基化合物的过程。
在此过程中,甲醛分子首先被氢氧根离子(OH-)攻击,形成甲氧根离子和一个极性质子,然后极性质子进一步被亲核试剂(如胺、酚等)攻击,形成新的碳-碳键。
三、羟醛缩合机理1. 羟醛生成首先,在弱碱性条件下,甲醛分子与氢氧根离子发生反应,生成羟甲基或甲氧根离子。
这个步骤是整个反应过程中最重要的步骤之一。
2. 美拉德反应接着,在第一个步骤的基础上,羟甲基或甲氧根离子与亲核试剂(如胺、酚等)发生缩合反应,形成亚甲基或烷基化合物。
这个步骤被称为美拉德反应。
3. 羟醛缩合的条件羟醛缩合反应需要一定的条件,包括弱碱性环境、适当的温度和压力等。
在实际应用中,常用的催化剂包括氢氧化钠、氢氧化钾和三乙胺等。
四、羟醛缩合反应的机理解析1. 羰基亲核加成羰基亲核加成是指亲核试剂(如胺、酚等)中的负电子对攻击羰基碳上电子不足原子所形成的中间体。
在羟醛缩合反应中,亲核试剂(如胺、酚等)中的负电子对攻击了甲醛分子上电子不足原子所形成的中间体。
2. 产物稳定性分析产物稳定性是指产物分子内部键能与外界环境作用力之间平衡状态下所达到的最低自由能状态。
在羟醛缩合反应中,产物的稳定性是由产物分子内部键能和外界环境作用力之间的平衡状态所决定的。
3. 美拉德反应机理美拉德反应机理是指亲核试剂与甲醛分子发生缩合反应时,中间体的生成和消失过程。
在羟醛缩合反应中,美拉德反应机理包括亲核试剂攻击甲醛分子、中间体生成、中间体消失和产物生成等步骤。
五、羟醛缩合反应的影响因素1. 催化剂种类和用量催化剂种类和用量对羟醛缩合反应有重要影响。
常用的催化剂包括氢氧化钠、氢氧化钾和三乙胺等。



Aldol反应反应在有机化学中的应用摘要:Aldol反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用Aldol反应的机理:Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
Aldol反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。



羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
羟醛缩合在有机合成当中很重要,它是形成碳碳单键的关键条件之一,罗宾逊成环反应中有一步就是羟醛缩合反应。
羟醛缩合在大学有机化学课程中常作为一个经典构建碳键的反应进行讲解,并用该反应介绍反应机理。
在普通的羟醛缩合反应中,包涵了酮的烯醇对于醛的亲核加成,形成β-羟基酮或者“羟醛”(广泛出现于各种天然产物及药物中的一种结构单元)。
羟醛缩合在生物化学中也同样广泛存在。
羟醛反应自身由醛缩酶催化,然而该反应不是正式的缩合反应,这是因为过程中并未脱除小分子。
反应在醛和酮之间发生(交叉羟醛缩合),或者在两个醛之间发生,则称为Claisen-Schmidt缩合反应。
这些反应都被冠以发现人的名字莱纳·路德维希·克莱森和J.G.施密特。
他们分别于1880和1881年发表了自己在该领域的论文。
机理:
反应的第一步为羟醛反应,第二步为脱水反应即消除反应。
当分子内有活性羧基的情况下,该脱水反应还会伴随脱羧反应。
羟醛加成产物可通过两种机理进行脱水反应:强碱如:叔丁醇钾、氢氧化钾或氢氧化钠通过烯醇机理进行反应,[10]或通过酸-催化进行的烯醇机理进行反应。
酸催化的羟醛反应机理
酸催化的脱水反应
做碱)
碱催化的羟醛反应 (图例使用−OCH
3
碱催化的脱水反应 (这里通常被错写为简单一步,见E1cB消除反应)。
9.3.3.3 羟醛缩合反应
羟醛缩合反应(Aldol c ondensation r eaction)
在稀碱溶液中,两分子有α-H的醛结合生成β-羟基醛的反应。
α-碳上有氢原子的β-羟基醛受热容易失去一分子水,生成α,β-不饱和醛。
反应机理:
β-‐羟基醛
2-丁烯醛(巴豆醛) β-羟基醛在加热时容易脱水生成α,β-不饱和醛。
庚醛以上的醛在碱性溶液中只能得到α,β-不饱和醛,因为分子量大的醛的Aldol反应必须加热才能进行。
easy difficult
酮的羟醛缩合反应不易进行,需要将产物不断
移
出平衡体系,促进反应向右
进行。
如何实现酮的羟醛缩合反应?
Soxhlet Extractor
catalyst
acetone
分子内缩合反应的选择性
交叉的羟醛缩合反应(Crossed
Aldol R eaction)
产物复杂,无实用价值
策略一:其中一个醛无 α-H
Claisen-Schmidt (克莱森-施密特)缩合反应 交叉的羟醛缩合反应(Crossed Aldol R
eaction)
交叉的羟醛缩合反应(Crossed
Aldol R eaction)
策略二:利用酮不易发生羟醛缩合反应的性质
LDA
交叉的羟醛缩合反应(Crossed A ldol R eaction)
Aldol reaction Cannizzaro reaction 三羟甲基乙醛
季戊四醇 。
羟醛的缩合-概述说明以及解释1.引言1.1 概述羟醛的缩合是一种重要的化学反应,广泛应用于有机合成领域。
羟醛(也称为醛酮)是一类化合物,含有一个碳氧双键和一个碳氢双键的官能团,具有很强的活性。
羟醛缩合指的是两个或多个羟醛分子之间发生的反应,生成一个更大的分子,并且伴随着碳-碳键的形成。
羟醛缩合反应的机理一般包括羟基的负离子产生、亲核试剂的加成和负离子的消除等步骤。
在缩合反应中,羟醛分子发生自身的缩合,可以通过内部的亲核试剂(如羟基)攻击羰基碳上的电子云,从而形成新的碳-碳键。
羟醛缩合在有机合成中具有广泛的应用。
首先,它可以用于构建碳骨架,生成各种有机化合物,如酮、糖和天然产物等。
其次,羟醛缩合反应还可用于合成杂环化合物,如吡咯、噻吩和咪唑等。
此外,羟醛缩合还可以被用作多步合成中的关键步骤,实现合成目标化合物的合成。
综上所述,羟醛缩合反应在有机化学合成中起着重要作用,具有广泛的应用前景。
对羟醛缩合反应的研究不仅有助于深入理解其反应机理,还为合成新型有机化合物提供了有力的工具。
随着合成化学的不断发展,相信羟醛缩合反应将在未来的有机合成中发挥更大的作用。
1.2文章结构1.2 文章结构本文主要介绍了羟醛的缩合反应。
文章结构如下:1. 引言1.1 概述:简要介绍了羟醛的基本概念和缩合反应的背景。
1.2 文章结构:介绍了本文的整体结构和各个章节的内容。
1.3 目的:明确了本文的目标和意义。
2. 正文2.1 羟醛的定义和性质:详细介绍了羟醛的化学结构、命名规则和一些基本性质。
2.2 羟醛缩合反应的机理:探讨了羟醛缩合反应的基本原理和常见的机理路径。
2.3 羟醛缩合在有机合成中的应用:列举了羟醛缩合在有机合成中的一些重要应用,并说明其在合成中的优势和局限性。
3. 结论3.1 总结羟醛缩合的重要性:总结了羟醛缩合在有机合成中的重要性和广泛应用的现状。
3.2 展望羟醛缩合的未来发展:对羟醛缩合反应的未来发展方向和可能的改进进行了展望。
羟醛缩合名词解释
羟醛缩合
什么是羟醛缩合?
羟醛缩合是一种有机反应,通过醛与醛或醛与酮之间的缩合反应,形成含有羟基的化合物。
相关名词
以下是与羟醛缩合相关的名词:
1.醛:一种有机化合物,含有羰基与氢原子的结构,常
用代表性的醛有甲醛和乙醛。
示例:甲醛(HCHO)、乙醛(CH3CHO)
2.酮:一种有机化合物,含有羰基与两个烃基的结构,
常用代表性的酮有丙酮和戊酮。
示例:丙酮(CH3COCH3)、戊酮(CH3COCH2CH2CH3)
3.缩合:两种或多种化合物结合成一个较大分子的过程。
示例:醛与醛之间的缩合反应
4.羟基:氢原子部分或完全被一个氧原子取代的一类官
能团。
示例:羟基(OH)
举例解释说明
羟醛缩合反应可通过以下示例进行解释说明:
•甲醛和乙醛的缩合反应:
[Reaction equation](
在此反应中,甲醛(HCHO)与乙醛(CH3CHO)发生缩合反应,生成含有羟基的产物。
•醛和酮的缩合反应:
[Reaction equation](
在此反应中,醛和酮发生缩合反应,形成含有羟基的化合物。
以上就是羟醛缩合及其相关名词的介绍和解释。
羟醛缩合在有机化学领域中具有重要的应用价值,能够合成具有特定功能的化合物。
羟胺缩合反应机理
羟胺缩合反应是一种重要的有机合成反应,用于制备一系列含有腈基、胺基、酰基等官能团的有机化合物。
反应是在碱性条件下进行的,反应物为羟胺和醛或酮。
该反应机理是通过亲核加成、脱水缩合、酰胺离解三步反应完成的。
首先,羟胺通过亲核加成反应与醛或酮发生缩合反应,生成中间产物羟胺醛或羟胺酮。
接着,中间产物发生脱水缩合反应,且在碱性条件下,水分子被去除,生成酰胺化合物。
最后,酰胺化合物通过酰胺离解反应,释放出氨,得到最终产物。
该反应具有高产率、易操作等优点,广泛应用于有机化学合成中。
- 1 -。