实验一 小白鼠骨髓细胞染色体制片
- 格式:ppt
- 大小:878.50 KB
- 文档页数:14




小白鼠染色体标本的制作染色与观察染色体是生物体内的遗传物质DNA和蛋白质的组合体,通过对染色体的观察可以了解生物种群的遗传信息和进化变化。
染色体观察在遗传学、病理学等领域具有重要的应用价值。
本文将介绍小白鼠染色体标本的制作方法以及染色和观察的步骤。
1.小白鼠染色体标本的制作方法制作小白鼠染色体标本的过程主要包括取材、处理和固定等步骤。
(1)取材选择健康的小白鼠,尤其是发育期的小白鼠,取得其骨髓或肝脏等组织。
取材时要注意卫生和无菌操作,以保证样品的质量。
(2)处理将取得的骨髓或肝脏等组织放入离心管中,加入等体积的生理盐水悬浮液,并在其中加入适量的KCl溶液进行渗透,使细胞膜变得脆弱,易于裂解释放染色体。
(3)固定将处理后的细胞悬浮液滴到已经消毒的玻璃片上,然后迅速将玻璃片倾斜,让细胞悬浮液自然扩散开来。
待其固定后,用甲醛进行固定处理,固定时间一般为5-10分钟。
2.小白鼠染色体染色的步骤(1)裂解将固定的标本玻璃片在室温下迅速加热至约60℃的热板上,使染色体细胞裂解释放出染色体。
裂解时间一般为5-10分钟。
(2)染色将裂解后的细胞标本浸泡在浓度适当的染色液中,常用的染色液有乔治染色液、甲酸-吡啶染色液和乙酸酒精染色液等。
对于小白鼠染色体标本的染色,乔治染色液是较为常用的选择。
(3)洗涤染色后的标本需要进行洗涤步骤以去除多余的染色液和固定剂。
使用生理盐水或磷酸缓冲液进行反复洗涤,直到洗涤液清澈。
3.小白鼠染色体观察的步骤在染色体标本制作和染色之后,我们可以通过显微镜进行小白鼠染色体的观察,并对染色体进行测量和特征描述。
(1)显微镜观察将染色后的标本玻璃片固定在显微镜载玻片上,使用显微镜进行观察。
观察过程中可以选择不同倍数的镜头以获得更详细的图像。
(2)测量和特征描述通过观察染色体在显微镜下的形态和结构,我们可以测量染色体的长度、形状等参数,并对染色体的特征进行描述,如染色体数量、着丝点的位置等。
总结:小白鼠染色体标本的制作染色与观察是一项重要的生物实验技术,可以帮助我们了解生物的遗传特征和疾病的发生机制。

动物骨髓细胞染色体标本的制备实验报告
实验目的:
本实验的目的是利用正常小鼠的骨髓细胞制备染色体标本,并通过显微镜观察染色体的形态和数量,并了解染色体的组成和结构。
实验原理:
染色体是细胞核中最大的有组织结构,由DNA和蛋白质组成。
染色体的数量和形态是每个物种独特的标志之一。
在有丝分裂过程中,染色体的形态和数量的变化可以反映出细胞的分裂状态。
为了制备染色体标本,需要通过细胞的裂解,释放和固定染色体,然后在显微镜下观察染色体的形态和数量。
实验步骤:
1. 取出小鼠的股骨,并在无菌条件下对其进行消毒。
2. 使用消毒的剪刀剪下股骨两端,将骨髓剪下,加入RPMI-1640培养液中,使髓液悬浮,然后用细胞培养器将其孵育2-3天,使骨髓细胞增殖。
3. 用离心机将骨髓细胞离心,去除培养液,用磷酸盐缓冲液进行细胞裂解。
4. 将制备好的染色体悬液滴在预先涂上盐酸聚赖氨酸溶液的载玻片上,让其固定,然后通过染色体芝士和琼脂糖溶液对细胞进行染色。
5. 用显微镜观察染色体标本,记录染色体的数量和形态,并观察细胞的分裂状态。
实验结果:
制备的染色体标本在显微镜下观察。
通过对标本的观察,我们可以看到染色体形态和数量的变化,以及细胞分裂状态的变化。
同时,我们可以从染色体上观察到细胞的遗传信息,包括基因序列和调控因子等。
结论:
本实验成功制备了小鼠骨髓细胞染色体标本。
观察染色体形态和数量的变化,可以从中了解细胞的遗传信息和分裂状态变化。
同时,该实验也展示了染色体的重要性和组成结构,加深了对细胞生物学的理解。


小鼠骨髓细胞染色体制备染色体制备是生物学研究中常用的实验技术之一,通过染色体制备可以获得染色体的形态和结构信息,从而进一步研究其功能和遗传特性。
本文将介绍小鼠骨髓细胞染色体制备的方法和步骤。
一、材料准备1. 小鼠骨髓细胞2. 10% 碘酒3. 0.075M KCl 溶液4. 甲醛溶液(4%)5. 甲基绿染液6. 预热37°C恒温水浴7. 玻片和载玻片夹二、实验步骤1. 将小鼠安乐死并取出骨髓,将骨髓切碎并转移到15ml离心管中。
2. 加入适量的10%碘酒,使得骨髓完全被浸泡,放置室温下静置15分钟,使细胞均匀染色后固定。
3. 使用离心机以1000rpm离心10分钟,将碘酒倒掉。
4. 加入适量的0.075M KCl 溶液,使骨髓细胞悬浮,用离心机以1000rpm离心10分钟,将上清液倒掉。
5. 再次加入适量的0.075M KCl 溶液,使骨髓细胞悬浮,用离心机以1000rpm离心10分钟,将上清液倒掉。
6. 加入适量的甲醛溶液(4%),使骨髓细胞固定,用离心机以1000rpm离心10分钟,将上清液倒掉。
7. 加入适量的甲醛溶液(4%),使骨髓细胞固定,用离心机以1000rpm离心10分钟,将上清液倒掉。
8. 加入适量的甲醛溶液(4%),使骨髓细胞固定,用离心机以1000rpm离心10分钟,将上清液倒掉。
9. 加入适量的甲基绿染液,使骨髓细胞染色,用离心机以1000rpm离心10分钟,将上清液倒掉。
10. 加入适量的甲基绿染液,使骨髓细胞染色,用离心机以1000rpm离心10分钟,将上清液倒掉。
11. 加入适量的甲基绿染液,使骨髓细胞染色,用离心机以1000rpm离心10分钟,将上清液倒掉。
12. 将悬浮的骨髓细胞滴于预热的玻片上,并用载玻片夹轻轻压平。
13. 将载玻片夹放入预热37°C的恒温水浴中,静置10分钟。
14. 将载玻片夹取出,用甲醛固定液稍微洗净,并用酒精进行脱水。
15. 将载玻片夹放入洗净过的甲醛固定液中浸泡10分钟,然后用酒精进行脱水。



第1篇一、实验目的1. 了解骨髓细胞染色体制备的基本原理和操作步骤。
2. 掌握染色体制片技术,观察骨髓细胞染色体结构。
3. 熟悉显微镜的使用方法,提高观察细胞结构的能力。
二、实验原理骨髓细胞染色体制备是研究染色体结构、数量及异常的重要方法。
通过染色体制备,可以在显微镜下观察到细胞的染色体结构,从而分析细胞的遗传特性。
本实验采用小鼠骨髓细胞作为实验材料,通过秋水仙素处理使细胞分裂阻滞在中期,再进行低渗处理、固定、滴片、染色等步骤,制备染色体标本。
三、实验材料与仪器1. 实验材料:小鼠骨髓细胞、秋水仙素、柠檬酸钠、固定液、染色液等。
2. 实验仪器:显微镜、离心机、载玻片、盖玻片、滴管、烧杯等。
四、实验步骤1. 实验前准备:将小鼠处死,取出骨髓组织,放入装有柠檬酸钠的小烧杯中,用剪刀剪碎,使骨髓细胞游离出来。
2. 低渗处理:将骨髓细胞悬浮液放入离心管中,离心后弃去上清液,加入适量固定液,再次离心,弃去上清液。
3. 染色:将固定后的细胞沉淀用染色液染色,室温放置10-15分钟。
4. 滴片:将染色后的细胞沉淀用滴管滴在载玻片上,盖上盖玻片,用显微镜观察。
五、实验结果与分析1. 观察到细胞呈圆形,细胞核较大,染色质清晰可见,染色体呈X形,可见有丝分裂中期细胞。
2. 观察到染色体数目与小鼠的正常染色体数目一致,染色体结构完整,无断裂、缺失、易位等异常。
六、实验讨论1. 秋水仙素处理:秋水仙素是一种细胞分裂抑制剂,能使细胞分裂阻滞在中期,有利于观察染色体结构。
2. 低渗处理:低渗处理可以使细胞膨胀,便于观察染色体结构。
3. 固定:固定可以使细胞和染色体保持原状,便于观察。
4. 染色:染色可以使染色体着色,便于观察。
七、实验总结本实验成功制备了小鼠骨髓细胞染色体标本,并观察到了染色体结构。
通过本实验,我们掌握了染色体制备的基本原理和操作步骤,提高了观察细胞结构的能力。
在今后的实验中,我们将进一步学习染色体分析技术,为遗传学研究提供有力支持。
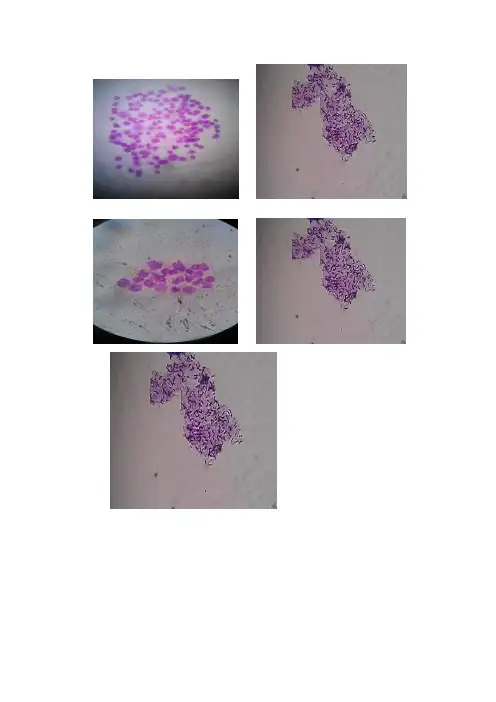
小鼠骨髓细胞染色体制片质量评价1、制片人:徐宜强2、同组人:朱沛煌徐宜强3、时间:2011年12月7日4、制片内容:小白鼠骨髓细胞染色体标本的制备5、制片过程:①预处理(实验前,老师已帮忙做好)取骨髓前3-4h给小鼠注射0.1%的秋水仙素。
②取骨髓断颈法处死小鼠,取股骨,剪掉股骨两端关节头,用注射器吸取1%你们酸钠洗脱至骨腔变白。
③低渗用吸管吹打,1000prm离心10min,去上清,加0.075mol/L KCl 5-8ml,吹打,水浴20min④固定1000prm离心10min,去上清,沿管壁慢慢加8ml固定液(3:1),轻轻吹打均匀,静置20-30min,1000prm离心10min,去上清,留0.5ml沉淀加固定液(1:1)5-6滴。
⑤滴片将事先在冰箱中预冷的载玻片30º倾斜,滴管与玻片50cm高度滴片,每张玻片上滴2-3滴,滴完立即吹散吹匀,放置至充分干燥。
⑥染色充分干燥后用苯酚品红染液染色20min。
⑦观察染色完毕后,用清水轻洗,干燥,观察染色体形态。
6、细胞破碎率:制片编号 1 2 3 4 5 65 10 12 13 15 5每100个细胞中细胞跌破数综合制作的六张玻片,得细胞破碎率=10%7、染色体形态:大体上呈现U字型。
8、染色体数目:小白鼠骨髓细胞染色体有40条。
9、清晰程度:中等,大部分染色体形态可以看清楚,有的染色体很清晰,个别染色体很模糊。
在个别较清晰破碎细胞中,可隐约数到36条。
10、实验中得失分析:实验开始的第一步就是杀死小白鼠,这着实给了我一个比较大的挑战,但是想想凡事总得有个第一次,就狠下心,捉了一只小鼠,按照老师指导的要点将小鼠迅速处死了。
但是取股骨的时候,由于大意没仔细听老师讲解,取错了,把股骨剪断了。
只好又重新又取了个小鼠来取股骨。
实验操作中还存在一些不足,导致细胞跌破率不高,染色的效果不是很好,有的载玻片上的很少,有的载玻片上还有不少细胞团簇在一起,可能原因是:一、低渗做的不是很好。
小鼠骨髓细胞染色体标本制备1. 引言大家好,今天我们来聊聊一个听起来可能有点儿复杂,但其实挺有趣的话题——小鼠骨髓细胞染色体的标本制备。
别担心,我会把这些专业术语说得简单明了,让你也能轻松get到这个过程。
说起来,小鼠可真是科学研究中的“常客”,就像饭桌上的米饭,随处可见,缺了它可不行。
这不,今天咱们就来探索一下怎么从小鼠身上提取骨髓细胞,搞个染色体标本,看看这些小家伙们的秘密。
2. 骨髓细胞的来源2.1 小鼠的选择首先,你得找一只小鼠。
挑小鼠可不是随便的,得挑那些健康活泼的小家伙,就像挑选水果一样,选那种又圆又亮的最好。
一般来说,实验室里会用小鼠的某个特定品系,比如C57BL/6,它们可是科研界的明星。
别忘了,鼠鼠们可不是随便抓来的,得遵循一套规矩,确保它们的生活环境干净卫生,毕竟咱们要尊重这些小生命。
2.2 获取骨髓细胞接下来,就是动手获取骨髓细胞的环节了。
首先,要麻醉小鼠,这一步可不能省,麻醉得当才能让它们安静下来,不然你想抓取细胞,它们可是不会轻易妥协的。
麻醉之后,小心翼翼地取出小鼠的骨髓,这个过程就像是在做外科手术,要有点儿医生的范儿,稳重些。
骨髓一般是在鼠鼠的股骨和胫骨里,捣鼓的时候要小心别伤到周围的组织。
3. 细胞制备过程3.1 细胞分离一旦取出骨髓,你会发现那里面的小细胞们就像一群调皮的孩子,四处乱窜。
我们要做的就是把它们从骨髓中分离出来。
这个过程通常会用到生理盐水,简单说就是把骨髓和盐水混合,轻轻摇晃,让细胞们游出来。
记住,摇晃的时候要轻柔,别像个暴徒一样,细胞们可是很娇嫩的!3.2 染色体制备接下来就是最神奇的部分——染色体的准备。
我们需要把这些细胞放到培养基里,让它们再长一段时间,这样细胞会分裂得更多,染色体也会更加明显。
等到细胞生长到一定程度,我们就可以通过加一些化学药剂,比如秋水仙素,来阻止它们的分裂,准备好进行染色。
4. 染色体的染色与观察4.1 染色过程染色这个步骤可有意思了!我们要用一种专门的染色液,把这些细胞染上色。