一维势箱模型与休克尔分子轨道理论的关系
- 格式:pdf
- 大小:111.21 KB
- 文档页数:3



休克尔轨道法的分子图一、化学家休克尔E.Erich Armand Arthur Josephckel (1896~)联邦德国物理化学家。
1896年8月9日生于柏林夏洛腾堡。
1914年入格丁根大学攻读物理。
曾中断学习,在格丁根大学应用力学研究所研究空气动力学。
1918年重新攻读数学和物理,1921年在P.德拜的指导下获博士学位。
他在格丁根大学工作两年,曾任物理学家M.玻恩的助手。
1922年在苏黎世工业大学再度与德拜合作,任讲师。
1930年在斯图加特工业大学任教。
1937年任马尔堡大学理论物理学教授。
休克尔主要从事结构化学和电化学方面的研究。
他1923年和德拜一起提出强电解质溶液理论,推导出强电解质当量电导的数学表达式。
1931年提出了一种分子轨道的近似计算法即休克尔分子轨道法(HMO 法),主要用于π电子体系。
他在30年代还对芳香烃的电子特性在理论上作出了解释,并总结出:环状共轭多烯化合物中π电子数符合4n+2(n为1,2或3)者,具有芳香性。
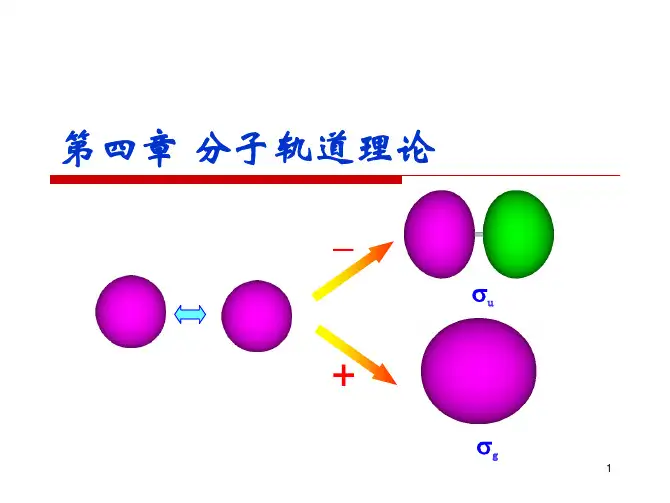
二、休克尔分子轨道法(HMO法)的来源分子轨道理论在处理分子时,并不引进明显的价键结构的概念。
它强调分子的整体性,认为分子中的原子是按一定的空间配置排列起来的,然后电子逐个加到由原子实和其余电子组成的“有效”势场中,构成了分子。
并将分子中单个电子的状态函数称为分子轨道,用波函数ψ(x,y,z)来描述。
每个分子轨道ψi都有一个确定的能值Ei 与之相对应,Ei近似地等于处在这轨道上的电子的电离能的负值,当有一个电子进占ψi 分子轨道时,分子就获得Ei的能量。
分子轨道是按能量高低依次排列的。
参与组合的原子轨道上的电子则将按能量最低原理、鲍里不相容原理和洪特规则进占分子轨道。
根据电子在分子轨道上的分布情况,可以计算分子的总能量。
π键实际上是持有电子的围绕参与组合的原子实的π分子轨道。
1931年,休克尔提出了一种计算π分子轨道及其能值的简单方法,称为休克尔分子轨道法(即HMO 法)。






《结构化学》教学大纲
一、课程基本信息
二、课程教学目标
1.了解用量子力学研究原子结构的基本方法,理解波函数和电子云的径向分布函数和角度分布及核
外电子排布的基本原理,掌握原子、分子和晶体中电子运动的基本规律。
2.了解用量子力学研究分子结构和配合物结构的基本方法,掌握分子轨道理论和配位场理论的基本
原理,深入了解化学键的本质。
初步了解研究分子结构的近代物理实验方法的基本原理。
3.了解晶体点阵结构的特点,理解X-射线衍射的基本原理及Laue和Bragg方程,了解粉末法物相
分析的基本原理。
4.了解金属键的自由电子模型和固体能带理论,掌握球的密堆积、金属单质的结构和离子晶体的若
干简单结构型式,了解离子配位多面体及其连接规律。
三、理论教学内容与要求
四、考核方式
根据结构化学课程的特点,考核方式以期末闭卷考试为主,平时成绩为辅。
期末考试试卷的成绩占总成绩的80%,课堂提问、上课出勤和课后作业作为平时成绩的考核依据共占据20%。
考试的内容以课堂教学的内容为主,考察学生对结构化学基本内容的掌握程度。
期末考题的类型包括选择题,填空题,简答题和综合计算题。

结构化学基础总结第一章:量子力学基础知识一、3个实验1、黑体辐射实验:(1)黑体:被认为是可以吸收全部外来辐射的物体,是理想的辐射体。
理想黑体可以吸收所有照射到它表面的电磁辐射,并将这些辐射转化为热辐射,其光谱特征仅与该黑体的温度有关,与黑体的材质无关。
可见光:400-700nm(2)假设:黑体吸收或发射辐射的能量是不连续的,而是分子一份一份的,即,量子化的。
E=hμ2、光电效应实验和Einstein光子学说:光量子化和光的波粒二象性本质。
(1)Einstein提出来了光量子(光子)。
波的性质:衍射、干涉。
E=hμ粒子的性质:反射、折射。
P=h/λ光子的动能与入射光的频率成正比,与光的强度无关。
(2)Heisenberg不确定度关系:Δq∙Δp≥ℏΔq坐标不确定量;Δp动量不确定量;q广义坐标单缝衍射:某粒子坐标确定得愈精确,其相应动量就愈不确定。
h可作为区分宏、微观粒子的标准:宏观h=0,微观h不能看作0。
3、氢原子光谱与Born氢原子模型:(1)氢原子光谱:指的是氢原子内之电子在不同能级跃迁时所发射或吸收不同波长、能量之光子而得到的光谱。
氢原子光谱为不连续的线光谱,自无线电波、微波、红外光、可见光、到紫外光区段都有可能有其谱线。
根据电子跃迁的后所处的能阶,可将光谱分为不同的线系。
(2)在卢瑟福模型的基础上,玻尔提出了电子在核外的量子化轨道,解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。
定态假设:原子的核外电子在轨道上运行时,只能够稳定地存在于具有分立的、固定能量的状态中,这些状态称为定态(能级),即处于定态的原子能量是量子化的。
此时,原子并不辐射能量,是稳定的。
激发态:原子受到辐射、加热或通电时,获得能量后电子可以跃迁到离核较远的轨道上去,即电子被激发到高能量的轨道上,这时原子处于激发态。
处于激发态的电子不稳定,可以跃迁到离核较近的轨道上,同时释放出光子。
二、量子力学基本假设1、假设1:对于一个量子力学体系,可以用坐标和时间变量的函数ψ(x,y,z,t)来描述,它包括体系的全部信息。
结构化学温习题一、填空题:(1)使波函数与其复共轭之乘积在全数空间区域内的积分值等于1,那个进程称为波函数的 。
(2)在量子力学中,用 来描述微观粒子运动状态。
(3)动量分量p z 对应的量子力学算符是 。
(4)3p 电子轨道角动量的大小能够表示为 。
(5)在线性变分法中,对两个原子形成化学键起关键作用的积分是 。
(6)波函数必需知足单值性、 、持续性。
(7)将电子和原子核的运动分开处置的近似称为 近似。
(8)电子云径向发布函数D(r)的概念式是 。
(9)电子波函数的值在空间相等的点所组成的空间曲面称为 。
(10)直线型分子对称轴的轴次为 。
(11)一个Cn 对称轴能够生成 个独立的对称操作。
(12)在F 2的分子轨道中(包括内层电子),3σg 的能量 1πu 的能量。
(13)CH 3Br 分子所属的点群为 。
(14)CH 2Cl 2分子所属的点群是 。
(15)原子轨道杂化后,轨道的极大值要紧散布在 方向上。
(16)在sp n杂化轨道k ks s kp p c c ψφφ=+中,表示s 轨道成份的量是 。
(17)在第k 个杂化轨道Ψ k 中,某种轨道的总成份αi 与该种轨道的组合系数c i 的关系是 。
(18)HCl 所属的分子点群是 。
(19)在BF 3分子中形成大π键时,B 原子提供的电子数是 。
(20)八面体配位场中中心离子的t 2g 轨道是 三个轨道。
(21)CO 32-基团中所形成的大π键m n π是 。
(22)配位体的群轨道与中心原子相对应的原子轨道的 相同。
(23)在O h 场中,割裂后的每一个t 2g 轨道的能量降低了 Dq 。
(24)自然界中存在的晶体空间点阵结构型式只能有 种。
(25)将对称性高、含有阵点数量尽可能少的平行六面体单位称为 。
(26)密置层为ABABAB 式的最密堆积方式是 密堆积。
(27)晶体结构中周期性重复着的内容称为 。
(28)金属原子等径圆球最密堆积中,球的配位数是 。
第1页 共 7 页《结构化学》课程 A 卷 专业班级: 命题教师: 审题教师:学生姓名: 学号: 考试成绩:一、判断题(在正确的后画“√”,错误的后面画“×”,10小题,每小题1分,共10分) 得分: 分1、自轭算符的本征值一定为实数。
( )2、根据测不准原理,任一微观粒子的动量都不能精确测定。
( )3、一维势箱中的粒子其能量是量子化的,并且存在零点能。
( )4、原子中全部电子电离能之和等于各电子所在原子轨道能总和的负值。
( )5、同核双原子分子中两个2p 轨道组合总是产生π型分子轨道。
( )6、具有未成对电子的分子是顺磁性分子,所以只有含奇数个电子的分子才是顺磁性的。
( )7、在休克尔分子轨道法中不需要考虑ˆH π的具体形式。
( ) 8、既具有偶极矩,又具有旋光性的分子必属于C n 点群。
( )9、含不对称 C 原子的分子具有旋光性。
( )10、分子的偶极距一定在分子的每一个对称元素上。
( )二、单项选择题(25小题,每小题1分,共25分) 得分: 分1、关于光电效应,下列叙述正确的是: ( )A 光电流大小与入射光子能量成正比B 光电流大小与入射光子频率成正比C 光电流大小与入射光强度没关系D 入射光子能量越大,则光电子的动能越大2、在一云雾室中运动的α粒子(He 的原子核), 其27416.8410,10m kg v m s --=⨯=⋅质量速度,室径210x m -=,此时可观测到它的运动轨迹,这是由于下列何种原因: ( )A 该粒子不是微观粒子B 测量的仪器相当精密C 该粒子的运动速度可测D 云雾室的运动空间较大3、对于"分子轨道"的定义,下列叙述中正确的是: ( )A 分子中电子在空间运动的波函数B 分子中单个电子空间运动的波函数C 分子中单电子完全波函数(包括空间运动和自旋运动)D 原子轨道线性组合成的新轨道第2页 共 7 页4、若K d =⎰τψ2,利用下列哪个常数乘ψ可以使之归一化 ( )A . KB . K 2C .K /1 D.5、对算符而言,其本征函数的线性组合具有下列性质中的 ( )A .是该算符的本征函数B .不是该算符的本征函数C .不一定是该算符的本征函数D .与该算符毫无关系6、下列函数是算符d /dx 的本征函数的是: ( )A. e 2xB. cos(x)C. xD. sin(x 3)7、处于状态i n ()x a πψ=的一维势箱中的粒子,其出现在x =2a 处的概率密度为 ( )A. 0.25ρ=B. 0.5ρ=C. 2/a ρ=D. ()1/22/a ρ=8、He +在321ψ状态时,物理量有确定值的有 ( )A .能量B .能量和角动量及其沿磁场分量C .能量、角动量D .角动量及其沿磁场分量9、下列归一化条件正确的是 ( ) A.⎰∞=021d r ψ B. ⎰∞=021d r R C. ⎰⎰∞=0π2021d d φθY D. ⎰=π021d sin θθΘ 10、用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s )中,正确的是( )A. 2,1,-1, -1/2;B. 0,0,0,1/2;C. 3,1,2, 1/2;D. 2,1,0,011、氢原子3d 状态的轨道角动量沿磁场方向的分量个数为 ( )A .1B .2C .3D .512、径向分布函数是指 ( )A .R 2 B. R 2d r C. r 2R 2 D. r 2R 2d r13、依据中心力场法,某电子i 受到的其它电子对它的排斥能为 ( )A .1i rB .i i r σC .()i i Z r σ-D .1ijr 14、角量子数L =1,自旋量子数S =2对应的谱项为 ( )A .5PB . 3DC . 2FD . 1S15、通过变分法计算得到的微观体系的能量总是: ( )第3页 共 7 页 A. 等于真实基态能量 B. 大于真实基态能量C. 不小于真实基态能量D. 小于真实基态能量16、在线性变分法中,对两个原子形成化学键起主导作用的是 ( )A .库仑积分H aaB .交换积分H abC .重叠积分S abD .重叠积分平方S 2ab17、下列哪种分子或离子键能最大? ( )A. O 2B. O 2-C. O 2+D. O 22-18、对溴化氢分子在远红外区测定吸收光谱,得到一系列间距为16.94cm -1的谱线。
结构化学教学中两个化学模型下的教学过程对比李娟;陈英【摘要】本文比较了一维势箱中的粒子模型和休克尔分子轨道理论两个教学过程的不同;分别用两个理论处理了链状共轭分子辛四烯、环状共轭分子苯的结构,不同的理论得到的结果有所不同.通过教学中前后联系、对比教学来解决结构化学教学过程中化学模型多,理论假设多,同学容易混淆的难题.【期刊名称】《绵阳师范学院学报》【年(卷),期】2018(037)005【总页数】8页(P48-54,60)【关键词】化学模型;量子力学;一维势箱;休克尔分子轨道理论【作者】李娟;陈英【作者单位】绵阳师范学院化学与化学工程学院,四川绵阳 621006;绵阳师范学院化学与化学工程学院,四川绵阳 621006【正文语种】中文【中图分类】G642.10 引言结构化学是研究原子、分子和晶体的结构以及结构与物质理化性质之间相互关系的一门学科,在科学研究、国防事业等各方面有着广泛应用.它是高等学校化学专业的一门重要的专业基础课,与无机化学、有机化学、物理化学等课程相衔接. 通过结构化学的学习可使学生进一步掌握微观物质运动的基本规律,获得关于原子、分子和晶体结构的基本理论及基础知识,深入理解结构和性质之间的关系;了解研究分子和晶体结构的近代物理实验方法和学科发展动态;深化对前修课程的理解,为学习后续课程、阅读化学文献和从事科学研究打下基础.结构化学的经典教材有北京大学出版社出版的周公度、段连云的《结构化学基础》,高等教育出版社出版的潘道凯、赵成大等的《结构化学》;兰州大学李炳瑞的《结构化学》等[1-4].结构化学教材均是以量子力学的基本方法为主线,先介绍量子力学的基本原理,再用量子力学的方法处理最简单的微粒—原子,了解原子的结构,包括几个量子数的得来,意义和原子轨道的多种图形表示;再是双原子分子的结构、多原子分子的结构、晶体的结构等[5-8].量子力学是二十世纪物理学的两大支柱之一,电子、原子、分子等微观粒子的运动遵循量子力学的规律.量子力学是一个公理体系,所谓公理它不能用更基本的原理证明出来,而直接作为结论加以应用.量子力学作为一个公理体系,包含多个基本假设,从这些基本假设出发,结合适当的化学模型,通过数学方式的处理,得到一些重要的结论,用于解释和预测一些实验事实.上世纪20年代,几乎是同时建立了两个描述微观粒子运动规律的力学理论,一个是海森堡的矩阵力学,一个是薛定谔的波动方程,结构化学教材中普遍使用薛定谔的波动方程,它的数学工具是微分方程.1 结构化学的特点和学生的学习困难结构化学与别的化学学科有很大的不同,首先,它是用数学方式计算化学问题;其次,与别的学科知识交叉较多,知识体系介于物理和化学之间,属于物理化学的范畴;再者,结构化学的知识抽象,生涩难懂,需要学生在学习中具有严密的逻辑思维能力和良好的数学知识功底.另外,化学是一门经验科学,结构化学借助于现代物理测试技术的先进手段,对物质的电学性质、磁学性质、光学性质、热学、超导等物理性质进行测试,通过实验的方法为量子力学理论提供实践依据,从而了解原子排列和电子运动的规律.在结构化学教材中,或者说在量子化学的发展中,为解决不同的化学问题建立了多个化学模型,发展起了很多的理论、假设,采取了多种近似处理.比如一维势箱中的粒子模型、中心势场模型,波尔理论、价键理论、分子轨道理论、杂化轨道理论、价层电子对互斥理论、休克尔分子轨道理论、晶体的点阵结构理论,定核近似、休克尔近似等.由于这些理论较多,同学们容易把不同理论的处理过程和结果以及应用范围混为一坛,例如,针对共轭分子的结构,用一维势箱中的粒子模型和休克尔分子轨道理论处理的结果就大不一样;氧气分子的结构,用价键理论和简单分子轨道理论处理的结果也不一样.平时课后作业反映出同学们基本掌握了所学知识,但考试时发现很多同学又混淆了两个理论的知识.针对这种情况我在教学中采取了一些措施,下面是用一维势箱中的粒子模型和休克尔分子轨道理论处理共轭分子结构的两个教学过程的对比.2 一维势箱中的粒子模型和休克尔分子轨道理论教学过程对比2.1 一维无限深势箱模型的教学过程一维势箱中的粒子模型一般在教材的第一章,介绍完量子力学产生的背景,量子力学的基本假设后,同学们要理解这些假设很困难,往往会感叹结构化学太难,同时对量子力学这些原理如何处理微观粒子的运动问题充满好奇.因此,紧接着就建立一个抽象的物理模型——维无限深势箱中的粒子模型,并用量子力学方式对它进行处理,过程如下:2.1.1 建立一维无限深势箱模型一个粒子在一维空间运动,其势能V(χ)=0(0<χ<l);V(χ)=∞(χ≤0,χ≥l),如图1所示:势函数如一口无限深的深井,粒子被束缚在x轴的0~l区域内运动,此模型可用来粗略描述金属导体中自由电子和直链共轭多烯中Л电子的运动.图1 一维势箱中的粒子模型Fig.1 The particle model in one-dimensional box2.1.2 薛定谔方程的求解过程(1)先写出体系的哈密顿算符,再得到势箱内粒子运动应满足的薛定谔方程.在势箱内:在势箱外:由于V(x)=∞,ψ(x)=0(2)求解微分方程的通解,其通解为:(3)根据边界条件讨论微分方程的特解ψ必须是连续的函数,作为该体系的边界条件, 应有ψ(0)=0,ψ(l)=0.ψ(0)=Acos0+Bsin0=0⟹A×1+B×0⟹0⟹A=0⟹ψ(l)=0,即因为B≠0,否则会使x无论取何值ψ都为0,即ψ(x)=0,在势箱内找到离子的概率为0;n的取值也不能为0,若n=0,⟹又因为ћ≠0,m≠0,l≠0⟹E=0,使ψ(x)≡0,即在势箱中找到离子的概率为0,与事实不符,因此不能为0.⟹ψ(n),ψ(-n)在量子力学中表示同一个态,n 的负值可舍去,n称为量子数.ψ的特解:(4)用波函数ψ的归一化条件,确定待定系数B2.1.3 针对一维势箱中粒子的计算结果展开讨论(1)由能量公式可知,能量不能取连续的值,是量子化的; n=1的状态是能量最低的状态即基态,它不能为零,称为零点能,它表明微观粒子永远运动着.此处结合量子力学产生的背景中不确定关系式的知识,告诉同学们零点能的存在是不确定关系的必然结果(2)由能量公式可知,体系能量En与势箱长度l的平方成反比,势箱越宽,箱中粒子的活动范围越大,体系能量就越低.这种由于粒子活动范围增大引起的能量降低效应称为离域效应,结合无机化学、有机化学中离域效应的知识,掌握离域效应产生的理论原因.共轭多烯中对分子化学活性起主要作用的是Л电子,Л电子在整个共轭体系上做离域运动,共轭体系越大,Л电子能量越低,分子越稳定就是这个原因;共轭体系越大,能级间隔越小,吸收光谱红移也是这个道理.(3)波函数具有正交归一性,即对x作图,对x作图,由图可知:ψn(x)有正有负,而几率密度总是正的;ψn(x)=0的点叫节点(x=0,l除外),节点有n-1个;节点越多,能量越高.其它量子力学体系也有此规律,如原子体系、分子体系,所以可根据节点数(节面数)的多少来判断各种状态能量的高低.此处结合无机化学学习过的s原子轨道、p原子轨道、d原子轨道、f原子轨道的图形,和同学们一起找出它们的节面位置和形状,分析为什么ns<np<nd<nf的能量.由德布罗意关系式知:结合与作图的结果一致,说明德布罗意关系式这个假设的正确性.(5)探讨经典力学与量子力学的联系由粒子两相邻能级间的能差计算相对能差,可知当n趋近于∞时,相对能差趋近于零.表明当量子数n很大时,两相邻能级之间的差和能量本身相比可忽略不计,可认为能量是连续变化的,量子力学和经典力学趋于一致.2.1.4 应用一维势箱中粒子的结果处理一个链状共轭多烯分子先布置思考题“链型共轭分子辛四烯CH2CHCHCHCHCHCHCH2,在长波方向460 nm处出现第一强吸收峰,试按一维势箱模型估算该分子的长度.”让同学们思考、讨论解题入手的方向,再让同学自愿举手回答他的解题的思路,看看他的思路是否正确,是否完整,另外的同学可做补充.因为刚接触到量子力学的知识,本节课是同学们的第3次结构化学课,大家对这些结论的应用方式还很陌生,绝大多数同学都理不清解题的思路,找不到解题的突破口,特别是对“在长波方向460 nm处出现第一强吸收峰”不理解.接下来老师和同学们一起分析辛四烯中存在8中心8电子的共轭大π键,辛四烯是链状分子,可按一维势箱模型处理;n的取值范围为1、2、3、4、5、6、7、8;n的取值不同,能量的高低也不同,每个能级代表一条分子轨道.复习无机化学所学的知识,电子在原子轨道、分子轨道中的填充需满足能量最低原理、包利原理、洪特规则,基态时8个电子应分别填在n为1、2、3、4的成键分子轨道上,在n为5、6、7、8的分子轨道上没有电子,是空轨道.“在长波方向460 nm处出现第一强吸收峰”指电子的跃迁最容易,跃迁所需能量最小,能量最高的占据轨道为n等于4,能量最低的空轨道为n等于5,所需能量最小的跃迁为从n=4到n=5的跃迁.ΔE=E5-E4,对应波长为460 120 pm2.1.5 将一维势箱中粒子模型结果推广到三维势箱中对立方势箱:波函数与3个量子数的取值有直接关系,3个量子数的取值不同,波函数就不同;但3个量子数的取值不同,平方后相加却可能相同,因此能量是相同的,由此引出简并态,简并度的概念.例如ψ112、ψ121、ψ211对应三种不同的运动状态,但能量值相同,互为简并态,简并度为3.让同学们回答以下几个问题,加深理解并考查知识的掌握情况.(1)立方势箱能量的简并度为多少?(2)立方势箱能量的简并度为多少?(3)立方势箱能量E≤可能的运动状态有那些?2.1.6 应用二维势箱中粒子的结果处理一个环状共轭多烯分子先布置思考题“作为近似,苯分子中的π电子可以看成在边长为350 pm的二维方势箱中的运动,计算苯分子中π电子从基态跃迁到第一激发态所吸收光的波长.” 让同学们思考、讨论解题方法,再让同学回答他们拟定的解题思路,另外的同学可做补充.接下来老师和同学们一起分析苯分子中存在6中心6电子的共轭大π键,按二维方势箱模型,能级公式为存在简并轨道,当nx为1,ny为1时能量最低,能量为当nx为1,ny为2时的能量与nx为2,ny为1时的能量相同,为二重简并;当nx为2,ny为2时能量为当nx为1,ny为3时的能量与nx为3,ny为1时的能量相同,为二重简并.每条分子轨道中可容纳2个电子,因此ψ11,ψ12,ψ21为成键轨道,ψ22,ψ13,ψ31为反键轨道.基态时,3条成键轨道中各填2个电子,即成键轨道全被电子占据,反键轨道均为空轨道.从基态跃迁到第一激发态意味着跃迁所需的能量最小,因此应该是从最高占据轨道跃迁到最低空轨道.苯分子能量最高的占据轨道为ψ12,ψ21,能量最低的空轨道为ψ22,因此苯分子中π电子从基态跃迁到第一激发态所需要的能量为ΔE=E22-E12=hc/λ,代入数据得到所吸收光的波长为134.6 nm.3 休克尔分子轨道理论的教学过程休克尔分子轨道理论是多原子分子的结构一章中的学习内容,此前同学们已经学习了原子的结构、双原子分子的结构、掌握了单电子近似、中心力场屏蔽近似、用线性变分法处理了氢分子离子的结构、了解了库伦积分、交换积分、重叠积分的含义,久期行列式、杂化轨道、价层电子对互斥理论等知识.共轭分子有特殊的物理化学性质,例如分子呈平面构型,有特征的紫外吸收光谱,有特定的化学性能等.1931年,休克尔(Huckel)应用原子轨道线性组合分子轨道的方法,并采用简化处理,引入了一些近似来预测共轭分子同系物的性质,分子的稳定性和化学反应性能,解释电子光谱.以下为休克尔分子轨道理论的教学过程.3.1 阐述HMO理论的基本要点得到休克尔行列式3.1.1 休克尔采用的σ-π分离近似和π电子近似有机共轭分子共平面,所有C原子的原子轨道和分子轨道分成两类,一类为采取sp2杂化的σ轨道及其基函数,如果以分子平面为反映面,它是对称的.另一类为π轨道及其基函数,如果以分子平面为反映面,它是反对称的.休克尔在讨论共轭分子的结构时,把σ电子和π电子分开处理,称σ-π分离近似.在讨论π电子时,把原子核、内层电子、非键电子、σ电子一起作为一个整体,构成分子的骨架,由于π电子在化学反应中比σ电子更加活泼,在量子化学的处理过程中,只讨论π电子,即π电子近似.3.1.2 单电子近似单电子近似在多电子原子、双原子分子、多原子分子的学习中已多次用到,联系以往的应用过程,强调共轭分子中每个π电子的运动状态均可用单电子波函数ψi来描述,ψi即π分子轨道.3.1.3 LCAO—MO近似在双原子分子的结构与性质一章中,同学们已学习了原子轨道的对称性、分子轨道的对称性以及成键三原则,并用线性变分法处理了氢分子离子的结构,但到本章的学习时,很多同学记忆已经模糊了,因此需要先用几分钟复习、回顾以前的知识,再指出离域π轨道是由对称性相同的各个C原子的2pz轨道进行线性组合而成,每个C原子提供一个2pz轨道φi,组合系数由线性变分法确定.代入变分积分公式展开并引入积分Hii,Hij,Sij,进一步利用能量极小值时得久期方程组.此久期方程中,组合系数有不全为零解的条件是系数行列式为零,得到久期行列式.3.1.4 休克尔近似库仑积分不考虑C原子位置的差别,每个C原子2pz电子的能量均近似为0.交换积分相邻C原子间的交换积分均为β,当原子间的距离在合理的范围内β为负值.重叠积分不考虑所有原子间2pz的重叠作用,即使相邻原子间也不考虑.在休克尔近似的基础上,链式共轭烯烃的久期行列式简化为:令进一步简化休克尔行列式,得简化的久期方程为:解出χi(i=1,2……n),求出对应的Ei=α-βχi;再将xi代回久期方程,利用归一化条件:求得分子轨道组合系数cki,进而得到π轨道ψi.3.2 HMO法对共轭烯烃处理的一般结果3.2.1 HMO法处理直链共轭多烯的一般结果含n个碳原子的链状多烯,久期行列式展开后得到:Dn(χ)=xDn-1(χ)-Dn-2(χ)已知:D1(χ)=x;D2(χ)=χ2-1若j表示π分子轨道的序数,r表示碳原子的序数则:3.2.2 HMO法处理单环共轭多烯的一般结果含n个碳原子的单环共轭多烯,久期行列式展开后:若j为π分子轨道的序数,r为碳原子的序数,则:(复函数形式) j=0,1,2,…,n-13.2.3 HMO法处理苯分子和辛四烯对于苯分子,碳原子采用sp2杂化成键,碳骨架呈平面六边形,苯分子结构如图2所示,2Pz轨道线性组合成分子轨道:ψ=c1φ1+c2φ2+c3φ3+c4φ4+c5φ5+c6φ6图2 苯分子的结构图Fig.2 The structure of the benzene molecule久期行列式为:展开久期行列式得:χ6-6χ4+9χ2-4=0 因为⟹(χ-1)2(χ+1)2(χ2-4)=0解得各能级的能量为:图3 苯的π分子轨道图形Fig.3 the orbital pattern of molecular for benzene χ1=-2 E1=α+2βχ2=χ3=-1 E2=E3=α+βχ4=χ5=1 E4=E5=α-βχ6=2 E6=α-2β相应的6个分子轨道的波函数为:苯的6条π分子轨道的图形如图3所示,由图3可知,ψ1没有节面,ψ2、ψ3有1个节面,ψ4、ψ5有2个节面,ψ6有3个节面;ψ1的能量最低,ψ2、ψ3的能量次之,ψ4、ψ5的更高,ψ6的能量最高,再一次印证了一维势箱中的粒子模型中节面越多能量越高的结论.按休克尔分子轨道理论,苯分子中也存在能级简并状态,ψ1无简并能级,ψ2、ψ3的能级是简并的,ψ4、ψ5的能级是简并的,ψ6无简并能级.用休克尔分子轨道理论处理辛四烯,可得各π分子轨道的能量为E1=α+2βcos20° E2=α+2βcos40° E3=α+2βcos60° E4=α+2βcos80°E5=α+2βcos100° E6=α+2βcos120° E7=α+2βcos140° E8=α+2βcos160°各能级均没有简并态.4 结论由以上教学过程可知,用一维势箱中的粒子模型和休克尔分子轨道理论处理共轭分子辛四烯和苯分子的结构,结论是完全不一致的.这种情况在结构化学的学习中时有发生,因此教学过程中一定要强调各个理论的适用范围,反复比较各理论的异同点;另外教学中教师要充分了解同学们的知识储备情况,相关知识要相互印证,前后联系,并与无机化学、有机化学的知识相互衔接、对比,对提高教学质量很有帮助.参考文献:[1] 周公度,段连运.结构化学基础[M].北京:北京大学出版社,1995.[2] 潘道皑.物质结构[M].北京:高等教育出版社,1989.[3] 李炳瑞.结构化学[M].北京:高等教育出版社,2011.[4] 金燕仙,闫华,钟爱国,等.《结构化学》教学方法探析[J].广州化工,2011(4):145-146+15.[5] 唐敖庆,江元生.分子轨道图形理论[M].北京:科学出版社,1980.[6] 叶世勇,费鹏.一维势箱模型与休克尔分子轨道理论的关系[J].安徽师范大学学报(自然科学版)2007(11);672-674.[7] 郭洪,孙成科,林雪飞,等.休克尔分子轨道(HMO)法的应用[J].曲靖师范学院学报,2008(11):1-5.[8] STREIWIESER A.Molecular orbital theory for organic chemists[M].NewYork:wiley,1961.。