钠及其化合物(知识网络)复习进程
- 格式:ppt
- 大小:87.50 KB
- 文档页数:3

金属钠及其化合物知识归纳及巩固一、钠:I 、钠原子结构钠元素位于元素周期表第三周期第IA 。
从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na +)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
II 、钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm 3),熔点低,是电和热的良导体。
III 、钠的化学性质由于钠原子最外层只有一个电子,在化学反应中容易失去最外层的一个电子变为钠离子:Na -e -→Na+所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1. 与非金属反应 (1)与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O 2=2Na 2O 在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
2Na+O 2Na 2O 2(2)与硫反应 2Na+S=Na 2S (研磨易爆炸) (3)与氯气反应 2Na+Cl 2 2NaCl (发出黄色火焰,产生白烟)2. 与水反应钠与水反应的化学方程式为:2Na+2H 2O=2NaOH+H 2↑该反应的实质是钠原子与水电离出的H +发生氧化还原反应,其离子方程式为:2Na+2H 2O=2Na ++2OH -+H 2↑注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
3. 与酸反应 钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应 2Na+2HCl=2NaCl+H 2↑钠与稀硫酸反应 2Na+H 2SO 4 =Na 2SO 4 +H 2↑钠与酸溶液反应的实质是:钠与酸电离出来的H +直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。
因为钠与水反应时,得电子的是水电离的H +,而酸中H +浓度大于水中H +的浓度。
4. 与盐的反应 与熔融盐的反应 4Na+TiCl 4(熔融) =Ti+4NaCl 与盐溶液反应 将钠加到盐溶液中,首先是钠与水反应,若生成的氢氧化钠与盐能发生复分解反应,生成难溶物或弱电解质等,则氢氧化钠和盐再反应;否点燃点燃则钠只与水反应。

金属元素及其化合物-------钠及其化合物碱金属
【知识网络】
【基础知识】
1、钠的结构、性质、保存
(1)钠原子的结构特点
钠原子最外层只有电子,在化学反应中易失去最外层的一个电子,因此。
(2)性质
1钠与非金属反应:O2(缓慢氧化生成Na2O,燃烧生成的Na2O2)、S等。
2钠与水的反应:(现象:熔、浮、游、红)3钠与酸的反应: (先与酸反应,过量的钠再与水反应) 4钠与盐溶液的反应:先与水反应生成碱,再考虑碱与盐的反应。
5钠与有机物的反应:与醇、酚、羧酸能发生反应置换出H2。
(3)钠的保存:钠应密封保存,少量的钠可保存在中。
2、氧化钠、过氧化钠的结构和性质(注意两者的比较)。

一轮复习第三章金属及其化合物第一讲钠及其化合物(第1课时)教学设计教学目标:知识与技能:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
过程与方法:1、学生自学基本了解钠及其化合物(氧化钠、过氧化钠)的性质。
2、通过思维导图引导学生知道如何复习元素化合物。
3、教师和学生共同通过思维导图学习钠、氧化钠、过氧化钠的性质及运用态度与价值观:1、使学生认识自学是很好且终生的学习的方法。
2、使学生认识思维导图是很好的学习工具。
教学重点:钠和过氧化钠的性质及其运用。
教学难点:学生对知识的整理与归纳的能力的培养。
教学过程:教学过程教学目标教学内容活动设计考纲解读使学生知道学习的方向和要点钠及其化合物在高考纲要求:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
考纲解读:1、掌握钠、过氧化钠、碳酸钠和碳酸氢钠的性质及其运用。
考中的要求和考试形式。
2.了解氧化钠和氢氧化钠。
展示导图:考情分析:此部分内容在选择题和大题中都有可能出现,通常以钠及其化合物考察NA、物质结构、电学、电离和水解等方面。
引导分析了解学习某物质的方法某物质应了解或掌握的内容1、与学生共同回顾在学习元素化合物时通常要知道其哪些方面。
2、展示导图。
思考完善学生用思维导图自学复习钠的性质及用途复习钠的性质及用途学生结合前面讨论完善自己的思维导图。
学生讲述1.培养学生归纳总结的能力2.复习钠的制法、物理性质、化学性质、用钠的制法、物理性质、化学性质、用途及制请优秀学生讲述他的思维导图中关于单质钠的部分。
途及制法法教师作品展示1.巩固钠的相关性质。
2.指导学生思维导图的绘制。
钠的制法、物理性质、化学性质、用途及制法1.展示教师的钠单质的思维导图。
2.与学生作品比较,指出各自的优缺点。
练习巩固、检测钠的相关性质钠的相关性质过渡引入钠的氧化物的复习思维导图体现了每个人对知识的理解认知程度,也是个性的充分表现。
用心画好每张图。
愉快的欣赏每张图,学习是快乐的,生活是美好的。


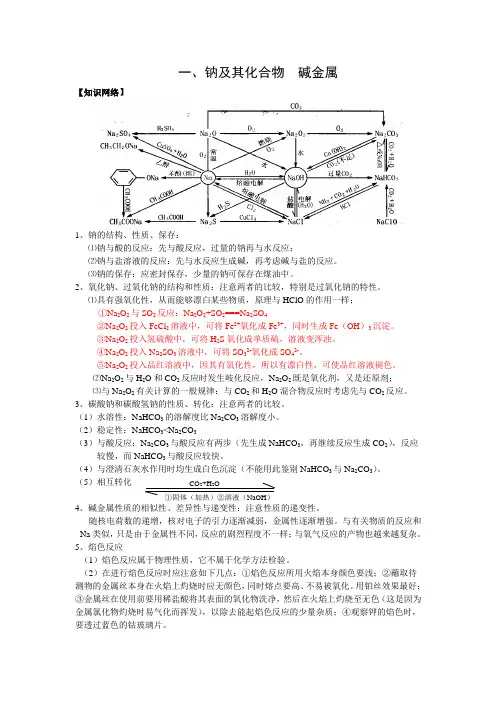
一、钠及其化合物 碱金属【知识网络】1、钠的结构、性质、保存:⑴钠与酸的反应:先与酸反应,过量的钠再与水反应;⑵钠与盐溶液的反应:先与水反应生成碱,再考虑碱与盐的反应。
⑶钠的保存:应密封保存,少量的钠可保存在煤油中。
2、氧化钠、过氧化钠的结构和性质:注意两者的比较,特别是过氧化钠的特性。
⑴具有强氧化性,从而能够漂白某些物质,原理与HClO 的作用一样;①Na 2O 2与SO 2反应:Na 2O 2+SO 2===Na 2SO 4②Na 2O 2投入FeCl 2溶液中,可将Fe 2+氧化成Fe 3+,同时生成Fe (OH )3沉淀。
③Na 2O 2投入氢硫酸中,可将H 2S 氧化成单质硫,溶液变浑浊。
④Na 2O 2投入Na 2SO 3溶液中,可将SO 32-氧化成SO 42-。
⑤Na 2O 2投入品红溶液中,因其有氧化性,所以有漂白性,可使品红溶液褪色。
⑵Na 2O 2与H 2O 和CO 2反应时发生岐化反应,Na 2O 2既是氧化剂,又是还原剂; ⑶与Na 2O 2有关计算的一般规律:与CO 2和H 2O 混合物反应时考虑先与CO 2反应。
3、碳酸钠和碳酸氢钠的性质、转化:注意两者的比较。
(1)水溶性:NaHCO 3的溶解度比Na 2CO 3溶解度小。
(2)稳定性:NaHCO 3<Na 2CO 3(3)与酸反应:Na 2CO 3与酸反应有两步(先生成NaHCO 3,再继续反应生成CO 2),反应较慢,而NaHCO 3与酸反应较快。
(4)与澄清石灰水作用时均生成白色沉淀(不能用此鉴别NaHCO 3与Na 2CO 3)。
(5)相互转化 4、碱金属性质的相似性、差异性与递变性:注意性质的递变性。
随核电荷数的递增,核对电子的引力逐渐减弱,金属性逐渐增强。
与有关物质的反应和Na 类似,只是由于金属性不同,反应的剧烈程度不一样;与氧气反应的产物也越来越复杂。
5、焰色反应(1)焰色反应属于物理性质,它不属于化学方法检验。



第一讲钠及其化合物【考纲要求】1.钠的性质及用途。
2.Na2O 和 Na2O2的性质及用途。
3. Na2CO3 、NaHCO3 、NaOH的性质及用途。
4. Na2O2 与 H2O、CO2 的反应原理,以及反应前后气体体积差和质量差在计算中的应用。
碱金属元素【考纲要求】1.碱金属元素的原子结构的相似性及递变性。
2.碱金属单质的性质的相似性及递变性。
3.焰色反应。
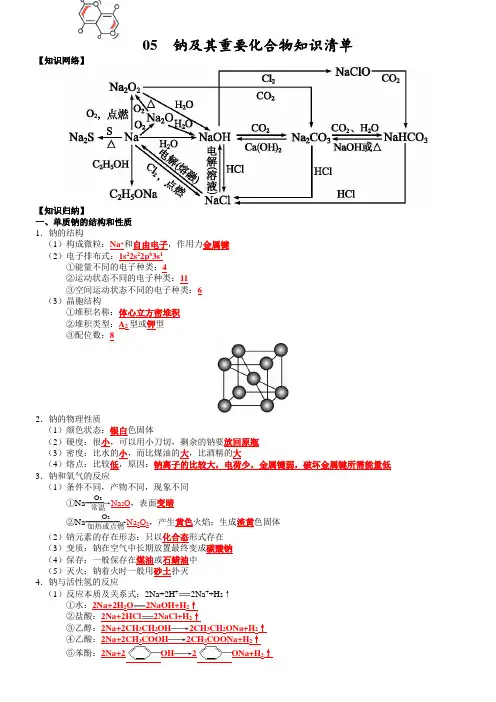
碱金属元素基础知识一.金属钠(可保存在中)1、钠的化学性质钠的原子结构示意图:跟非金属反应:(O2、Cl2、S)对应的化学方程式:、、(2)与H+反应(H2O、酸、盐溶液)①钠与水反应,标出电子转移:现象及解释:浮:熔:游:产生气体,在水面上向各方迅速游动最后消失 .嘶红:②钠与盐酸离子方程式:③钠投入硫酸铜溶液中化学方程式:(3)与有机物反应(醇、酚、羧酸)与乙醇化学方程式:二、钠的化合物1、Na2O2:颜色状态电子式: 用途: 与H2O 、CO2化学方程式2、Na2CO3 与NaHCO3Na2CO3 俗名:色态:溶解性:热稳定性:NaHCO3俗名:色态:溶解性:热稳定性:Na2CO3 和NaHCO3分别与酸反应速率:V(Na2CO3)V(NaHCO3)三、钠及化合物之间的关系Na2O2Na Na2O NaO H Na2CO3 NaHCO3(方程式写在背面)四、碱金属元素包括()1、递变规律:从上到下原子半径,原子核对最外层电子的束缚力,失电子能力,元素的金属性,单质的还原性,与水或酸反应置换出氢的能力,最高价氧化物的水化物性.2、锂与氧气化学方程式:钾与氧气化学方程式:3、焰色反应操作步骤:将放在酒精灯上灼烧至与原来颜色相同,蘸取待测溶液,在酒精灯上灼烧,钠为色,钾为色(需透过),用洗净铂丝.。

钠及其化合物知识复习指要
颜建河
【期刊名称】《数理化学习(高一二版)》
【年(卷),期】2012(000)009
【摘要】碱金属是典型的金属元素,是学生学习的第一个金属元素族,其所涉及的代表物——钠及其化合物知识,是金属及其化合物一章学习的核心知识,并渗透到整个中学化学学习的各个阶段之中,是学习的重点内容之一.为此,
【总页数】4页(P23-26)
【作者】颜建河
【作者单位】河北省衡水市故城县教育局,253800
【正文语种】中文
【中图分类】G633.8
【相关文献】
1.钠及其化合物知识复习指要 [J], 颜建河
2.谈课程标准对元素化合物知识的教学要求——以"钠及其化合物"为例 [J], 林海斌
3.指向深度学习的高中化学事实性知识内涵深究及教学建议\r——以\"钠及其化合物\"为例 [J], 郭为;卢伟
4.核心素养导向下的元素化合物知识教学——以"钠与水溶液的反应"为例 [J], 逯漫
5.钠及其化合物知识归纳及典例解析 [J], 尉言勋
因版权原因,仅展示原文概要,查看原文内容请购买。
课程篇基于关键能力培养的高中化学教学实践———以“钠及其化合物”高三复习课为例李耀佳(广州市番禺区象贤中学,广东广州)高三第一轮复习由于时间短、内容多,很多老师急于赶进度,已经习惯于“知识梳理,考题选讲,练习强化”这种模式教学,导致课堂过于沉闷,不能激发学生的学习兴趣。
这种复习还有另外一个弊端,对知识点复习只是蜻蜓点水,课堂上学生没有经过深度学习、深度思考,学生的关键能力没有得到培养。
因此学生会出现这样的现象:知识点背诵熟练,做了很多的题目,但是考试成绩依然无法提高。
高考是能力测试为主导的考试,对学生的逻辑思维、整合信息等能力有一定的要求。
能力是可以经过训练得到的,绝不是一蹴而就的,简单的知识传授不能全面培养学生的能力。
因此在平常的教学过程中,教师需要关注学生能力的培养。
化学关键能力的要素包括化学表征能力、实验与探究能力、化学方法和分析能力、化学信息处理能力、发现与提出问题的能力、证据推理与论证能力、模型认知能力[1]。
这些能力都属于高阶能力,培养能力最有效的策略在于思维的训练,而引发思维训练需要问题引领。
因此课堂设置深度的问题可以引发思维向深度发展,从而发展关键能力。
如何设置深度问题培养化学学科关键能力?以下笔者以“钠及其化合物”高三复习课为例,通过巧设情境、重组实验、设置认知冲突、创建开放性问题等策略复习元素化合物知识所进行的实践研究,具体教学设计如下图:1备2验3置情境4建开放问题能力线纳为什么能换出过钠的漂白性原鉴和碳酸获取与加工能力设案:测定碳酸的纯度证据理能力推证能批判性维能力实能案评价能力一、教学目标1.完成“以氯化钠为原料制备碳酸钠”转化任务,促进学生自主构建钠及其化合物的知识网络,夯实基础。
2.以钠及其化合物性质的探究,通过“情境—设问—解决策略”培养学生的信息获取和加工、实验探究和证据推理、批判性思维和方案评价等关键能力。
二、教学流程环节一:完成“转化任务”,为能力发展打下坚实的基础。