高三化学计量数专题
- 格式:docx
- 大小:25.67 KB
- 文档页数:5

2020届高三化学题型强化训练——化学计量的相关计算1 / 252020届届届届届届届届届届届——届届届届届届届届届一、单选题(本大题共20小题,共40分)1. 标准状况下,将VLA 气体(摩尔质量为M g/mol)溶于0.1L 水中,所得溶液密度为ρg/mL ,则此溶液物质的量浓度为( )A. VρMV+2240 mol/LB. 1000VρMV+2240 mol/LC. 100VρMV+2240 mol/LD. 1000+VρMMV+2240 mol/L2. 在200mL 含Mg 2+、Al 3+、NH 4+、H +、Cl −等离子的溶液中,逐滴加入4mol/L 的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述正确的是( )A. 原溶液中n(Mg 2+):n(Al 3+)=10:1B. 原溶液中的c(H +)=0.8mol/LC. x 与y 的差值为0.01molD. 原溶液中c(Cl −)=0.66mol/L3. 往含0.2mol NaOH 和0.1mol Ba(OH)2的溶液中持续稳定地通入CO 2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO 2气体的体积关系正确的图象是(气体的溶解忽略不计)( )A. B.C. D.4. 1.52g铜镁合金完全溶解于50mL密度为1.40g⋅mL−1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol⋅L−1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是()A. 该合金中铜与镁的物质的量之比是1:2B. 该浓硝酸中HNO3的物质的量浓度是14.0mol⋅L−1C. NO2和N2O4的混合气体中,NO2的体积分数是80%D. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL5.将一定量Mg、Al合金溶于1mol⋅L−1的HCl溶液中,进而向所得溶液中滴加1mol⋅L−1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下。

第二讲中学化学常用计量中的常考问题1.(2019·江苏化学,8)设N A表示阿伏加德罗常数的值。
下列说法正确的是( )。
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1N AB.常温常压下,18 g H2O中含有的原子总数为3N AC.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5N AD.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N A2.(2019·四川理综,7)设N A为阿伏加德罗常数的值,下列叙述正确的是( )。
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5N AB.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为N AC.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N AD.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6N A3.(2019·广东理综,9)设n A为阿伏加德罗常数的值,下列说法正确的是( )。
A.常温下,23 g NO2含有n A个氧原子B.1 L 0.1 mol·L-1氨水含有0.1n A个OH-C.常温常压下,22.4 L CCl4含有n A个CCl4分子D.1 mol Fe2+与足量的H2O2溶液反应,转移2n A个电子4.(2019·新课标全国理综,7)下列叙述正确的是( )。
A.1.00 mol NaCl中含有6.02×1023个NaCl分子B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠考查形式选择题考向曝光2019年会继续考查阿伏加德罗常数,主要从概念的内涵、物质在标准状况下的状态、溶液的体积及在溶液中的存在形式等角度设问;借助阿伏加德罗定律考查气体的体积、分子数、密度与温度和压强等量之间的关系将成为另一热点。

高考化学二轮专题 02 化学中的常用计量姓名:________ 班级:________ 成绩:________一、单选题 (共12题;共24分)1. (2分) (2016高三上·伊宁开学考) 用NA表示阿伏加德罗常数的值,下列说法正确的是()A . 在标准状况下22.4L H2O中含有氢原子的个数为2NAB . 2.7g 铝与足量的盐酸反应时失去的电子数为0.3NAC . 1mol/L NaCl溶液中含有钠离子的个数为NAD . 常温常压下,11.2 L氧气含有的原子数目为NA2. (2分) (2016高三上·赣州开学考) 设NA代表阿伏加德罗常数的数值,则下列说法正确的是()A . 1.8 g D2O含有NA个中子B . 用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NAC . 在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2D . 25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C﹣H键3. (2分) (2016高三上·大连开学考) NA代表阿伏加德罗常数的值.下列叙述正确的是()A . 标准状况下,2.24L戊烷中存在的共价键总数为1.6NAB . 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NAC . 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NAD . 1L0.1mol•L﹣1的NaH2PO4溶液中H2PO4﹣、HPO42﹣和PO43﹣离子数之和为0.1NA4. (2分) (2018高一上·南宁月考) 下列混合气体中,与同温同压同体积的CO气体原子数一定相等的是()A . HCl与O3B . H2与NH3C . N2与O2D . He与NO5. (2分) (2016高三上·襄阳开学考) 设NA为阿伏伽德罗常数的值,下列叙述正确的是()A . 10gT2O含有的电子数为5NAB . 常温下,0.2L 0.5mol•L﹣1NH4NO3溶液的氮原子数小于0.2NAC . 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NAD . 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA6. (2分) (2018高一上·南阳期中) 在标准状况下,13g某气体所含的分子数与14gCO所含的分子数相等。

第2讲化学常用计量1.(2010·赣州市质检)在化学学科中经常使用下列物理量,其中跟阿伏加德罗常数(N A)无关的组合是( )①相对原子质量;②摩尔质量(g/mol);③原子半径;④中和热(kJ/mol);⑤物质的量;⑥化学反应速率[mol/(L·s)];⑦气体摩尔体积(L/mol);⑧溶解度;⑨燃烧热(kJ/mol);⑩溶质的质量分数A.①③⑧⑩B.②④⑤⑥⑦⑨C.①②③④⑤D.⑥⑦⑧⑨⑩解析:根据物理量的单位,可以判断其与阿伏加德罗常数是否有关,相对原子质量、溶质的质量分数为具体数值,原子半径的单位为nm,溶解度的单位为g,这些物理量与阿伏加德罗常数均无关。答案:A2.(2010·南昌市调研)设N A为阿伏加德罗常数,下列说法正确的是( )A.1 mol氧单质一定含有2 N A个氧原子B.含4 mol Si—O键的石英晶体中含氧原子数为4 N AC.6.8 g液态 KHSO4中含有0.05 N A个阳离子D.1 mol H3O+中含质子数为10 N A解析:A选项,氧单质指代不明,可能是O2或O3;B选项,1 mol SiO2含有4 mol Si—O键,故含有4 mol Si—O键的石英晶体中含有2 mol O;D选项,1 mol H3O+含有的质子为11 mol。答案:C3.(2010·武汉市武昌区调研)设N A为阿伏加德罗常数,下列说法正确的是( )A.电解精炼铜过程中,电路中每通过N A个电子,阳极溶解铜32 gB.1 L 2 mol/L的NH4Cl溶液中含NH+4数目为2 N AC.5.6 g铁粉与硝酸反应失去的电子数一定为0.3 N AD.1 mol C20H42的分子中含有的共价键数目为61 N A解析:电解精炼铜时,粗铜作阳极,由于粗铜中含有杂质Fe、Ni等,电路中每通过N A个电子,阳极溶解铜小于32 g,A错;1 L 2 mol/L的NH4Cl溶液中NH+4会发生水解,故其数目小于2 N A,B错;铁粉与硝酸反应时,由于硝酸用量的不同可能生成Fe2+(少量硝酸)或Fe3+(过量硝酸),因此5.6 g铁粉与硝酸反应时失去的电子数为0.2 N A~0.3 N A,C错;1 mol C20H42中含有共价键数目为2044212⨯+⨯×N A=61 N A,D对。答案:D4.(2010·江西省高三联考)如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。下列判断正确的是(不考虑NO2转化为N2O4)( )A.开始时左右两室分子数相同B.反应前后NO室压强相同C.最终容器内密度与原来相同D.最终容器内无O2存在解析:由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,而NO 和O 2的摩尔质量不相等,故其物质的量不相等,开始时左右两室分子数不相同,故A 错误。由于反应后NO 室的气体物质的量要减小,故压强要减小,B 错误。由于NO 与O 2反应,O 2过量,故最终容器内有O 2存在,D 错误。答案:C5.(2010·江西省重点中学第二次联考)在4℃时向100 mL 水中溶解了22.4 L HCl 气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )A.该溶液物质的量浓度为10 mol/LB.所得溶液的体积为22.5 LC.根据题干数据,该溶液物质的量浓度无法求得D.该溶液中溶质的质量分数因溶液的密度未知而无法求得解析:该溶液的体积应该大于100 mL,溶液的质量为22.422.4/L L mol×36.5 g/mol+100 mL×1 g/mL=136.5 g,由于没有提供溶液的密度,无法计算出溶液的体积,因此该溶液的物质的量浓度无法计算,A 错、B 错、C 对;溶质的质量分数为36.5136.5g g×100%=26.7%,D 错。 答案:C6.(2010·江西省高三联考)在200 mL 某硫酸盐溶液中,含有1.5 N A 个硫酸根离子(N A 表示阿伏加德罗常数的值),同时含有N A 个金属离子。则该硫酸盐的物质的量浓度为( )A.1 mol ·L -1B.2.5 mol ·L -1C.5 mol ·L -1D.2 mol ·L -1解析:由硫酸盐溶液中含有1.5 N A 个硫酸根离子,同时含有N A 个金属离子,可知金属离子与硫酸根离子物质的量之比为2:3,故其化学式可表示为:M 2(SO 4)3,所以其物质的量浓度为0.5 mol/0.2 L=2.5 mol ·L -1。答案:B7.(2010·襄樊市调研)用N A 表示阿伏加德罗常数的值。下列叙述正确的是( )A.标准状况下的33.6 mL 氯气通入足量水中,转移电子数为1.5×10-3 N AB.标准状况下,22.4 L 四氯化碳中共价键数目为4 N AC.1L 浓度为1 mol ·L -1的Na 2CO 3溶液中含有3 N A 个离子D.合成氨反应达到平衡时,每形成N A 个N≡N 键的同时,就有6 N A 个N —H 键形成解析:反应Cl 2+H 2O===HCl+HClO 为可逆反应,不可能进行完全,因此33.6 mL 氯气通入足量水中,转移电子数小于1.5×10-3 N A ,A 错;标准状况下四氯化碳为液体,不能运用气体摩尔体积计算其物质的量,B 错;Na 2CO 3溶液中由于23CO -的水解反应:23CO -+H 2O===HCO -3+OH -,离子数目增多,因此1 L 浓度为1 mol/L 的该溶液中离子数目大于3N A ,C 错;根据N 2+3H 2===2NH 3,反应达平衡时,每生成1 mol N 2分子(形成1 mol N≡N 键)的同时生成2 mol NH 3分子(形成6 mol N —H 键),D 对。答案:D8.(2010·武汉市武昌区调研)设N A 为阿伏加德罗常数,下列叙述中正确的是( ) ①106 g Na 2CO 3晶体中的离子总数大于3 N A②标准状况下,16 g O 3和O 2混合气体中含有的氧原子数为N A③将0.1 mol NaCl 全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 N A④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2 N AA.①②B.②④C.①③D.③④解析:106 g碳酸钠晶体中的离子总数为3 N A,故①错误;由于胶体粒子是多个微粒的集合体,故③中所含的胶体粒子数目小于0.1 N A,错误;④中由于1 mol N2和3 mol H2发生可逆反应,反应不能进行完全,故反应后气体分子数要大于2 N A,④正确。答案:B9.(2010·石家庄质检(一))下列各组中两种气体所含的原子数一定相等的是( )A.质量相等、密度不等的N2和COB.温度相同、体积相同的O2和N2C.体积相等、密度相等的CO和C2H4D.压强相同、体积相同的N2和O2解析:A项,氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,故原子数一定相等;B项,压强不一定相等,则两气体的物质的量不一定相等;C项,体积和密度相等,则两气体的质量相等,由于摩尔质量相等,则两者的物质的量相等,则原子数之比为1:3;D项,温度不一定相同,则原子数不一定相等。答案:A10.(2010·北京市目标检测)已知Ca(OH)2的溶解度随温度的升高而降低。将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( )A.溶液中Ca2+的数目B.溶剂的质量C.溶液中溶质的物质的量浓度D.溶质的质量解析:将40℃的饱和澄清石灰水冷却至10℃时,此时溶液是不饱和溶液,溶液中溶质质量、溶剂质量均不变,所以溶液中Ca(OH)2的物质的量浓度不变。保持40℃向其中加入少量CaO,CaO与H2O反应导致溶剂质量减少,有部分Ca(OH)2晶体析出,但溶液仍是40℃时的饱和溶液,所以Ca(OH)2的物质的量浓度不变,综合上述知选项C正确。答案:C11.(2010·黄冈市质检)某同学用NaHCO3和KHCO3组成的混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如下表:下列分析推理不正确的是( )A.盐酸的物质的量浓度为3.0 mol/LB.根据表中数据能计算混合物中NaHCO3的质量分数C.加入9.2 g混合物时盐酸过量D.15.7 g混合物恰好与盐酸完全反应解析:A项,由表中数据可知,求盐酸浓度需选择盐酸不足量的数据进行,如随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,H++HCO-3=H2O+CO2↑,c(HCl)=3.3622.4/0.050LL molL=3 .0 mol/L,正确;B项,根据表中第一栏数据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数,正确;C 项,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故盐酸过量,正确;D 项,根据固体混合物与气体的比例关系可知,产生3.36 L二氧化碳所需固体质量为:9.22.243.36m=,解得m=13.8 g,此时盐酸恰好完全反应,故不正确。答案:D12.(2010·四川省摸底考试)现有6 g含有杂质的亚硫酸钠固体,与足量的盐酸反应产生标况下1.12 L气体,并测得该气体的相对分子质量为60,则固体中所含的杂质可能是( )A.Na2CO3B.NaHCO3C.Na2CO3和NaHCO3D.Na2SO4解析:气体相对分子质量为60,说明气体为二氧化硫和二氧化碳的混合气体。由十字交叉法得故可得n(SO2)=0.04 mol,n(CO2)=0.01 mol。若杂质为Na2CO3,则m(Na2CO3)=0.01×106=1.06(g),m(Na2SO3)=5.04 g,故m总=1.06 g+5.04 g=6.1 g>6 g,不符合题意;若杂质为NaHCO3,m(NaHCO3)=0.01×84=0.84(g),则m总=0.84 g+5.04 g=5.88 g<6 g,不符合题意;根据平均值原理知,答案为C。答案:C13.(2010·赣州市质检)一定条件下,4 g A和14 g B的混合气体体积为448 mL,相同状况下,8 g A和17 g B的混合气体体积为672 mL,A、B可能是下列各组中的( )A.乙烯和乙炔B.乙炔和苯C.甲烷和甲醇D.环己烷和丁烯解析:设A、B的摩尔质量分别为x g/mol、y g/mol。由于在相同状况下,两组混合气体的体积比等于物质的量之比,则有(414817):(x y x y++)=448:672,解得:x:y=1:2,只有C项符合。答案:C14.如图所示的实验装置可用来测定含两种元素的某种气体X的化学式。在注射器A中装有240 mL气体X,慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管总重20.32 g,实验后B管总重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:(1)X气体是由________和________元素组成的。(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24000 mL,则X的摩尔质量是________g/mol。(3)通过计算,确定X的化学式为________。(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________________。解析:在C管中收集到水,则X中一定含有氢元素;在D中收集到N2,说明X中一定含有N 元素,即X中含N、H两种元素。B管中CuO含O:20.32 g-20.00 g=0.32 g,n(O)=0.3216/gg mol=0.02 mol,n(N2)=0.2828/gg mol=0.01 mol,本实验条件下V m=24 L/mol,所以n(X)=0.2424/LL mol=0.01 mol,因此n(X):n(N):n(H)=0.01 mol:(0.01 mol×2):(0.02 mol×2)=1:2:4,所以X的化学式为N2H4,摩尔质量为32 g/mol。答案:(1)N H (2)32 (3)N2H4(4)N2H4+2CuO△ N2+2H2O+2Cu15.(2010·赣州质检)80℃,101 kPa下,用下图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A 筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化。(不考虑2NO2===N2O4)(1)C中发生反应的化学方程式是________________。已知原C中的气体是单一气体,它是________,理由是______________________________________________。(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前C中的气体是________,理由是____________________________________________________ 。(3)若实验开始前A、C中气体体积(换算成标况)分别为1.40 L和2.24 L,且A中的气体经过B管后,B管增重了1.40 g。经计算和推理可判定A中的气体是________,其质量为________g。(不必写出计算和推理过程)解析:(1)C中气体由无色变为红棕色,则发生了NO和O2转化为NO2的反应。(2)运用极限法,分别假设全部为NO或NO2,可以计算出与水反应后气体的体积变化,从而确定出C中气体为NO和NO2。(3)根据Na2O2与CO2的反应,B管增重的质量为与CO2等物质的量的CO的质量,因此n(CO2)=1.4028/gg mol=0.05 mol,而C筒中气体体积无变化,则A中另一种气体为O2,n(O2)=1.4022.4/LL mol-0.05 mol=0.0125 mol,故A中气体的质量为:0.05 mol×44g/mol+0.0125 mol×32 g/mol=2.6 g。答案:(1)2NO+O2=2NO2 NO NO与B管进来的O2反应生成NO2的体积与原NO体积相同,只发生了颜色变化(2)NO2和NO 若C管中只有NO2,则剩余气体的体积为原来的1/3,若只有NO,则剩余气体的体积与原来相等,因而只能是NO2与NO的混合气体(3:1)(3)CO2和O2 2.616.(2010·江西省高三联考)硝酸铜受热易分解:2Cu(NO3)2△ 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO高温2Cu2O+O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2===N2O4,2NO2=2NO+O2等反应)。现取5.64 g Cu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是________。(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况下)是________。(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是________。(4)设该质量的无水硝酸铜在分解过程中,得到的残留固体质量为x,生成的气体中NO2和O2的体积比为y,求y与x的关系式:________;________。解析:(1)由题意可知n[Cu(NO3)2]=0.03 mol,根据铜元素守恒可得n(CuO)=0.03mol,m(CuO)=2.4 g。(2)无水硝酸铜分解生成CuO时,生成的NO2与O2恰好与水完全反应,多余的气体为CuO分解生成的氧气,4CuO~O2,n(O2)=0.03/4=0.0075(mol),标准状况下的体积为0.168 L。(3)残留固体可能是CuO和Cu2O的混合物,也可能是CuO和Cu(NO3)2的混合物。若为CuO和Cu2O的混合物,则n(CuO)=0.02 mol, n(CuO)+2n(Cu2O)=0.03 mol, n(Cu2O)=0.005 mol, m(Cu2O)=0.72g, m(残留固体)=1.60 g+0.72 g=2.32 g; 若为CuO和Cu(NO3)2的混合物,则n(CuO)=0.02 mol, 则n(CuO)+n[Cu(NO3)2]=0.03 mol, n[Cu(NO3)2]=0.01mol,m[Cu(NO3)2]=1.88 g,m(残留固体)=1.60 g+1.88 g=3.48 g。(4)当残留固体为CuO和Cu(NO3)2的混合物或全部为CuO时,只发生反应:2Cu(NO3)2△ 2CuO+4NO2↑+O2↑,此时,NO2和O2的体积比为y=4,2.4 g≤x<5.64 g;当残留固体为CuO和Cu2O的混合物或全部为Cu2O时,设CuO的物质的量为m mol, Cu2O的物质的量为n mol,则n(CuO)+2n(Cu2O)=m+2n=0.03(mol),x=80m+144n,y=0.06/(0.015+0.5n),解得1.922.88yx =-,此时2.16g≤x<2.4g;另外,x=2.4 g时也符合1.922.88yx =-。答案:(1)2.4 g (2)O2 0.168 L (3)3.48 g或2.32 g (4)2.4g≤x<5.64 g,y=4 2.16g≤x≤2.4 g,1.922.88yx =-。


化学计量数专题 2 ★如何做关于物质的量及阿伏伽德罗常数的选择题?要注意什么?1、弄清几个有关物质的量的计算的公式以及相应公式应用的条件;物质的量 n=N/NA(粒子数除以阿伏加德罗常数)=m/M(质量除以摩尔质量)=V/Vm =C*V液(物质的量浓度乘以溶液的体积)2、了解物质的量和微粒间的对应关系;3、清楚各微粒间的关系,能够灵活的应用物质的量换算目标微粒数;在数值上:1 mol=1 N A≈6.02×10234、注意一些重要的理论知识,如转移电子计算,电离水解平衡,电化学等.★气体摩尔体积的适用范围是什么?使用气体摩尔体积时应注意什么?①必须是标准状况.在高中化学学习中取22.4L/mol②对象是任何气体,既包括纯净物又包括气体混合物.③22.4升是个近似数值.④单位是L/mol,而不是L.本人觉得;百炼成刚,多做题,做多了就会啦!1.设NA为阿伏加德罗常数的值。
下列叙述不正确的是A.7.80g Na2O2与5.85g NaCl所含阴离子数相等B.15g甲醛(HCHO)和乙酸的混合物中氧原子数为0. 5NAC.一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NAD.常温下,2L pH=12的Na2CO3溶液中含有OH—数目为0.02NA2、NA为阿伏加德罗常数的数值,下列说法中正确的是A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NAB. 1.0L 0.1mol?L—1水玻璃溶液中含有的阴离子数目为0.1NAC.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NAD.在标准状况下,2.24L的CH3CH2OH含有NA个分子3、下列有关阿伏伽德罗常数说法正确的是A.含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NAB.标况下,22.4L四氯化碳所含分子数大于NAC.0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NAD.电解267g熔融AlCl3,能生成3mol Cl2和54g金属铝4、设NA为阿伏加德罗常数的值,下列叙述正确的是A.标准状况下,33.6L HF中含有氟原子的数目为1.5NAB.常温常压下,9.2g二氧化氮和四氧化二氮的混合物含有氮原子的数目为0.2NAC.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NAD.0.1mol铁溶于足量氯水中,转移电子的总数为0.2NA5、用NA表示阿伏加德罗常数的值,下列叙述中错误的是( )A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NAB.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NAC.标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均为0.2NAD.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对6、设NA为阿伏加德罗常的数值,下列说法正确的是A.常温常压下,16g O3气体含有氧原子数为NAB.标准状况下,44.8L 四氯化碳含有的分子数为2NAC.0.1mol·L—1氧化铝溶液中含有Al3+数为0.1NAD .2.4g 金属镁变为镁离子时失去的电子数为0.1N A 7、下列说法正确的A .7.8g Na 2O 2中所含阴离子的物质的量是0.2molB .等物质的量的—CH 3与OH —所含电子数相等 C .35C12和37C12互为同素异形体D .1mol 乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×10238、设N A 表示阿伏加德罗常数的值,下列叙述正确的是A .1L 0.1 mol·L —1的CH 3COONa 溶液中CH 3COO —的总数是0.1N AB .常温常压下,1.6g O 2 和O 3 混合气体中质子总数为0.8 N AC .一定条件下,2mol SO 2 和 1mol O 2 发生反应,转移的电子总数一定是4N AD .1L 0.1mol·L —1的葡萄糖溶液中分子总数为0.1 N A9、设N A 为阿伏加德罗常数的数值,下列说法错误..的是 A .标准状况下,22.4 LCl 2和HCl 的混合气体中含原子总数为2N A B .256g S 8晶体中含S-S 键为7N A 个C .由1molCH 3COONa 和少量CH 3COOH 形成的中性溶液中,CH 3COO -数目为N A 个D .1 mol Na 与O 2完全反应,生成Na 2O 和Na 2O 2的混合物,转移电子总数N A 个10、N A 表示阿伏加德罗常数,下列叙述正确的是A .6.4 g 铜粉与足量硫粉充分反应,失去的电子数为0.2 N AB . Na 2O 2与足量H 2O 反应生成0.2molO 2,转移电子的数目为0.4 N AC .标准状况下,22.4 L 氯气与足量氢氧化钠溶液反应转移的电子数为2 N AD . 0.5 mol·L -1CuCl 2溶液中含有Cu 2+数小于0.5 N A 11、 N A 代表阿伏加德罗常数,下列说法不正确的是A .一定量的Fe 与含1mol HNO 3的稀硝酸恰好反应,则被还原的氮原子数小于N AB .1 L0.5mol /LNa 2CO 3溶液中含有的CO 32-数目为0.5N AC .标准状况下,2.24L Cl 2与足量的Mg 充分反应,转移的电子数目为0.2N AD .0.1mol CH 4所含的电子数为N A12、用N A 表示阿伏加德罗常数的值,下列叙述中正确的是 A .通常情况下,7.6g CS 2含有非极性键数目为0.4N A B .22.4L CO 气体与1mol N 2所含的电子数相等C .将7.8gNa 2O 2放入足量的水中,反应时转移0.1N A 电子D .25℃时,1L pH=13的Ba (OH )2溶液中含OH —数目为0.2N A13、用N A 表示阿伏加德罗常数,下列说法正确的是:A .用含0.1mol FeCl 3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1N AB .13gNO 2和33gN 2O 4混合气体中含N 原子数为N AC .28gCO 和22.4LN 2含有的分子数均为N AD .等物质的量的NH 4+和OH -含电子数均为10N A 14、用N A 表示阿佛加德罗常数的值。

1.(2022秋·黑龙江牡丹江·高三牡丹江一中校考专题练习)设A N 为阿伏伽德罗常数的值,下列说法正确的是A .1.0 L 1 mol/L 3AlCl 溶液中,3Al +的数目为A 1.0NB .0.2 mol 苯含有双键的数目为A 0.6NC .电解熔融2MgCl ,阴极增重1.2 g ,外电路中通过电子的数目为A 0.1ND .标准状况下22.4 L 3SO 的质量为80 g2.(2022秋·黑龙江牡丹江·高三牡丹江一中校考专题练习)设A N 为阿伏加德罗常数的值,下列说法正确的是A .32g 8S ()分子中含有的S -S 键数为A NB .标准状况下,2.24L 25C H OH 所含氢原子数为A 0.6NC .10.1mol L -⋅的23Na CO 溶液含23CO -的数目为A 0.1ND .在高温、高压和催化剂条件下,密闭容器中2g 2H 与足量2N 反应,转移电子数为A 2N 3.(2022秋·北京海淀·高三统考专题练习)设A N 为阿伏加德罗常数的值,下列说法正确的A .一定量的22Na O 溶于足量水,生成21.6gO 时转移电子的数目为A 0.2NB .在21.8gH O 与22.24LO 中含有的分子数相同,均为A 0.1NC .在1mol 由24C H 和36C H 的混合物中,含C -H 键的数目一定为A 5ND .在常温下,1Lp H 10=的23Na CO 溶液中含+H 的数目一定为-10A 10N4.(2022秋·北京海淀·高三统考专题练习)用A N 代表阿伏加德罗常数的数值。
下列说法中,正确的是A .0.1mol 碳酸钠和碳酸氢钠的混合物含有的氧原子数为A 0.3NB .标准状况下,22.4L 乙炔中σ键数为A N 、π键数为A 2NC .1100mL 1mol L -⋅醋酸溶液中含有的氢离子数为A 0.1ND .60g 二氧化硅晶体中含有Si O -键数为A 2N是实验室中常用的强氧化剂,在生物医药方面也有重要用途。

高三总复习—化学基本概念 第一讲 化学中的常用计量一、知识要点考点一 物质的量 摩尔质量 1. 物质的量(1)物质的量(n ):物质的量是表示含有一定数目粒子的集合体的物理量,单位为摩尔(mol)。
(2)物质的量的规范表示方法:(3)阿伏加德罗常数(N A ):0.012 kg 12C 所含的碳原子数为阿伏加德罗常数,其数值约为6.02×1023, 单位为:mol -1。
公式:N A =N n2. 摩尔质量(1)摩尔质量是单位物质的量的物质所具有的质量。
单位是g·mol -1。
公式:M =m n 。
(2)数值:以g·mol-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。
考点二 气体摩尔体积 阿伏加德罗定律 1. 影响物质体积大小的因素(1)构成物质的微粒的大小(物质的本性)。
(2)构成物质的微粒之间距离的大小(由温度与压强共同决定)。
(3)构成物质的微粒的多少(物质的量的大小)。
2. 气体摩尔体积(1)含义:单位物质的量的气体所占的体积,符号V m ,标准状况下,V m =22.4_L·mol -1。
(2)相关计算:①基本表达式:V m =V n②与气体质量的关系:m M =VV m③与气体分子数的关系:V V m =NN A(3)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。
3.阿伏加德罗定律及其推论应用(1)阿伏加德罗定律:同温同压下,相同体积的任何气体,含有相同数目的分子(或气体的物质的量相同)。
(2)阿伏加德罗定律的推论(可通过pV=nRT及n=mM、ρ=mV导出)物质的量浓度与溶质质量分数的比较1.有关仪器的使用(1)容量瓶的使用①特点②使用方法及注意事项a.容量瓶使用前一定要检查是否漏液。
其操作顺序为装水盖塞→倒立→正立→玻璃塞旋转180°→倒立。
b.用“能”或“不能”填空不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能作为反应容器或长期贮存溶液的容器;不能加入过冷或过热的液体;不能配制任意体积的溶液。

证对市爱幕阳光实验学校高三化学总复习 考点1 化学常用计量1.〔2021·理综·T7·6分〕A N 表示阿伏加德罗常数,以下判断正确的选项是 A .在18182g O 中含有A N 个氧原子B .状况下,22.4L 空气含有A N 个单质分子C .1 molCl 2参加反转移电子数一为2A ND .含A N 个Na +的2Na O 溶解于1L 水中,Na +的物质的量浓度为1 mol/L【此题以考查考生的知识运用和计算能力为出发点,着重考查了考生对有关阿伏加德罗常数计算和判断的掌握情况,近几年的高考试题对此题型的考查保持了一的持续性,如通过阿伏加德罗常数进行一些量之间的换算成为高考的热点。
【思路】解答此题注意两点:〔1〕熟练掌握阿伏加德罗常数和其它量的换算公式;〔2〕对常见物质的性质熟练掌握。
【标准解答】选A 。
选项A :18182g O 物质的量为0.5mol ,所以它所含氧原子的物质的量为1 mol ,即为1N A ,A 正确;选项B :空气是多种成分的混合物,不只是单质,B 错误;选项C :在氯气与水的反中,1 mol 氯气只转移1N A 电子,所以C 项错误;选项D :所得溶液中含有N A 个Na +可得氢氧化钠的物质的量为1 mol ,但溶液体积不是1L ,所以溶液的物质的量浓度不是1mol/L ,D 错误。
【类题拓展】解答与阿伏加德罗常数有关计算时注意的问题:1.解答以N=m/M ·N A 为中心的有关根本粒子计算是,注意看清所求粒子的种类。
2. 以气体物质为中心的计算,解答此题注意: (1)假设题目给出物质的体积,一要看是否是状况,假设不是状况,那么1mol 气体的体积不一是2L ;二要看是不是气体,如不是气体,那么无法求算其物质的量及其分子数。
(2)假设题目给出气体的质量或物质的量,那么粒子数目与外界条件无关。
(3)假设气体为稀有气体,须注意它是单原子分子。
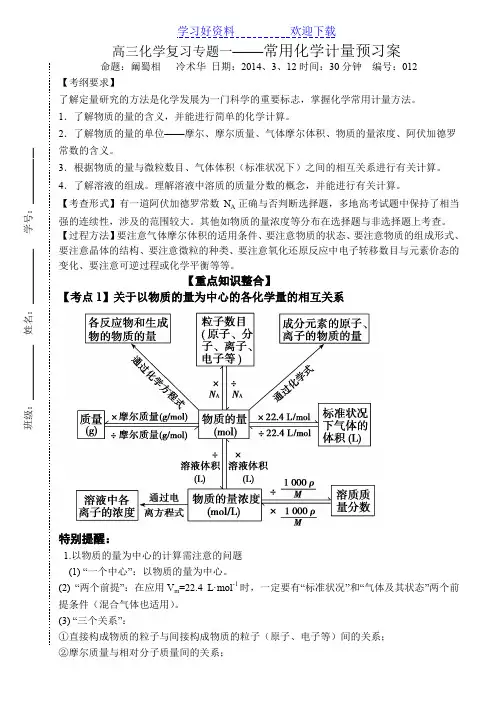
高三化学复习专题一——常用化学计量预习案命题:阚蜀相 冷术华 日期:2014、3、12时间:30分钟 编号:012【考纲要求】了解定量研究的方法是化学发展为一门科学的重要标志,掌握化学常用计量方法。
1.了解物质的量的含义,并能进行简单的化学计算。
2.了解物质的量的单位——摩尔、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
3.根据物质的量与微粒数目、气体体积(标准状况下)之间的相互关系进行有关计算。
4.了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
【考查形式】有一道阿伏加德罗常数N A 正确与否判断选择题,多地高考试题中保持了相当强的连续性,涉及的范围较大。
其他如物质的量浓度等分布在选择题与非选择题上考查。
【过程方法】要注意气体摩尔体积的适用条件、要注意物质的状态、要注意物质的组成形式、要注意晶体的结构、要注意微粒的种类、要注意氧化还原反应中电子转移数目与元素价态的变化、要注意可逆过程或化学平衡等等。
【重点知识整合】 【考点1】关于以物质的量为中心的各化学量的相互关系特别提醒:1.以物质的量为中心的计算需注意的问题(1) “一个中心”:以物质的量为中心。
(2) “两个前提”:在应用V m =22.4 L·mol -1时,一定要有“标准状况”和“气体及其状态”两个前提条件(混合气体也适用)。
(3) “三个关系”: ①直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系; ②摩尔质量与相对分子质量间的关系;班级:___________ 姓名:___________ 学号:___________③“强、弱、非”电解质与溶质粒子(分子或离子)数之间的关系。
(4)“四个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。
【针对练习】1.(2012·上海)工业上将氨气和空气的混合气体通过铂-铑合金网发生氨氧化反应,若有标准状况下VL 氨气完全反应,并转移n 个电子,则阿伏加德罗常数N A 可表示为( )A .5V 11.2nB .11.2n 5VC .5n 22.4VD .5V22.4n 2.(2012·广东)设N A 为阿伏加德罗常数的数值,下列说法正确的是( )A .常温下,4g CH 4含N A 个C —H 共价键B .1 mol Fe 与足量稀HNO 3反应,转移个2N A 个电子C .1L 0.1 mol/L NaHCO 3溶液中含有0.1N A 个HCO 3—D .常温常压下,22.4L 的NO 2和CO 2混合气体含有2N A 个O 原子3.(2012·海南)将0.195g 锌粉加入到20.0mL 的0.100 mol·L -1MO 2+溶液中,恰好完全反应,则还原产物可能是( )A .MB .M 2+C .M 3+D .MO 2+【考点2】阿伏加德罗定律1.内容:在相同的温度和压强下,相同体积的任何气体含有相同数目的分子。

专题02 化学计量与化学计算1.(2021·全国高考甲卷真题)A N 为阿伏加德罗常数的值。
下列叙述正确的是 A .18g 重水(2D O )中含有的质子数为A 10NB .3mol 的2NO 与2H O 完全反应时转移的电子数为A 4NC .32g 环状8S ()分子中含有的S-S 键数为A 1ND .1L pH=4的-12270.1mol L K Cr O ⋅溶液中2-27Cr O 离子数为A 0.1N【答案】C【解析】A .2D O 的质子数为10,18g 2D O 的物质的量为18g=20g/mol0.9mol , 则18g 重水(2D O )中所含质子数为A 9N ,A 错误;B .2NO 与2H O 反应的化学方程式为:3NO 2+H 2O=2HNO 3+NO ,该反应消耗3个NO 2分子转移的电子数为2个,则有3mol 的NO 2参与反应时,转移的电子数为A 2N ,B 错误;C .一个8S ()分子中含有的S-S 键数为8个,32gS 8的物质的量为32g =832g/mol ⨯18mol ,则含有的S-S 键数为A A 18N =N 8⨯⨯,C 正确;D .酸性227K Cr O 溶液中存在:2-2-+2724Cr O +H O2CrO +2H ,含Cr 元素微粒有2-27Cr O 和2-4CrO ,则1L pH=4的-12270.1mol L K Cr O ⋅溶液中2-27Cr O 离子数应小于A 0.1N ,D 错误;故选C 。
2.(2021·广东高考真题)设A N 为阿伏加德罗常数的值。
下列说法正确的是 A .31mol CHCl 含有C Cl -键的数目为A 3N B .1L1.0mol/L 的盐酸含有阴离子总数为A 2N C .11.2L NO 与211.2L O 混合后的分子数目为A ND .23g Na 与足量2H O 反应生成的2H 分子数目为A N 【答案】A【解析】A .1个3CHCl 分子中含有3个C Cl -键,微粒个数与物质的量成正比,故31mol CHCl 含有3mol C Cl -键,C Cl -键的数目为A 3N ,A 正确;B .盐酸为氯化氢的水溶液,氯化氢会全部电离出阴离子Cl -,水会部分电离出阴离子OH -,水的质量及电离程度未知,故无法计算1L1.0mol/L 的盐酸含有阴离子总数,B 错误;C .未提到具体的温度、压强(如标况下),故无法计算11.2L NO 与211.2L O 混合后的分子数目,C 错误;D .23g Na 为1mol ,钠与足量的水反应生成氢气的关系式为:22Na H ,故1mol Na 应对应生成0.5molH 2,2H 分子数目应为0.5A N ,D 错误; 故选A 。
2023年高考化学一轮小专题复习:化学计量一、选择题(本大题共14题)1.(2022·四川南充·三模)N A 是阿伏加德罗常数的值,下列说法正确的是A .22.4L (标准状况) HF 中含有10N A 个质子B .2 mol SO 2和1 molO 2在一定条件下反应所得混合气体分子数为2N AC .将1 mol NH 4NO 3溶于稀氨水中,若所得溶液呈中性,则溶液中NH 4+的数目为N AD .惰性电极电解CuSO 4溶液,若电路中通过的电子数为N A ,则阳极生成32 g 铜2.(2022·河南南阳·一模)N A 为阿伏加德罗常数的值,下列有关叙述正确的是A .常温常压下,3.6 g D 2O 与H 218O 组成的体系中含有中子数2N AB .标准状况下,11.2 L 氖气中所含电子数为0.5N AC .某电池的总反应为Fe+2Fe 3+=3Fe 2+,当有5.6 g Fe 溶解时电路中有0.3N A 电子通过D .32 g 环状S 8()分子中含有的S—S 键数为N A3.(2022·北京市八一中学二模)A N 为阿伏加德罗常数的值。
下列说法正确的是A .92g 甲苯中σ键总数为A 15NB .标准状况下,11.2L 3CH OH 中含有的原子总数为A 2.5NC .常温下,0.5mol/L 2Na S 溶液中2S -数目小于A 0.5ND .一定条件下,0.3mol 2H 和0.1mol 2N 充分反应后转移电子总数为A 0.6N4.(2022·广东·高三阶段练习)若N A 表示阿伏伽德罗常数,下列说法中正确的是A .标准状况下,体积为22.4L 的CCl 4含有的分子数为N AB .标准状况下,56g 的铁与足量的浓硫酸反应时,生成气体的分子数目为N AC .标准状况下,1mol 15N 2的中子数为14N AD .由锌、铜、稀硫酸构成的原电池,当有65g 锌溶解时,外电路理论上通过2N A 个电子 5.(2022·河南·濮阳一高高三期中)设A N 为阿伏加德罗常数的值,下列说法正确的A .1mol 2Cl 与足量水反应转移电子数为A NB .11.2LNO 与11.2L 2O 混合后的分子数目为A NC .1L0.11mol L -⋅的3NaHCO 溶液中3HCO -和23CO -离子数之和为0.1A ND .氢氧燃料电池正极消耗1mol 气体时,电路中通过的电子数目为4A N6.(2022·湖南省常宁市第一中学三模)N A 表示阿伏加德罗常数的值,下列说法正确的是A .1 L0.1 mol/L 的AlCl 3溶液中含有Al 3+的数目为0.1N AB .100 mL18.4 mol/L 的浓硫酸与足量锌反应时,生成的SO 2数目为0.92N AC .常温常压下,31g 白磷燃烧生成P 4O 6时,断裂P-P 键的数目为1.5N AD .0.1 mol NaHCO 3晶体中阴、阳离子总数为0.3N A7.(2022·新疆·乌市一中一模)在一定条件下,将充满NO 2和O 2的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的16,则原混合气体中NO 2和O 2的体积之比可能是 ①4①1 ①2①1 ①9①1 ①8①1A .①①B .①①C .①①D .①①8.(2022·江苏南通·一模)科学家第一次让18个碳原子连成环状,其合成过程如图。
1.(2022秋·吉林长春·高一东北师大附中校考期末)温度较高时2Cl 通入23Na CO 溶液发生反应:2232333Cl 6Na CO 3H O 5NaCl NaClO 6NaHCO ++=++,下列说法正确的是 A .该反应中23Na CO 为氧化剂B .1231L0.1mol L Na CO -⋅溶液中Na +的物质的量为0.1molC .反应中消耗23molCl 转移的电子数约为235 6.0210⨯⨯D .反应中氧化产物和还原产物的物质的量之比为5:12.(2022秋·吉林长春·高一东北师大附中校考期末)A N 代表阿伏加德罗常数的值,以下说法不正确的是A .将足量Al 与100mL 18mol /L 浓硫酸反应,生成224mL 气体,转移电子数为A 0.2NB .218gD O 所含中子数为A 9NC .431gP 分子中含有P -P 键数为A 1.5ND .4240gNaHSO 和3KHSO 的固体混合物中含有的阳离子数为A 2N3.(2022秋·浙江杭州·高一学军中学校考期中)设N A 表示阿伏加德罗常数的数值,下列说法正确的是A .标准状况下,1 L 酒精完全燃烧后生成的CO 2分子个数约为A 11.2NB .20 g D 2O 与20 g H 218O 含有的中子数均为10 N AC .1 mol/LAl 2(SO 4)3溶液中含有3N A 个SO 2-4D .50 mL 12 mol/L 盐酸与足量MnO 2共热,转移的电子数为0.3N A4.(2023秋·浙江衢州·高二校联考期末)设 N 为阿伏加德罗常数的值,下列说法正确的是A .0.1mol·L -1Ba(OH)2 溶液中含有 OH -的数目为 0.2N AB .49.5 gCOCl 2中的碳氯键数目为 N AC .31g P 4中的共价键数目为 N AD .120 g NaHSO 4 和 KHSO 3的水溶液中含有的阳离子数为N A5.(2023秋·湖南郴州·高一校联考期末)设 A N 为阿伏加德罗常数的值。
一、单选题1.(2022秋·吉林长春·高三校考阶段练习)设N A 为阿伏加德罗常数的值,下列叙述正确的是A .将1mL2mol•L -1的FeCl 3溶液滴加到沸水中,则胶体粒子数为0.02N AB .0.1molKHSO 4晶体中含有的离子数目是0.3N AC .SO 2与O 2化合生成标准状况下22.4LSO 3时,反应的SO 2分子数是N AD .将1molCl 2通入足量NaOH 溶液中,则溶液ClO -、Cl -的数目之和小于2N A2.(2023秋·河北邢台·高三邢台市第二中学校考期末)设N A 为阿伏加德罗常数的值。
下列说法正确的是A .1L0.1mol•L -1NH 4ClO 4溶液中NH 4+、ClO 4-的数目都小于0.1N AB .标准状况下,2.24L 乙烯中σ键的数目为0.4N AC .常温下,1LpH=13的Ba(OH)2溶液中,含OH -的数目为0.2N AD .足量Cu 与10g98%的浓硫酸共热反应,转移的电子数小于0.1N A3.(2023秋·河南信阳·高三校联考阶段练习)设A N 为阿伏加德罗常数的值,下列说法正确的是A .4036g Ar 中含有的质子总数为A 18NB .246.4gN H 与3CH OH 的混合物中含有的共价键总数为 A NC .10.1mol L -⋅的2H S 溶液中2H S 、HS -、2S -的总数为A 0.1ND .室温下,27.1gCl 通入足量的NaOH 溶液中反应,转移的电子数为 A 0.2N4.(2022秋·辽宁盘锦·高一辽河油田第二高级中学校考阶段练习)氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。
在一定条件下,AlN 可以通过反应Al 2O 3+N 2+3C高温2AlN+3CO 合成。
下列叙述中,正确的是A .AlN 的摩尔质量为41gB .上述反应中,每生成1molAlN 需转移6mol 电子C .AlN 中氮元素的化合价为+3D .上述反应中,C 是还原剂,N 2是氧化剂5.(2023秋·河南信阳·高一信阳高中校考期末)用A N 表示阿伏加德罗常数的值。
化学计量数专题 2 ★如何做关于物质的量及阿伏伽德罗常数的选择题?要注意什么?
1、弄清几个有关物质的量的计算的公式以及相应公式应用的条件;
物质的量 n=N/NA(粒子数除以阿伏加德罗常数)=m/M(质量除以摩尔质量)=V/Vm =C*V液(物质的量浓度乘以溶液的体积)
2、了解物质的量和微粒间的对应关系;
3、清楚各微粒间的关系,能够灵活的应用物质的量换算目标微粒数;
在数值上:1 mol=1 N A≈6.02×1023
4、注意一些重要的理论知识,如转移电子计算,电离水解平衡,电化学等.
★气体摩尔体积的适用范围是什么使用气体摩尔体积时应注意什么
①必须是标准状况.在高中化学学习中取22.4L/mol
②对象是任何气体,既包括纯净物又包括气体混合物.
③22.4升是个近似数值.
④单位是L/mol,而不是L.
本人觉得;百炼成刚,多做题,做多了就会啦!
1.设N
A
为阿伏加德罗常数的值。
下列叙述不正确的是
A.7.80g Na
2O
2
与5.85g NaCl所含阴离子数相等
B.15g甲醛(HCHO)和乙酸的混合物中氧原子数为0. 5N
A
C.一定条件下,1.4g N
2和0.2mol H
2
混合充分反应,转移的电子数为0.3N
A
D.常温下,2L pH=12的Na
2CO
3
溶液中含有OH—数目为0.02N
A
2、N
A
为阿伏加德罗常数的数值,下列说法中正确的是
A.在密闭容器中加入1.5molH
2和0.5molN
2
,充分反应后可得NH
3
分子数目
为N
A
B. 1.0L 0.1molL—1水玻璃溶液中含有的阴离子数目为0.1N
A
C.一定条件下,2.3gNa完全与O
2反应生成3.6g产物时失去电子数目为0.1N
A
D.在标准状况下,2.24L的CH
3CH
2
OH含有N
A
个分子
3、下列有关阿伏伽德罗常数说法正确的是
A.含0.2mol H
2SO
4
的浓硫酸与足量锌反应,生成气体的分子数小于0.1N
A
B.标况下,22.4L四氯化碳所含分子数大于N
A
C.0.1mol/L 的AgNO
3溶液中,阳离子所带正电荷数目为0.1N
A
D.电解267g熔融AlCl
3,能生成3mol Cl
2
和54g金属铝
4、设N
A
为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,33.6L HF中含有氟原子的数目为1.5N
A
B.常温常压下,9.2g二氧化氮和四氧化二氮的混合物含有氮原子的数目为
0.2N
A
C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO
2分子的数目为0.46N
A
D.0.1mol铁溶于足量氯水中,转移电子的总数为0.2N
A
5、用N
A
表示阿伏加德罗常数的值,下列叙述中错误的是( )
A.16.9 g过氧化钡(BaO
2)固体中阴、阳离子总数为0.3N
A
B.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 N
A
C.标准状况下,2.24 L Cl
2分别与足量 Fe或Cu反应转移的电子数均为0.2N
A
D.常温常压下,28 g乙烯和环丁烷(C
4H
8
)的混合气体原子间的共用电子共
6N
A
对
6、设N
A
为阿伏加德罗常的数值,下列说法正确的是
A.常温常压下,16g O
3气体含有氧原子数为N
A
B.标准状况下,44.8L 四氯化碳含有的分子数为2N
A
C.0.1mol·L—1氧化铝溶液中含有Al3+数为0.1N
A
D .2.4g 金属镁变为镁离子时失去的电子数为0.1N A 7、下列说法正确的
A .7.8g Na 2O 2中所含阴离子的物质的量是0.2mol
B .等物质的量的—CH 3与OH —
所含电子数相等 C .35C12和37C12互为同素异形体
D .1mol 乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023
8、设N A 表示阿伏加德罗常数的值,下列叙述正确的是
A .1L 0.1 mol·L —1的CH 3COONa 溶液中CH 3COO —的总数是0.1N A
B .常温常压下,1.6g O 2 和O 3 混合气体中质子总数为0.8 N A
C .一定条件下,2mol SO 2 和 1mol O 2 发生反应,转移的电子总数一定是4N A
D .1L 0.1mol·L —1的葡萄糖溶液中分子总数为0.1 N A
9、设N A 为阿伏加德罗常数的数值,下列说法错误..
的是 A .标准状况下,22.4 LCl 2和HCl 的混合气体中含原子总数为2N A B .256g S 8晶体中含S-S 键为7N A 个
C .由1molCH 3COONa 和少量CH 3COOH 形成的中性溶液中,CH 3COO -数目为N A 个
D .1 mol Na 与O 2完全反应,生成Na 2O 和Na 2O 2的混合物,转移电子总数N A 个
10、N A 表示阿伏加德罗常数,下列叙述正确的是
A .6.4 g 铜粉与足量硫粉充分反应,失去的电子数为0.2 N A
B . Na 2O 2与足量H 2O 反应生成0.2molO 2,转移电子的数目为0.4 N A
C .标准状况下,22.4 L 氯气与足量氢氧化钠溶液反应转移的电子数为2 N A
D . 0.5 mol·L -1CuCl 2溶液中含有Cu 2+数小于0.5 N A 11、 N A 代表阿伏加德罗常数,下列说法不正确的是
A .一定量的Fe 与含1mol HNO 3的稀硝酸恰好反应,则被还原的氮原子数小于
N A
B .1 L0.5mol /LNa 2CO 3溶液中含有的CO 32-
数目为0.5N A
C .标准状况下,2.24L Cl 2与足量的Mg 充分反应,转移的电子数目为0.2N A
D .0.1mol CH 4所含的电子数为N A
12、用N A 表示阿伏加德罗常数的值,下列叙述中正确的是 A .通常情况下,7.6g CS 2含有非极性键数目为0.4N A B .22.4L CO 气体与1mol N 2所含的电子数相等
C .将7.8gNa 2O 2放入足量的水中,反应时转移0.1N A 电子
D .25℃时,1L pH=13的Ba (OH )2溶液中含OH —数目为0.2N A
13、用N A 表示阿伏加德罗常数,下列说法正确的是:
A .用含0.1mol FeCl 3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1N A
B .13gNO 2和33gN 2O 4混合气体中含N 原子数为N A
C .28gCO 和22.4LN 2含有的分子数均为N A
D .等物质的量的NH 4+和OH -含电子数均为10N A 14、用N A 表示阿佛加德罗常数的值。
下列叙述正确的是
( )
A .在0 ℃时,22.4 L 氢气中含有2N A 个氢原子
B .电解食盐水若产生2g 氢气,则转移的电子数目为N A
C .1mol 乙烷分子中共价键总数为7N A
D .密闭容器中46gNO 2含有的分子数为N A
15、 设N A 为阿伏伽德罗常数的数值,下列说法正确的是
A .常温下,23g NO 2含有N A 个氧原子
B .标准状况下,11.2L SO 3中含有的分子数为0.5N A
C .1 mol Cl 2做氧化剂转移的电子数是N A
D .1L 0.1molL -1的氨水中含OH ―离子数为0.1N A 个 16、 N A 为阿伏伽德罗常数,下列叙述错误的是( )
A .1mol 乙醇中含有C —H 键的数目为6 N A
B .46gNO 2和N 2O 4混合气体中含有原子总数为3N A
C .足量Na 与1 mol O 2 反应,,转移电子可能为4N A 个
D .常温下,1L0.1 0mol .L -1的43NH NO 溶液中氮原子数为0.2A N 17、设N A 是阿伏加德罗常数的值,下列说法正确的是
A .1 L1mol·L -1的NaClO 溶液中含有ClO -的数目为N A
B .60g 二氧化硅含有的共价键数为2N A
C .7.8g 钾与100mL 1mol·L -1盐酸充分反应生成气体分子数为0.1N A
D .标准状况下,7.1g 氯气与足量的石灰乳充分反应,转移电子数为0.2N A
18.设N A 为阿伏加德罗常数的值,下列说法不正确的是( ) A .常温下,1molC12与过量的Fe 完全反应,转移电子数是2N A B .常温常压下,17g 氨气所含的电子数为10N A C .46克NO 2和N 2O 4混合气体中含有原子个数为3N A D .0.1 mol 甲基中含有电子数是 0.1N A。