高考化学二轮复习计算专题
- 格式:doc
- 大小:282.13 KB
- 文档页数:8

突破点3晶体结构分析和有关计算命题角度1原子间距离、原子坐标与配位数判断1.(化学式确定)(1)(2023·浙江1月选考)Si 与P 形成的某化合物晶体的晶胞如图。
该晶体类型是_共价晶体__,该化合物的化学式为_SiP 2__。
(2)(2022·天津选考)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。
由晶胞图判断该氧化物的化学式为_Na 2O__。
【解析】(1)Si 与P 形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有8×18+6×12=4个Si,8个P,故该化合物的化学式为SiP 2。
(2)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内,则晶胞中有8个钠,氧有8×18+6×12=4个,钠氧个数比为2∶1,则该氧化物的化学式为Na 2O。
2.(配位数)(2022·重庆选考)X 晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于_与Zn 2+相连的双键氧原子不在对称轴的同侧__。
(2)X 晶体中Zn 2+的配位数为_4__。
【解析】(1)由X 晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于与Zn 2+相连的双键氧原子不在对称轴的同侧。
(2)1个[Zn 4O]6+上、下、左、右、前、后共有6个L 2-,每个L 2-与[Zn 4O]6+形成2个Zn←O 配位键,1个[Zn 4O]6+含有4个Zn←O 配位键,1个[Zn 4O]6+中Zn 2+形成的配位键数目为6×2+4=16,1个Zn 2+的配位数为4。
3.(原子距离与坐标)(2021·山东选考)XeF 2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_2__个XeF 2分子。


高考化学二轮复习化学晶胞的相关计算专项训练试题附解析一、晶胞的相关计算1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。
回答下列问题:(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。
基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。
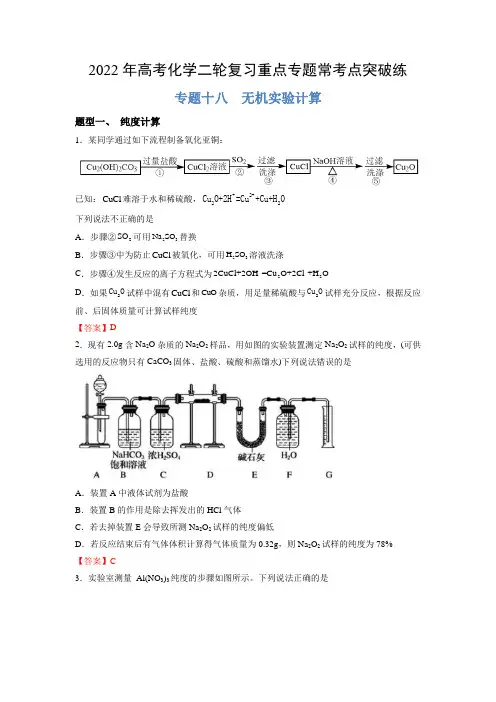
2022年高考化学二轮复习重点专题常考点突破练专题十八 无机实验计算题型一、 纯度计算1.某同学通过如下流程制备氧化亚铜:已知:CuCl 难溶于水和稀硫酸,+2+22Cu O+2H =Cu +Cu+H O 下列说法不正确的是A .步骤②2SO 可用23Na SO 替换B .步骤③中为防止CuCl 被氧化,可用23H SO 溶液洗涤C .步骤④发生反应的离子方程式为--222CuCl+2OH =Cu O+2Cl +H OD .如果2Cu O 试样中混有CuCl 和CuO 杂质,用足量稀硫酸与2Cu O 试样充分反应,根据反应前、后固体质量可计算试样纯度 【答案】D2.现有2.0g 含Na 2O 杂质的Na 2O 2样品,用如图的实验装置测定Na 2O 2试样的纯度,(可供选用的反应物只有CaCO 3固体、盐酸、硫酸和蒸馏水)下列说法错误的是A .装置A 中液体试剂为盐酸B .装置B 的作用是除去挥发出的HCl 气体C .若去掉装置E 会导致所测Na 2O 2试样的纯度偏低D .若反应结束后有气体体积计算得气体质量为0.32g ,则Na 2O 2试样的纯度为78% 【答案】C3.实验室测量 Al(NO 3)3纯度的步骤如图所示。
下列说法正确的是A .配制 Al(NO 3)3溶液只需要 250 mL 容量瓶和玻璃棒这两种玻璃仪器B .加入试剂 a 发生反应的离子方程式为 Al 3+ + 3OH − = Al(OH)3 ↓C .操作“b”需要在蒸发皿中进行D .Al(NO 3)3的纯度为21710m 100%17m 【答案】D4.(2021·云南昆明市·高三三模)II.测定Li 3N 产品纯度(5)反应结束冷却至室温后,读数前应先_______,测得体积为VL(已折合成标准状况)。
若杂质与水反应不产生气体,则Li 3N 的质量分数为_______(只列出含m 和V 的计算式,不必计算化简)。

专题强化练(二) 物质的量1.(2024·汕头期末质量检测)2024年,我国科学家利用CO 2为原料人工合成淀粉,在将来具有极高的经济价值。
已知合成淀粉过程中发生反应:CH 3OH +O 2――→催化剂HCHO +H 2O 2,设N A 为阿伏加德罗常数的值,下列有关说法正确的是( ) A .17 g H 2O 2中含有过氧键数目为0.5N AB .标准状况下,22.4 L CH 3OH 中含有的羟基数为N AC .反应过程中HCHO 为还原产物D .1 mol O 2参加反应转移电子数为4N A解析:已知1个H 2O 2分子中存在1个过氧键,则17 g H 2O 2中含有过氧键数目为17 g 34 g·mol -1×1×N A mol -1=0.5N A ,A 项正确;在标准状况下CH 3OH 为液体,故无法计算22.4 L CH 3OH 中含有的羟基数目,B 项错误;由反应方程式可知,CH 3OH +O 2=====催化剂HCHO +H 2O 2,CH 3OH 中C 为-2价,而HCHO 中C 为0价,化合价上升,被氧化,故反应过程中HCHO 为氧化产物,C 项错误;由反应方程式可知,O 2中的O 由0价转化到H 2O 2中的-1价,则1 mol O 2参加反应转移电子数为2N A ,D 错误。
故选A 。
答案:A2.(2024·揭阳期末考试)设N A 为阿伏加德罗常数的数值。
下列说法正确的是( ) A .1 mol C 2H 6中含有的非极性共价键的数目为7N A B .1 L pH =4的醋酸溶液中CH 3COO -的数目略少于10-4N A C .密闭容器中,1 mol N 2和3 mol H 2催化反应后分子总数为2N A D .22.4 L 氯气通入足量的氢氧化钠溶液中充分反应,转移的电子数为N A解析:1个C 2H 6分子中只含有1个碳碳单键属于非极性共价键,A 项错误;依据电荷守恒可知c (H +)=c (OH -)+c (CH 3COO -)=10-4mol·L -1,B 项正确;合成氨是可逆反应,在没有转化率的前提下无法精确计算,C 项错误;缺少条件“标准状况”无法计算22.4 L 氯气的物质的量,D 项错误。

2022届高三高考化学二轮复习专题检测 化学反应热的计算练习题(一) 一、单选题(共15题)1.下列热化学方程式中,ΔH 能正确表示物质的燃烧热的是( ) A .22S()O ()SO ()g g g += 269.8kJ/mol H ∆=- B .21C()O ()CO()2s g g += 110.5kJ/mol H ∆=-C .2221H ()O ()H O()2g g g += 241.8kJ/mol H ∆=-D .2182222C H ()25O ()16CO ()18H O()l g g l +=+ 11036kJ/mol H ∆=- 2.下列变化过程中,吸热的是( ) A.2H H H +→ B.H Cl HCl +→ C.2I I I →+ D.22S O SO +→3.沼气是一种能源,它的主要成分是CH 4,0.5 mol CH 4完全燃烧生成CO 2和液态水时放出445 kJ 的热量,则下列热化学方程式中正确的是( ) A.2CH 4(g)+4O 2(g)2CO 2(g)+4H 2O(l) ΔH=+890 kJ·mol -1 B.CH 4(g)+2O 2(g)CO 2(g)+2H 2O(l) ΔH=+890 kJ·mol -1 C.CH 4(g)+2O 2(g)CO 2(g)+2H 2O(l) ΔH=-890 kJ·mol -1 D.CH 4(g)+2O 2(g)CO 2(g)+2H 2O(g) ΔH=-890 kJ·mol -14.下列说法中,正确的是( )A.在化学反应中发生物质变化的同时,不一定发生能量变化B. 0H ∆>表示放热反应, 0H ∆<表示吸热反应C.放热反应,使体系的温度升高;吸热反应,使体系的温度降低D.生成物释放的总能量大于反应物吸收的总能量时, 0H ∆< 5.下列说法错误的是( )① 化学反应除了生成新物质外,还伴随着能量的变化 ② 放热反应不需要加热就能发生 ③ 需要加热才能发生的反应都是吸热反应④ 化学反应放热还是吸热,决定于生成物具有的总能量和反应物具有的总能量的大小⑤ 反应物的总能量高于生成物的总能量时,发生放热反应 ⑥ 反应物的总能量低于生成物的总能量时,发生吸热反应 ⑦ 化学反应中的能量变化都表现为热量的变化 A .①②③④⑤⑥ B.②③C.②③⑦D.①④⑤⑥6.已知:122C(s)O (g)CO (g)393.5kJ mol H -+=∆=-⋅12221H (g)O (g)H O(l)241.8kJ mol 2H -+=∆=-⋅欲得到相同的热量,需燃烧固体碳和氢气的质量比约为( ) A.2:3.25B.12:3.25C.l :1D.393.5:2417.已知I 2(g)+H 2(g) 2HI(g)△H=-QkJ/mol(Q>0),H-H 键能为akJ/mol,H-I 键能为bkJ/mol,则I-I 键能是( )A.b+Q-a kJ/molB.2b-Q-a kJ/molC.2b+Q-a kJ/molD.b-Q+a kJ/mol8.已知1 mol 白磷(s)转化为1mol 红磷,放出18.39KJ 热量,又知: 4P (白, s)+5O 2(g)2P 2O 5(s) △H 1 4P (红, s)+5O 2(g) 2P 2O 5(s) △H 2 则△H 1和△H 2的关系正确的是( ) A.△H 1=△H 2 B.△H 1>△H 2 C.△H 1<△H 2 D.无法确定9.在25℃、101kPa 条件下,C(s)、2H (g)、3CH COOH(1)的燃烧热分别为393.51kJ mol -⋅、285.81kJ mol -⋅、870.31kJ mol -⋅,则2232C(s)2H (g)O (g)CH COOH(1)++的反应热为( )A.-488.31kJ mol -⋅B.+488.31kJ mol -⋅C.-1911kJ mol -⋅D.+1911kJ mol -⋅10.某反应由两步反应A BC 构成,它的反应能量曲量线如图,下列叙述正确的是( )A.两步反应均为吸热反应B.三种化合物中C 最稳定C.A 与C 的能量差为E 4D.A B 反应,反应条件一定要加热11.下列各组热化学方程式中,化学反应的ΔH 前者大于后者的是( ) ①C(s)+1/2O 2(g)=CO (g) ΔH 1; C(s)+O 2(g)=CO 2 (g) ΔH 2; ②S(s)+O 2(g)=SO 2(g) ΔH 3; S(g)+O 2(g)=SO 2(g) ΔH 4;③2H 2(g)+O 2(g)=2H 2O(g) ΔH 5 ; 2H 2(g)+O 2(g)=2H 2O(l) ΔH 6; ④CaCO 3(s)=CaO(s)+CO 2(g) ΔH 7; CaO(s)+H 2O(l)=Ca(OH)2(s) ΔH 8; A .全部B .④C .②③④D .①②③12.氢气和氮气一定条件下反应生成氨气。

第44讲 化学计算(建议2课时完成)[考试目标]1.掌握化学常见的计算方法2.了解化学计算的常见题型、解题思路和解题技巧[要点精析]一、化学计算的常见题型1.有关相对原子量、相对分子量及确定化学式的计算2.有关物质的量的计算3.有关气体摩尔体积的计算4.有关混合物质量分数、体积分数的计算5.有关溶液质量分数、物质的量浓度的计算6.有关溶液pH 与氢离子浓度、氢氧根离子浓度的简单计算7.利用化学方程式的计算[例题1]今测得某硝酸铵化肥中含氮量为38.5%,则该化肥中可能混有( )A.NH 4HCO 3 B.(NH 4)2SO 4 C.NH 4Cl D.CO(NH 2)2[解析]NH 4NO 3中氮元素的质量分数=%100234⨯NO NH N =%10080142⨯⨯=35%,按照同样的方法计算各物质中氮元素的质量分数,只有尿素中氮元素的质量分数高于35%,所以选D 。
答案:D 。
[例题2]N 、O 两种元素形成的化合物中N 、O 两种元素的质量比为7 :12,试写出其化学式。
[解析]设其化学式为N x O y ,则:m N :m O =14x :16y=7 :12所以,x :y=2 :3 化合物的化学式为:N 2O 3[例题3]稀硫酸和稀盐酸的混合液100mL 加入0.3mol/L 的氢氧化钡溶液100mL ,充分反应后,经过滤得沉淀2.33g ,又测得所得滤液中OH -浓度为0.1mol/L 。
则原混合液中稀硫酸和稀盐酸的物质的量浓度分别为___________、_____________(设不考虑溶液体积的变化)。
[解析]设硫酸的物质的量为xH 2SO 4+Ba(OH)2=BaSO 4↓+2H 2O1mol 233gX 2.33ggg x mol 33.22331= x=0.01mol滤液中n OH-=0.1mol/L×0.2L=0.02mol∴反应消耗的n OH-=0.3mol/L×2×0.1L -0.02mol=0.04mol0.1mol 硫酸消耗0.02molOH -,所以,盐酸消耗0.02molOH -,n HCl =0.02mol原混合液中C H2SO4=L mol L mol /1.01.001.0= C HCl =L mol L mol /2.01.002.0= 二、常见的计算方法和解题技巧1.关系式法:关系式法是根据化学方程式计算的巧用,其解题的核心思想是化学反应中质量守恒,各反应物与生成物之间存在着最基本的比例(数量)关系。

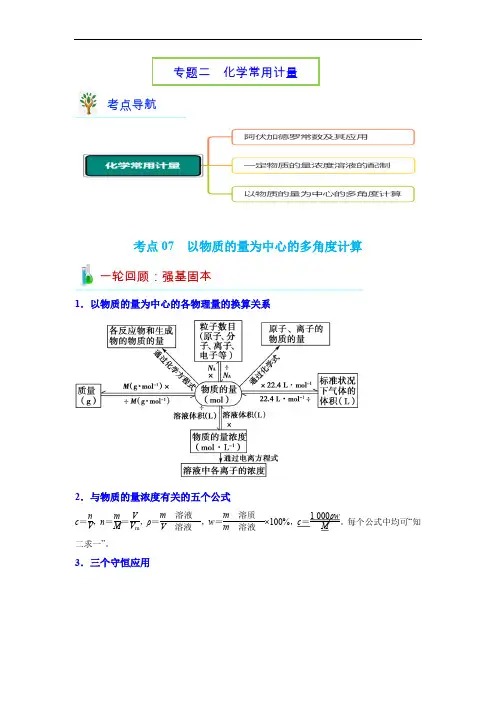
考点07 以物质的量为中心的多角度计算1.以物质的量为中心的各物理量的换算关系2.与物质的量浓度有关的五个公式c=nV,n=mM=VV m,ρ=m溶液V溶液,w=m溶质m溶液×100%,c=1 000ρwM。
每个公式中均可“知二求一”。
3.三个守恒应用考点导航一轮回顾:强基固本专题二化学常用计量1.必须掌握的“四”个定义式c =n /V ,n =m /M =V /V m ,ρ=m (溶液)/V (溶液),w =m (溶质)m (溶液)×100%。
每个公式中均可“知二求一”。
2.熟练推导“三”种换算关系(1)物质的量浓度与溶质质量分数之间的换算 c =n V =m /M V =m (aq)w MV =1 000ρw M ,w =cM 1 000ρ 。
(ρ:g·cm -3) (2)物质的量浓度与溶解度(S )的换算(饱和溶液) c =n V =S /M 100+S 1 000ρ= 1 000ρS M (100+S ),S =100cM 1 000ρ-cM 。
(ρ:g·cm -3) (3)气体溶质溶于水中制得溶液,其物质的量浓度和质量分数的计算 在标准状况下,1 L 水中溶解某气体V L ,所得溶液密度为ρ,则:c =nV=V /22.41 000×1+V22.4×M1 000ρ= 1 000ρV 22 400+MV (ρ:g·cm -3),w =m (溶质)m (溶液)×100%=V 22.4×M 1 000×1+V 22.4×M=MV 22 400+MV×100%。
3.灵活利用“三”个守恒关系(1)稀释前后“溶质的物质的量守恒”:c (浓溶液)·V (浓溶液)=c (稀溶液)·V (稀溶液)。
(2)溶液中“粒子之间电荷守恒”(溶液呈电中性)。
(3)质量守恒:反应前后同种原子的质量相等。

2022年高考化学二轮复习——计算题1.(2021·上海闵行·三模)某硫酸厂用接触法制硫酸:(1)在煅烧黄铁矿时损失硫5%(质量分数,下同);在SO2的催化氧化时,SO3的产率为92%;在吸收塔中损失SO3 0.6%。
现有含FeS295%的黄铁矿(杂质不含硫元素)100t,可制得98%的浓硫酸_____________t。
(2)若该厂每小时生产at 98%(质量分数)硫酸。
为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。
若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则该厂每小时消耗标准状况下空气的体积为_________m3,b%的下限等于__________。
(3)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。
为测定此铵盐中氮元素的质量分数,将不同质量的铵盐样品分别加入到50.00mL相同浓度的NaOH 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。
该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:①铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;①铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;①铵盐质量为40.000 g时,浓硫酸的质量不变。
通过计算推理求解该铵盐的成分和铵盐样品中氮元素的质量分数_____。
(写出计算推理过程,计算结果用小数表示,并保留3位小数)2.(2021·上海松江·三模)有三份不同质量的硫化铜与硫化亚铜的混合物样品①①①。
甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中硫化铜的量。
(1)甲取2.56克样品①,置于空气中加强热,产物为氧化铜和二氧化硫。
若产生0.448 L气体(标准状况),该气体被30 mL一定浓度氢氧化钠恰好完全吸收,将所得溶液小心低温蒸干得固体2.3克。

2121ρρ=Mr Mr专题二十二* 化学计算一.考点梳理1.化学中常用的计量关系 (1)相对分子质量①Mr =分子中各原子的相对原子质量总和 ②Mr = 22.4·ρ ( ρ是标准状况气体的密度)③Mr = ρ相对·Mr 相对 ρ相对=(Mr 相对是相对气体的相对分子质量,ρ相对为相对密度。
如 Mr=2ρ(H 2)④__Mr =m n 总总m 总 为混合气体的总质量,n 总 为混合气体的总物质的量。
或者:__Mr =Mr 1x 1+ Mr 2x 2+……,Mr 1 、Mr 2为各组成气体有相对分子质量,x 1、x 2为各组成气体的体积分数(2)以物质的量为中心的各种量的转化 ①微粒个数=物质的量×6.02×1023 ②物质的质量:m=n ·M (g)③标准状况下气体体积:V= n ·22.4 (L)④物质的量浓度:c =Vn(mol/L)(3)有关阿佛加德罗定律及其推论 ①同温同压: V 1/V 2=n 1/n 2=N 1/N 2 ②同温同体积: P 1/P 2=n 1/n 2=N 1/N 2 ③同温同压:ρ1/ρ2=M 1/M 2④同温度同压强同质量:V 1/V 2=M 2/M 1 2.有关分子式的计算主要包括分子式的计算(求式量、摩尔质量);求一定质量的某化合物中某元素的质量或质量分数;根据分子式进行化合价的计算;确定分子式。
3.有关溶液的计算 (1)物质的量浓度的计算① ② c 1 V 1=c 2 V 2 (溶液的稀释)③ c 混 = 212211V V V c V c ++ (同溶质的两溶液混合)④ c=M %1000ωρ⨯⨯(物质的量浓度与质量分数的转化)(2)溶质的质量分数的计算关系①ω=100%m m ⨯溶质溶液=100%m m m ⨯+溶质溶质溶剂② ω=100%100SS ⨯+ (饱和溶液)③ m 1 ω1= m 2 ω2 (溶液的稀释)④ m 1 ω1+ m 2 ω2= m 混 ω混 (同溶质的混合) (3)溶液的溶解度的计算关系 ① S =100m g m ⨯溶质溶剂② S =1001ωω- (ω为饱和溶液的质量分数) ③气体溶解度的计算1 体积水(密度为1 g/mL) 吸收了V L 气体,相对分子质量为M ,所得溶液的密度为ρg/mL ,求此溶液的质量分数与物质的量浓度?ω= 22.4100%100022.4VM V M⨯⨯+⨯ c =22.4100022.41000V VMρ+⨯•如一支试管盛NH 3,倒置在水槽中,则氨水物质的量浓度为(设氨水在试管中不扩散):c =V122.4(mol/L)V 22.4=4.有关化学方程式计算:(1)同一化学方程式中的比例关系: ①质量比②系数比、物质的量比、微粒个数比 ③有气体参加,体积比 ④速率与物质的系数比在以方程式为基础进行计算时,同一物质的单()(mol/L)()n mol c V L =溶质溶液位要相同,不同物质的单位可以不同,即和我们平常所说的:上下单位一致,左右单位相当。
冠夺市安全阳光实验学校专题十七综合计算【专题要点】在每年的化学高考试题中,属于计算类题目现在基本不出现的大的计算题,一般均以小题的形式呈现,穿插于选择题的选项中以及实验题、工业设计题、有机题等大题中;高考题中常见的计算主要出现在以下几个知识点上:1.阿伏伽德罗常数以及相关物理量的计算;2.物质的量应用于化学方程式的计算;3.结合热化学方程式的书写,应用盖斯定律进行化学反应反应热的相关计算;4.化学平衡常数的应用于计算反应物的转化率;5.pH的简单计算;6.溶解度、溶液中溶质的质量分数的计算;7.其他如实验中涉及的定量实验的定量计算等;在复习时紧扣知识点复习,结合计算技巧,突破计算难点【考纲要求】1.理解相对原子质量、相对分子质量的含义,并能进行有关计算。
2.了解摩尔(mol) 、摩尔质量、气体摩尔体积(状况下)、物质的量浓度、阿伏加德罗常数的含义。
并能进行有关计算(混合气体的平均相对分子质量的相关计算不作要求)。
3.能正确书写化学方程式,并能根据质量守恒定律进行有关计算。
4.能正确书写热化学方程式,能用盖斯定律进行简单化学反应反应热的计算。
5.理解化学平衡和化学平衡常数的含义,能用化学平衡常数计算反应物的转化率。
6.了解溶液pH的定义,能进行pH 的简单计算7.理解溶解度、溶液中溶质的质量分数的概念【教法指引】【知识网络】一.物质的量及阿伏伽德罗常数的计算见专题十六;二.盖斯定律的应用盖斯定律在科学研究中具有重要意义。
因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。
此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
例如:C(S)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;△H1= - 393.5kJ/mol CO(g)+0.5 O2(g)=CO2(g) ;△H2= - 283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H3。
魁夺市安身阳光实验学校知识组块六六类计算(1)了解相对原子质量、相对分子质量的定义,并能进行有关计算。
(2)能正确书写化学方程式和离子方程式,并能进行有关计算。
(3)了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
(4)根据物质的量与微粒(原子、分子、离子等)数目、气体体积(状况下)之间的相互关系进行有关计算。
(5)了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
(6)了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
(7)了解化学平衡建立的过程。
理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
(8)了解溶液pH的定义。
了解测定溶液pH的方法,能进行pH的简单计算。
关联点计算是自然学科必备工具之一,高考试题计算是重要内容。
通过对信息的捕获、理解、加工,对加强学生的思维敏捷性、严密性、整体性以及创造性的培养,均有重要作用。
针对高中化学内容的计算大体可分为六类,“有关分子构成的计算”、“有关溶液组成的计算”、“有关pH的计算”、“有关方程式的计算”、“有关热学、电学的计算”、“有关概念理论的综合计算”。
在这些计算类型中,多数是以物质的量为中心的计算,涉及四个基本公式,物质的量成为宏观物质与微观粒子之间联系桥梁(关系见上图)。
在实际应用过程中,遇到复杂情况,产生了几种计算方法,关系式法、差量法,极值法、十字交叉法、讨论法等。
下面选择这些方法中的几个进行一下简单介绍。
1.差量法:①准确写出相关反应的化学方程式;②找出产生差量的“对象”及“理论差量”。
该“理论差量”可以是质量、物质的量、气体体积、压强、密度、反应过程中热量的变化等,且该差量的大小与参加反应物质的有关量成正比;③根据反应方程式,根据“实际差量”确定出比例关系,列式求解。
2.守恒法:守恒法使用的关键在于从诸多变化和繁杂数据中寻找恒量(如质量守恒、元素守恒、电荷守恒、电子得失守恒等)确定关系。
2023年高考化学专题训练--物质的量的相关计算一、单选题1.设N A为阿伏加德罗常数,则下列说法错误的...是()A.在标准状态下,2.24L环己烷的分子数为0.1N AB.1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8N AC.14g乙烯和环丙烷混合物中含有的碳原子数为N AD.0.2mol乙炔分子中含有的共用电子对数为N A2.下列有关1mol O2的说法中,不正确的是(N A表示阿伏加德罗常数)()A.质量为32g B.含氧原子数为N AC.含氧分子数为N A D.在标准状况下,体积约为22.4L3.在标准状况下有:①6.72 L CH4;②3.01×1023个氯化氢分子;③13.6 g硫化氢;④0.2 mol NH3。
下列对这四种气体相关量的比较错误的是()。
A.体积:②>③>①>④B.密度:②>③>④>①C.质量:②>③>①>④D.氢原子数:①>④>③>②4.N A为阿伏加德罗常数的值,下列说法正确的是()A.1molNaCl晶体中约含N A个氯化钠分子B.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧气分子数为0.3N AC.1mol[Al(OH)4] —中含有的共用电子对数为4N AD.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4N A5.设N A表示阿伏加德罗常数的值,下列叙述中正确的是()A.3g甲醛所含碳原子数为0.2N AB.1mol CH3OH分子含有的电子总数为18N AC.44gC3H8中含有共价键的数目为11N AD.17g羟基中含有的电子数为10N A6.等质量的下列物质所含分子数最多的是()A.N2B.HCl C.O2D.NH37.将4.6g钠与95.6g水混合反应得到溶液①,向①中加入50mL硫酸溶液得到中性溶液②,下列说法错误的是()A.①中NaOH的质量分数为8%B.c(H2SO4)=2mol·L-1C.②中n(Na2SO4)=0.1mol D.钠与水反应时生成了2.24L气体8.高铁酸钾(K2FeO4)为暗紫色粉末,极易溶于水,在强碱性溶液中相当稳定,中性条件下与水反应[4FeO42−+10H2O=4Fe(OH)3+8OH−+3O2↑]。
高考化学二轮复习专题------化学计算的基本方法技巧一.专题动态分析:高考理科综合能力测试中,化学计算试题有选择、填空、简答、全过程计算等基本题型。
与过去3+2单科化学卷不同的是,“3+X”理科综合测试中化学计算题的难度大大降低,题型理科综合测试中的化学计算除保留原来的混合物计算、复杂化学式计算、过量问题的计算、范围讨论型等基本计算题型外,同时还开发了数据缺省型计算、学科间综合计算、信息迁移型计算、图象问题计算等多样化题型,从不同角度和不同层面上考查学生能力和水平。
高考化学计算试题注重对知识的理解和应用考查,重视对计算思路方法的考查,削减了数学计算容量,恢复了化学的本质。
这一信号告诉我们,不要将化学计算简单地理解为数学应用题,那样将会失去化学计算题对提高学生水平和能力作用的本意。
可以预料,定性和定量融合的试题将会成为理综卷的主流题型。
新的高考模式中,化学计算素材重要的着眼点之一就是注重体现“化学与社会”“科学与技术”的关系,显示化学计算与社会、生产及生活广泛联系,使化学计算视角更为广阔。
例如化工计算、环境的污染与治理的计算等。
二.化学计算中常用的基本方法与思路;(1)守恒法守恒法就是巧妙地选择化学式中某两数(如总化合价数、正负电荷总数)始终保持相等,或几个连续的化学方程式前后某粒子(如原子、电子、离子)的物质的量保持不变,作为解题的依据,这样可避免书写化学方程式,从而提高解题的速度和准确性。
化学中有多种守恒关系。
学习中要理顺各种守恒关系之间的内在联系,拓宽主要守恒关系的外延。
绝大部分守恒关系是由质量守恒定律衍生出来的,可表示为:从具体应用挖掘各种守恒关系在不同情形下有不同的形式。
如电子守恒关系有以下几种表现形式:【例1】Cu、Cu2O和CuO组成的混合物,加入100Ml0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。
求:(1)写出Cu2O跟稀硝酸反应的离子方程式。
(2)产物中硝酸铜的物质的量。
(3)如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别为多少?(4)如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围。
【点拨】本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。
若抓住反应的始态和终态利用守恒关系进行求解,则可达到化繁为简的目的。
(1)利用电子守恒进行配平。
3Cu2O+14HNO3==6Cu(NO3)2 + 2NO↑+7H2O(2) 利用N 原子守恒。
n (HNO 3)== 0.06mol ,n (NO )== 0.01mol ,则n (Cu(NO 3)2)==(0.06-0.01)/2=0.025mol(3) 本题混合物中虽含有Cu 、Cu 2O 和CuO 三种物质,但参加氧化还原反应的只有 Cu 、Cu 2O ,所以利用电子守恒可直接求解。
转移电子总数:n (e -)= n (NO )×3==0.03molCu 提供电子数:0.01×2=0.02molCu 2O 提供电子数:0.03-0.02=0.01mol n (Cu 2O )=0.01/2=0.005moln (CuO )=0.0025-0.01-0.005×2=0.005mol(4) 根据(3)解法可得n (Cu 2O )=0.015-Xmol n (CuO )=X-0.005mol 。
根据电子守恒进行极端假设:若电子全由Cu 提供则n (Cu )=0.015mol ;若电子全由Cu 2O 提供则n (Cu 2O )=0.015mol ,则n (Cu 2+)==0.03mol 大于了0.025mol ,说明n (Cu )不等于0,另根据n (CuO )=X-0.005mol 要大于0可得n (Cu )>0.005mol 。
所以0.005mol < n (Cu )<0.015mol 。
【巩固】2、碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。
在高温下这两种化合物均能分解成氧化铜。
溶解28.4g 上述混合物,消耗1mol/L 盐酸500mL 。
燃烧等质量的上述混合物,得到氧化铜的质量是A.35gB.30 gC.20 gD.15 g(2)差量法 根据物质发生化学反应的方程式,找出反应物与生成物中某化学量从始态到终态的差量关系进行列式,实际上是比例法。
其解题关键是正确找出化学方程式中的差量(标准差)和实际发生化学反应的差量(实际差),这些差往往是同一物理量(同一单位)的差量。
具体有①质量差;②气体体积差;③物质的量差。
另外,还有压强差、以及热量差等。
【例2】10毫升某气态烃在80毫升氧气中完全燃烧后,恢复到原来状况(1.01×105Pa , 270C )时,测得气体体积为70毫升,求此烃的分子式。
【点拨】原混和气体总体积为90毫升,反应后为70毫升,体积减少了20毫升。
剩余气体应该是生成的二氧化碳和过量的氧气,下面可以利用差量法进行有关计算。
C x H y + (x+4y )O 2 xCO 2 + 2y H 2O 体积减少 1 1+4y 10 20计算可得y=4 ,烃的分子式为C 3H 4或C 2H 4或CH 4【巩固】1、现有KCl 、KBr 的混合物3.87g ,将混合物全部溶解于水,并加入过量的AgNO 3溶液,充分反应后产生6.63g 沉淀物,则原混合物中钾元素的质量分数为A.0.241B.0.259C.0.403D.0.487(3)关系式法 对于多步反应体系,可找出起始物质和最终求解物质之间的定量关系,直接列出比例式进行计算,可免去中间繁琐的计算过程。
具体有:①多步反应关系式法:对没有副反应的多步连续反应,可利用开始与最后某一元素不变的关系,建立相应关系式解题。
②循环反应关系式法:可将几个循环反应加和,消去其中某些中间产物,建立一个总的化学方程式,据此总的化学方程式列关系式解题。
另外,在混合物的计算中、复杂的化学反应计算中均可建立起相关量的关系式,这也是化学计算中的普遍方法。
【例3】为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。
为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。
将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。
试通过计算说明该加碘食盐是否为合格产品。
有关反应如下:IO3-+5I-+6 H+→3I2+3H2OI2+2S2O32-→2I-+S4O62-【点拨】本题为多步反应的计算,可根据反应方程式直接建立IO3-和S2O32-的关系式进行求解。
解:6S2O32-------- IO3-6mol 1mol0.030mol/L×18.00mL×10-3nn(I2)==0.09×10-3mol每千克食盐中含KIO3:∴该加碘食盐是合格的【规律总结】实际化工生产中以及化学工作者进行科学研究时,往往涉及到多步反应:从原料到产品可能要经过若干步反应;测定某一物质的含量可能要经过若干步中间过程。
对于多步反应体系,利用关系式法可以节省不必要的中间运算步骤,避免计算错误,并能迅速准确地获得结果。
用关系式解题的关键是建立关系式,建立关系式的方法主要有:1、利用微粒守恒关系建立关系式,2、利用方程式中的化学计量数间的关系建立关系式,3、利用方程式的加合建立关系式。
【巩固】3、已知脊椎动物的骨骼中含有磷。
以下是测定动物骨灰中磷元素含量的实验方法。
称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。
再加入某试剂,使磷酸根又转化成沉淀。
沉淀经灼烧后得到组成为P2Mo24O77的固体(其式量以3.60 ×103计)0.504 g。
试由上述数据计算该骨灰样品中磷的质量分数。
(磷的相对原子质量以31.0 计。
)(4)平均值法【例4】由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是A.锌B.铁C.铝D.镁【点拨】本题利用平均摩尔电子质量求解,据10克金属与足量的盐酸反应产生的氢气在标准状况下为11.2升可得金属平均摩尔电子质量为10g/mol。
四种金属的摩尔电子质量分别为:Zn:32.5g/mol、Fe:28g/mol、Al:9g/mol、Mg:12g/mol,其中只有Al的摩尔电子质量小于10g/mol,故答案为C。
【规律总结】所谓平均值法是一种将数学平均原理应用于化学计算的解题方法。
它所依据的数学原理是:两个数Mr1和Mr2(Mr1大于Mr2)的算术平均值Mr,一定介于两者之间。
所以,只要求出平均值Mr,就可以判断出Mr1和Mr2的取值范围,再结合题给条件即可迅速求出正确答案。
常见方法有:求平均原子量、平均式量、平均摩尔电子质量、平均组成等。
【巩固】4、由10g含有杂质的CaCO3和足量的盐酸反应,产生CO20.1mol,则此样品中可能含有的杂质是A.KHCO3和MgCO3B.MgCO3和SiO2C.K2CO3和SiO2D.无法计算(5)极端假设法当两种或多种物质混合无法确定其成分及其含量时,可对数据推向极端进行计算或分析,假设混合物质量全部为其中的某一成分,虽然极端往往不可能存在,但能使问题单一化,起到了出奇制胜的解题效果。
常用于混合物与其他物质反应、化学平衡混合体系等计算。
【例5】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8 L(标准状况),原混合物的质量可能是A.2 gB.4 gC.8 gD.10 g【点拨】本题给出的数据不足,故不能求出每一种金属的质量只能确定取值范围。
三种金属中产生等量的氢气质量最大的为锌,质量最小的为铝。
故假设金属全部为锌可求的金属质量为8.125g,假设金属全部为铝可求的金属质量为2.25g,金属实际质量应在2.25g ~~8.125g之间。
故答案为B、C。
【规律总结】“极端假设法”是用数学方法解决化学问题的常用方法,一般解答有关混合物计算时采用,可分别假设原混合物是某一纯净物,进行计算,确定最大值、最小值,再进行分析、讨论、得出结论。
【巩固】5、0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。
该混合气体的平均相对分子质量可能是A.30 B.46 C.50 D.66(6)讨论法有一类化学计算题,由于某一条件的不确定,结果可能是两个或两个以上,也可能在某个范围内取值,这类题需要用讨论的方法求解。
常见的类型:1、讨论反应发生的程度;2、讨论反应物是否过量;3、讨论反应物或生成物的组成范围;4、讨论不定方程的解。