过渡元素成键特征讲解
- 格式:ppt
- 大小:411.50 KB
- 文档页数:5


五室下午3组部分过渡元素配合物的常见配位数结构及成键特点过渡元素配合物是指过渡元素原子与配体形成的化合物。
配位数是指配体与中心金属原子或离子之间的键合个数,结构是指配位数相同的配合物之间的空间排列方式,成键特点则是指化学键的性质和特点。
常见的过渡元素配合物的配位数为2、4、6、8等。
其中,配位数为2的常见配合物有线性型配合物,如[Ag(NH3)2]+,[Cu(H2O)2]2+等。
这些配合物中,中心金属原子或离子与两个配体形成两个配位键,配位键通常是靠近直线的方式排列。
配位数为2的配合物成键特点是成键角较大,成键能力较弱。
配位数为4的常见配合物有四方面平面型、四面体型和正方形平面型。
四方面平面型代表物是固态氨合铜(II)离子[Cu(NH3)4]2+,其中中心金属原子与四个氨分子形成四个配位键,配位键呈正方形排列。
四面体型代表物是四氯合钴(II)离子[CoCl4]2-,其中中心金属离子与四个氯离子形成四个配位键,配位键呈四面体排列。
正方形平面型代表物是四对氰合镍(II)离子[Ni(CN)4]2-,其中中心金属离子与四个氰根离子形成四个配位键,配位键呈正方形排列。
配位数为4的配合物成键特点是成键角较小,成键能力较强。
配位数为6的常见配合物是八面体型和六面体型。
八面体型代表物是六氟合铵合镍(II)离子[Ni(NH4)6]2+,其中中心金属离子与六个氨分子形成六个配位键,配位键呈八面体排列。
六面体型代表物是六气体合铁(II)离子[Fe(CO)6],其中中心金属离子与六个CO配体形成六个配位键,配位键呈六面体排列。
配位数为6的配合物成键特点是配体和中心金属原子或离子成键较强。
配位数为8的常见配合物是八面体型。
八面体型代表物是八氯合钨(IV)离子[WCl8]4-,其中中心金属离子与八个氯离子形成八个配位键,配位键呈八面体排列。
配位数为8的配合物成键特点是成键能力很强。
总结起来,过渡元素配合物的常见配位数、结构及成键特点如下:-配位数为2,结构为线性型,成键角较大,成键能力较弱。

过渡元素化学(二)过渡元素是周期表中的一组元素,其电子排布在第3到第12组之间。
这个区域由于有半满或近半满的d轨道和未填满的f轨道,使得这些元素具有特殊的性质,可以表现出很多不同的化学行为。
本文将深入探讨过渡元素的化学性质以及它们在化学反应中所扮演的角色。
1. 过渡元素的物理特征过渡元素具有许多独特的物理特征。
首先,它们具有高密度,高熔点和沸点,因为它们拥有许多未填满的d轨道,这些轨道的电子之间相互作用会导致较强的金属-金属键。
其次,它们通常是良好的导体,因为它们的未填满的d轨道使它们具有离子化趋势,容易失去电子形成正离子或者吸收电子形成负离子。
2. 过渡元素离子的颜色许多过渡元素的离子具有强烈的颜色,这是由于它们的d轨道未填满。
当电子从一个未填满的d轨道移到另一个未填满的d轨道时,会吸收光,而吸收波长的颜色就是离子呈现的颜色。
例如,二价铜在水溶液中呈现蓝色,因为它的四对未填满的d电子在s和p电子之间能吸收波长为580 nm左右的光线,这些电子从第一对d电子到第三对d电子转移。
过渡元素可以呈现多种不同的氧化态,这使得它们在许多有机和无机化学反应中都有不同的用途。
例如,铁可以以氧化态+2形式存在,也可以存在于+3的氧化态下。
由于不同的氧化态会影响到元素的化学性质,因此过渡元素在反应中所扮演的角色也会因其氧化态的不同而有所不同。
4. 过渡元素在催化反应中的作用过渡元素在催化反应中发挥着重要的作用,常见的过渡金属催化反应包括原料的直接活化、分子间的加成、还原等。
许多过渡金属催化剂的成功应用可以归功于它们容易形成中间态,也可以通过自旋、电荷、配体效应等变化调节反应活性。
与此同时,过渡元素也可以得到良好的选择性,这是由于它们的每一种氧化态具有不同的反应性能,所以它们可作为特异性催化剂。
总之,过渡元素是化学反应中非常重要的一类元素,它们具有独特的性质和特征,使得它们在许多不同的化学反应中都有不同的贡献和应用。



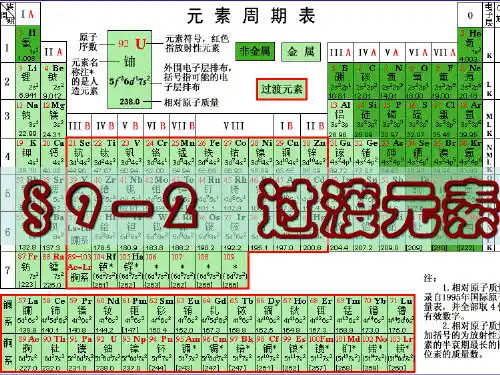
第53节过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅡB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
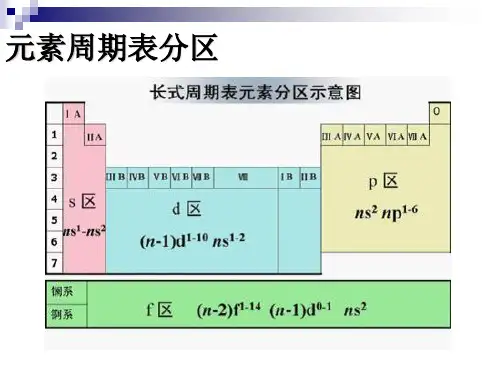
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410℃,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。



过渡元素的特征性质有以下几点。
①都是金属,具有熔点高、沸点高、硬度高、密度大等特性;并有
金属光泽及延展性、高导电性和导热性。
例如钨和钽的熔点分别是3410±20℃和2996℃。
不同的过渡金属之间可形成多种合金。
②②过渡元素中的d电子参与了化学键的形成,所以在它们的化
合物中常表现出多种氧化态。
最高氧化态从每行起始元素(钪、钇、镧)的+3增加到第六个元素(钌、锇)的+8。
在过渡元素的每个竖列中,元素的最高氧化态一般体现在该列底部的元素中,例如在铁、钌、锇这一列里,铁的最高氧化态是+6,而锇则达到+8。
③③过渡元素具有能用于成键的空d轨道和较高的电荷/半径
比, 容易形成稳定的配位化合物,例如能形成Au(CN)娱配离子,可用于在低品位金矿中回收金。
此外,维生素B12是Co(Ⅲ)的配合物,血红素是Fe(Ⅲ)的配合物等。
过渡元素常用作催化剂。
元素周期表中的过渡元素在化学的广袤世界里,元素周期表就像是一座神秘的宝库,而其中的过渡元素则是宝库中璀璨夺目的明珠。
过渡元素以其独特的性质和多样的用途,在化学、材料科学、生物学等众多领域发挥着至关重要的作用。
让我们先来了解一下什么是过渡元素。
过渡元素是指元素周期表中d 区的一系列元素,包括了从第 3 族到第 12 族的元素。
它们的最外层电子构型通常为(n 1)d 1 10 ns 1 2 。
这一特殊的电子构型赋予了过渡元素许多与众不同的化学性质。
过渡元素的一个显著特点是它们具有多种氧化态。
这是因为其 d 轨道上的电子可以参与成键,并且在不同的条件下,d 轨道上电子的得失相对较为容易。
比如铁元素,常见的氧化态有+2 价和+3 价;锰元素则有+2、+4、+6、+7 等多种氧化态。
这种多氧化态的特性使得过渡元素在化学反应中表现出丰富的化学行为。
由于存在未充满的 d 轨道,过渡元素常常形成配合物。
配合物是由中心原子或离子与围绕它的一组分子或离子(称为配体)通过配位键结合而成的化合物。
例如,铜离子可以与氨分子形成深蓝色的四氨合铜离子Cu(NH 3 ) 4 2+ 。
这些配合物在生物体内也具有重要意义,例如血红蛋白中的铁离子与卟啉环形成的配合物,能够实现氧气的运输。
过渡元素的物理性质也颇具特色。
它们大多具有较高的熔点和沸点,这是由于过渡元素原子之间存在较强的金属键。
此外,过渡元素的金属往往具有良好的导电性、导热性和延展性。
在实际应用中,过渡元素的身影无处不在。
在催化领域,过渡元素可谓是“明星选手”。
许多重要的化学反应都需要催化剂来加速反应进程,而过渡金属及其化合物常常充当着这一关键角色。
例如,在工业生产中,铂、钯等过渡金属常用于催化加氢反应;在汽车尾气处理中,铂和铑等元素的催化剂能够将有害气体转化为无害物质。
材料科学中,过渡元素也功不可没。
钛合金由于其高强度、低密度和良好的耐腐蚀性,被广泛应用于航空航天领域;不锈钢中加入铬、镍等过渡元素,大大提高了其抗腐蚀性能。
过渡元素的结构特点与基本性质过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是⾦属,所以也称为过渡⾦属元素。
见表16.1.5s0,是⼀种例外的电⼦排布)。
镧系、锕系的元素的电⼦排布,增加的电⼦填⼊(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层⼆个电⼦层都是未充满的,因此在元素周期表的划分上不属于过渡⾦属元素,⽽属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电⼦构型过渡⾦属价电⼦构型的通式为:(n-1)d1~9 ns1~2。
原⼦核外电⼦排布遵循能量最低原理、保⾥不相容原理和洪特规则。
L. Pauling 原⼦轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有⼀些电⼦排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡⾦属元素常表现为多种氧化态,其根本原因在于内层电⼦的排布,过渡⾦属外层电⼦排布为:(n-1)d1~9 ns1~2 ,(n-1)d 轨道与ns轨道能量相近,部分(n-1)d电⼦参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡⾦属元素的最⾼氧化态与所在的族相等,最⾼氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最⾼氧化态⼩于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电⼦都参与成键。
第十三章过渡元素13-1 过渡元素概述广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素。
它们在长式周期表中位于s区元素和p区元素之间,因而称为过渡元素。
过渡元素单质都是金属,共分为四个系列。
第一过渡系:Sc→Zn;第二过渡系Y →Cd ;第三过渡系Lu →Hg;第四过渡系Lr→Uub。
13-1-1 过渡元素原子的特征一、价层电子构型为n-1)d1-10n s1-2。
二、原子半径变化规律1.过渡元素原子半径一般比同周期主族元素小2.同一周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
3.同族元素从上往下原子半径增大,但五、六周期(除ⅢB)外由于镧系收缩使其同族元素原子半径十分接近,导致其元素性质相似。
13-1-2 单质的物理性质1.过渡金属外观多呈银白色或灰白色,有光泽。
2. 除钪和钛属轻金属外,其余均属重金属。
3.数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。
13-1-3 金属活泼性过渡金属在水溶液中的活泼性,可根据标准电极电势来判断。
1.第一过渡系金属,除铜外,Eθ(M2+/M)均为负值,其金属单质可从非氧化性酸中置换出氢。
2. 同一周期元素从左向右过渡,总的变化趋势是Eθ(M2+/M)值逐渐变大,其活泼性逐渐减弱。
3.同族元素(除Sc分族外)自上往下金属活泼性降低。
13-1-4 氧化数过渡元素除最外层s电子可以成键外,次外层d电子也可以部分或全部参加成键,所以过渡元素的特征之一是具有多种氧化数。
1.期从左到右,元素最高氧化数升高, ⅦB后又降低。
2.从上往下,高氧化数化合物稳定性增加3.过渡元素可形成氧化数为0、-1、-2、-3的化合物.13-1-5 非整比化合物过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。
13-1-6 化合物的颜色过渡元素所形成的配离子大都显色,这主要与过渡元素离子的d轨道未填满电子有关。
其中d0、d10构型的离子无色。
13-1-7 配合性和催化性一、元素容易形成配合物。