协和MDT经典病例分析,你不能错过!
- 格式:docx
- 大小:296.84 KB
- 文档页数:20

mdt病例讨论模板及使用方法mdt病例讨论模板及使用方法1. 引言在医学领域中,多学科团队(Multidisciplinary Team,MDT)病例讨论是一个常见的会议形式,旨在通过不同专业医生的协作讨论,为患者的治疗和护理制定最佳方案。
MDT会议通常由多个科室的专家组成,包括内科、外科、肿瘤学、放射科等,并且每个专业的医生都会就患者的病情提供自己的意见和建议。
MDT病例讨论模板是一种工具,帮助医生系统化地汇总和记录相关病例信息,并确保讨论过程能够高效、全面地进行。
2. MDT病例讨论模板的基本结构(1)患者基本信息:- 尊称、性别、芳龄;- 就诊日期、住院号;- 主要症状和病史。
(2)影像学检查结果:- 包括各种影像学检查的结果,如CT扫描、MRI、X光等。
(3)实验室检查结果:- 包括血液检查、尿液检查、病理学检查等。
(4)诊断:- 根据以上的检查结果,列出初步诊断或可能诊断。
(5)讨论和建议:- 每个参与MDT的专家都可以陈述自己对患者病情的观点和建议; - 参与专家之间可以展开互动、讨论,共同制定治疗方案或进一步的检查计划。
(6)最终决策和治疗计划:- 基于所有专家的观点和建议,制定最终治疗方案;- 涉及到手术治疗的患者,还应包括手术计划。
3. 使用MDT病例讨论模板的方法(1)收集患者相关资料:- 包括影像学检查结果、实验室检查结果、病史等;- 确保资料的准确性和完整性。
(2)组织MDT会议:- 邀请相关科室的专家参与会议;- 确定会议时间和地点。
(3)填写MDT病例讨论模板:- 在模板中逐项填写患者的相关信息;- 确保每个专家在会议前可以提前阅读模板。
(4)进行MDT病例讨论:- 在会议上,由主持人引导,逐项讨论患者的病情和治疗方案; - 每个专家都可以就自己的领域发表意见和建议;- 鼓励专家之间的互动和讨论。
(5)记录和总结讨论结果:- 由主持人或会议记录员负责记录讨论过程,并确保每个专家的观点得以体现;- 结合讨论结果,制定最终的治疗方案。


从协和的一份病例分析看临床思维(支气管扩张鼻窦炎)我个人认为协和的病例分析是国内做的最好的之一,秉承了以病人为教材的传统!是目前临床医生学习的典范!希望大家多留意多学习!咳、痰、喘北京协和医院内科李宁宁呼吸科留永健--------------------------------------------------------------------------------病历摘要患者女,23岁,因“咳嗽、咳痰8周,加重伴喘息6周。
”入院。
患者8周前受凉后出现咳嗽、咳黄绿色痰,伴黄脓涕、低热(最高37.8℃)。
6周前出现气短,伴阵发性喘息,夜间重,不能平卧;喘息时咳白色泡沫样痰,咳嗽加重,黄绿色脓痰量增加,伴畏寒、出汗,明显双下肢水肿。
外院X线胸片显示“双肺纹理重”;痰细菌培养:有2次铜绿假单胞菌、1次奈瑟菌。
先后予静点甲磺酸左氧氟沙星(利复星)6天,克林霉素3天和头孢菌素治疗,患者喘息减轻,体温正常,但仍有较多脓痰。
此后间断用左氧氟沙星(可乐比妥)、庆大霉素、喘定、氨茶碱及糖皮质类固醇吸入等治疗,未见好转。
我院门诊行鼻窦CT“左上颌窦炎,右上颌窦黏膜厚”;血气分析提示低氧血症;冷凝集试验(-);予头孢丙烯(施复捷)、阿奇霉素(希舒美)及吸氧治疗,患者喘息症状明显缓解,夜间可平卧,黄绿色痰量减少,但仍有低热,流黄涕,轻微活动后气短,为进一步诊治收入我院。
既往史出生40天曾诊为“喘息性肺炎”,20年来反复发生上呼吸道感染(平均每月1次);12岁患“鼻窦炎”;17岁患“缺铁性贫血”(近年来反复发作);6年前曾咯血,X线胸片诊为“支气管扩张”。
个人史:患者在烟灰厂附近居住17年,居住区内有人养鸽子。
父亲有类似病史。
入院查体双侧筛窦及上颌窦区压痛(右侧为著)。
胸廓对称,形态正常,胸骨无压痛,触觉语颤减弱,双肺叩诊清音;双肺可闻及散在湿罗音和弥漫性哮鸣音,双下肺有较多细小爆裂音。
主动脉瓣、肺动脉瓣区均闻及S2亢进。







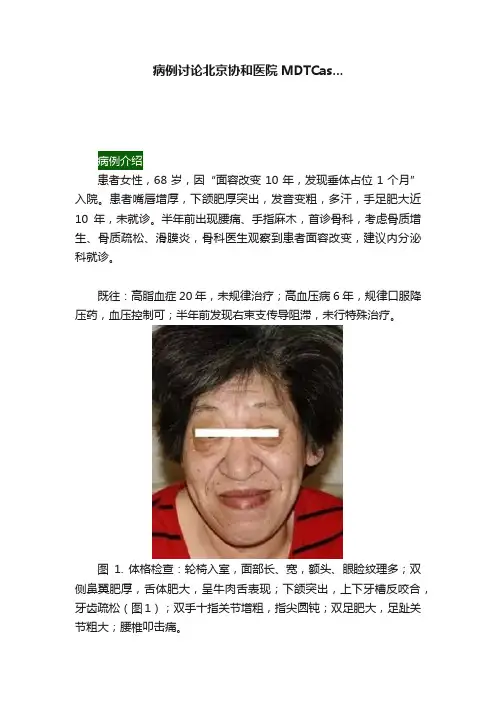
病例讨论北京协和医院MDTCas...患者女性,68岁,因“面容改变10年,发现垂体占位1个月”入院。
患者嘴唇增厚,下颌肥厚突出,发音变粗,多汗,手足肥大近10年,未就诊。
半年前出现腰痛、手指麻木,首诊骨科,考虑骨质增生、骨质疏松、滑膜炎,骨科医生观察到患者面容改变,建议内分泌科就诊。
既往:高脂血症20年,未规律治疗;高血压病6年,规律口服降压药,血压控制可;半年前发现右束支传导阻滞,未行特殊治疗。
图1. 体格检查:轮椅入室,面部长、宽,额头、眼睑纹理多;双侧鼻翼肥厚,舌体肥大,呈牛肉舌表现;下颌突出,上下牙槽反咬合,牙齿疏松(图1);双手十指关节增粗,指尖圆钝;双足肥大,足趾关节粗大;腰椎叩击痛。
图2. 鞍区增强MRI示:蝶鞍扩大,增强扫描可见垂体左翼强化减低区,部分包绕左侧颈内动脉,Knosp分级III级(图2A、2B)。
实验室检查:葡萄糖生长激素抑制试验(OGTT试验):OGTT: 0 30 60 120 180 minGlu: 6.5 11.4 16.3 12.2 7.7 mmol/LGH: 8.7 6.87 30.1 32.1 20.1ng/mlIGF-1: 998 ng/ml↑;垂体-肾上腺轴:F:16.4ug/dl, ACTH:41.9pg/ml,UFC/24hr:85ug;垂体-甲状腺轴:FT3:3.26pg/ml, FT4:1.38ng/dl, TSH:0.938uIU/ml;垂体-性腺轴:LH:19.5mIU/mL, FSH:53.4mIU/ml, E2:22.7pg/ml, T:41.2ng/dl;糖化血红蛋白:6.5%↑;血脂四项:TC:4.58mmol/L,TG:0.8mmol/L, HDL-C:2.09mmol/L, LDL-C:2.06mmol/L。
并发症检查:心电图示:心室性期前收缩,窦性心动过缓,急性前壁梗塞,aVL、V6导联ST-T段异常,右心房增大,QT缩短,轻度左心电轴偏转。
mdt会诊记录范文以下是为您生成的一篇以“MDT 会诊记录”为主题的作文,希望能满足您的需求:---#在医院这个充满着生死较量和希望交织的地方,MDT 会诊就像是一场为患者精心策划的“战斗策略会”。
今天,我就有幸参与并见证了这样一次特别的 MDT 会诊。
患者是一位年近七旬的大爷,姓张。
张大爷之前一直身体还算硬朗,每天早上都能在公园里打上一套太极拳。
可最近一段时间,他却突然觉得身体不对劲了。
先是胃口变得很差,吃啥都不香,接着整个人迅速消瘦下来,脸色也越来越苍白。
家里人一看这情况,赶紧把他送到了我们医院。
经过初步的检查,发现张大爷的问题可不简单。
他的腹部有个肿块,肝脏上也有一些异常的阴影,而且血液检查的指标也有很多不正常的地方。
这下可把主管医生给难住了,单靠一个科室的力量,很难确切地诊断出到底是什么病,更别说制定有效的治疗方案了。
于是,一场MDT 会诊就这样紧锣密鼓地安排上了。
会诊的那天,会议室里坐满了各个科室的专家。
有肿瘤科的主任,一脸严肃,手里拿着一叠厚厚的病历资料;有消化内科的专家,目光专注,不时在本子上记录着什么;还有影像科的医生,面前摆着张大爷的各种片子,正仔细地对比着。
我作为一名小跟班,缩在角落里,心里既紧张又好奇,不知道这场会诊会得出怎样的结论。
首先发言的是主管医生,他详细地介绍了张大爷的病情和目前已经做过的检查结果。
听着他的叙述,我心里暗暗佩服,这几天他为了张大爷的病,可真是没少下功夫,每一个细节都了解得清清楚楚。
接着,影像科的医生拿起片子,走到投影仪前。
“大家看啊,这腹部的肿块边界不是很清晰,而且和周围的组织似乎有粘连。
肝脏上的阴影呢,密度也不均匀。
从这些影像表现来看,我觉得恶性肿瘤的可能性比较大。
”他一边指着片子上的各个部位,一边认真地解释着。
肿瘤科的主任点了点头,“嗯,从影像上看是有这种可能。
但我们还得结合患者的临床表现和其他检查结果综合判断。
”说着,他转过头问消化内科的专家,“患者的消化道症状你们怎么考虑?”消化内科的专家推了推眼镜,说道:“患者胃口差、消瘦,可能是肿瘤导致的消化功能紊乱。
协和MDT经典病例分析,你不能错过!丁香智汇中高级医生的学术加油站关注作者:夏鹏1,马莹1,张磊1,李明喜1,陈丽萌1,李雪梅1,张路2,冯俊2,李剑2,郭潇潇3,程中伟3,李秉璐4,宋锴澄5,冯瑞娥6,甘佳 7,王勤8单位:北京协和医院1 肾内科,2血液内科,3心内科,4基本外科,5麻醉科,6病理科,7输血科,8放射科通信作者:张磊本文即刊登于《协和医学杂志》2019 年第 1 期贫血,肾病综合征,心肌淀粉样变,高丙种球蛋白血症,腹腔占位1病人简历患者女性,48 岁,因「乏力 7 年,腹胀 4 年,血肌酐升高 2 个月」于 2017 年 6 月 30 日收住北京协和医院肾内科。
1现病史患者2010 年出现乏力,伴面色苍白,活动耐量减低。
当地医院查血常规示血红蛋白 (Hb)最低 30~40 g/L,予铁剂治疗后可维持在60~70 g/L。
2013 年起患者自觉上腹胀,可触及剑突下质韧肿块,边界不清,无恶心、呕吐、腹痛,未详细诊治。
2017 年4 月患者出现颜面部及双下肢水肿,自觉尿量减少(约500~800 ml/d),尿色正常,尿中泡沫增多,无发热、喘憋。
当地医院查血肌酐>300 μmol/L,予中药治疗 2 周后尿量恢复至约 1500 ml/d,水肿减轻,无夜尿增多。
2017 年 5 月 9 日患者周身无力伴眩晕、心悸、大汗、呼吸困难、恶心呕吐,随后晕厥伴短暂意识丧失,醒后无法回忆,无抽搐、双眼上翻等表现。
当地医院查心电图示心率40 次/min,血常规示白细胞(WBC)7.26×109/L,中性粒细胞计数(NEUT)5.71×109/L,Hb 61 g/L,血小板(PLT)418×109/L;血生化示白蛋白23 g/L,球蛋白 72 g/L,血浆二氧化碳总量 17.9 mmol/L,血钙 1.91 mmol/L,乳酸脱氢酶 159 U/L,血钾 7.3 mmol/L,血肌酐158 μmol/L;予对症、输血、降钾治疗后 Hb 升至 109 g/L,血钾降至 4.8 mmol/L,血肌酐降至78.8 μmol/L,患者心率、神志恢复正常,生命体征稳定。
进一步完善检查,凝血功能检查示凝血酶原时间16.1 s,活化部分凝血活酶时间 34.3 s,国际标准化比值 1.37,D-二聚体509 μg/L;尿常规+尿沉渣检查示隐血(+),尿蛋白(+++),尿红细胞12.4 个/μl;24 h 尿蛋白定量 4.17 g。
自身抗体:抗核抗体均质型1∶100(+);抗中性粒细胞胞浆抗体、抗肾小球基膜抗体(-)。
酸化血清溶血试验(-),直接抗人球蛋白试验IgG、C3d(+),补体正常。
红细胞沉降率 46 mm/h,超敏 C-反应蛋白 148 mg/L。
免疫球蛋白:IgG 49.2 g/L,IgA4.67 g/L,IgM 3.46 g/L。
血、尿免疫固定电泳(-),血游离轻链κ 267.7 mg/L,λ 139.82 mg/L,κ/λ1.91,当地医院给予对症治疗。
患者因诊断困难,于2017 年6 月至北京协和医院就诊,查血清IgG 亚类:IgG1 35 300 mg/L,IgG2 9670 mg/L,IgG3 1410 mg/L,IgG4 3840 mg/L;抗核抗体18项: 抗核抗体1∶80(+),余(-)。
起病以来,精神、食欲、睡眠可。
大便 1~2 次/d。
2 个月前体重下降 5 kg,有活动后乏力,平地持续行走距离不足300 m、上楼梯1~2 层即感胸闷。
2既往史患者有青霉素过敏史,余无特殊。
3入院查体体温36.8 ℃,呼吸20 次/min,心率70 次/min,血压90/60 mmHg。
体型消瘦,体质量指数 15.4 kg/m2。
舌体无胖大,心、肺听诊无特殊。
腹壁可见散在血管瘤样皮疹,腹软,左肋缘、剑突下可及质韧肿块,直径约 6 cm,有轻度压痛,无明显肌紧张,肝、脾触诊边界不清晰,麦氏点、双输尿管点无压痛。
4实验室检查血常规:WBC 2.90×109/L,NEUT1.82×109/L,Hb 70 g/L,平均红细胞体积90.4 fl,平均红细胞血红蛋白浓度308 g/L,平均红细胞血红蛋白量27.2 pg,PLT 222×109/L,网织红细胞2.48%。
血生化:白蛋白19 g/L,二氧化碳总量19.7 mmol/L,尿素10.21 mmol/L,肌酐134 μmol/L,胆红素在正常范围内;外周血涂片检查正常。
心脏指标:心肌肌钙蛋白0.190 μg/L,氨基末端脑钠肽前体22948 pg/ml,脑尿钠肽1259 ng/L。
凝血功能:凝血酶原时间16.6 s,国际标准化比值1.42,活化部分凝血活酶时间43.6 s,D-二聚体0.40mg/L FEU;1∶1血浆活化部分凝血活酶时间纠正试验部分纠正;便潜血(-)。
尿常规+尿沉渣检查:隐血试验红细胞25个/μl,尿蛋白浓度1.0 g/L。
24 h尿总蛋白定量4.84 g。
炎症指标:红细胞沉降率115 mm/h,超敏C-反应蛋白88.92 mg/L。
免疫球蛋白:IgG 46.38 g/L,IgA4.79 g/L,IgM 3.09 g/L。
铁四项检查:血清铁49.2 μg/dl,血清铁总铁结合力198μg/dl,铁饱和度24.8%,转铁蛋白饱和度25.1%,血清铁蛋白624 ng/ml。
自身抗体:抗人球蛋白试验(+),抗β2糖蛋白1 抗体24 RU/ml,抗可提取性核抗原抗体、抗中性粒细胞胞浆抗体均(-)。
感染指标:EB病毒、巨细胞病毒、输血8项(乙肝五项、丙肝、梅毒、人类免疫缺陷病毒)、结核感染T细胞检测、TORCH-IgM均(-)。
血、尿免疫固定电泳、血清蛋白电泳(-),血游离轻链检查示无明确M蛋白证据。
肾脏彩色多普勒超声检查:右肾10.9 cm×4.4 cm×5.5cm,左肾11.5 cm×5.4 cm×4.8 cm。
骨髓涂片检查:大致正常。
炎症因子:白细胞介素(IL)-6 257.0 pg/ml,肿瘤坏死因子-α 17.4 pg/ml,IL-8及IL-10正常范围内,血管内皮生长因子871 pg/ml;人类疱疹病毒8型DNA(-)。
心电图检查:窦性心律,肢体导联低电压,Ⅰ度房室传导阻滞,V3~V6导联T波倒置。
超声心动图:心肌病变,双房明显增大,左右室壁均增厚,心肌回声增强,右室收缩功能正常低限,下腔静脉吸气变化率<50%,左心室舒张功能受限,轻度肺动脉高压,左室射血分数69%。
经心内科会诊进一步完善24 h动态心电图示:持续房扑?可见室性心搏10次,单个室性早搏7次,室性心动过速1次。
心肌灌注延迟成像动态磁共振成像示左心房增大;室间隔心肌增厚,室间隔、左室前壁基底段及中间段心肌中层片状延迟强化;左室及右室心内膜下、右房及房间隔线样延迟强化,心肌病变可能,淀粉样变性不除外。
影像学检查:腹部盆腔增强CT+三维重建(图1):肝胃间隙软组织肿物,边缘光滑,最大截面约77 mm×50 mm×66 mm,平扫CT值约为46 HU,其内密度不均,可见多发点状及结节状钙化。
增强CT扫描,动脉期轻中度不均匀强化,门脉期及延迟期明显强化;肿块由脾动脉分支、肝固有动脉分支及胃十二指肠动脉分支供血;静脉回流至脾静脉及门静脉主干。
肿块后缘与胰腺前缘局部脂肪间隙模糊,分界欠清;腹膜后、腹腔肝门区多发肿大淋巴结。
躯干+头部PET/CT示肝胃间隙见软组织密度影,大小约6.6 cm×5.4 cm×7.6 cm,内见点状高密度影,放射性摄取不均匀增高,标准摄取值最高约4.6;肝大,脾大。
回盲部局部肠壁增厚,放射性摄取增高,范围约3.3 cm×2.5 cm×2.9 cm,标准摄取值最高约4.0。
图 1 腹部盆腔增强CT扫描+三维重建可见肝胃间占位.A.冠状位(箭头所示为肿物);B.门脉期(箭头所示肿物静脉由门静脉属支引流);C、D.动脉期(箭头所示肿物分别由脾动脉和胃十二指肠动脉分支供血);E.平扫期(箭头所示肿物内存在钙化)消化内镜检查:胃镜示慢性萎缩性胃炎;肠镜见回肠末段黏膜光整,盲袋结构正常,阑尾开口清晰,回盲瓣呈唇形,未见溃疡、糜烂及新生物。
2第一次多学科讨论1放射科根据腹部盆腔 CT 影像分析:患者肝、脾明显增大,肝脏强化不均,呈「龟背样」表现,可为肝淤血所致;双侧肾脏肿大,右肾为著,皮髓质分界欠清,实质强化明显减低、延迟;肠系膜密度混浊,伴腹部盆腔积液。
最突出的异常为肝胃间的巨大占位,该肿块平扫密度较均匀,内可见点线状钙化,增强后呈偏均匀的中等强化,未见明确坏死区。
此处占位需考虑的鉴别诊断包括:淋巴增殖性疾病、间叶组织来源肿瘤及胃肠道间质瘤等。
后两者在病变较大时常出现坏死区,故密度及强化不匀,与本例表现不符。
三维重建显示肿块与胃部无明显相连,血供丰富,由脾动脉分支、肝固有动脉分支及胃十二指肠动脉分支供血;引流静脉主要是脾静脉和门脉的属支。
结合临床表现和影像资料,首先考虑Castleman 病(Castleman's disease,CD)。
CD 影像学常表现为边界清晰的肿块,可合并淋巴结肿大,也可孤立存在,平扫密度均匀,少有中央坏死区,增强后强化明显且较均匀,其中透明血管型强化最为显著(可近似动脉强化程度),浆细胞型强化程度稍低,混合型强化程度介于上述两者之间。
如果病变内有粗大或分支状钙化,对于诊断本病有提示意义。
2血液内科患者为中年女性,慢性病程,临床呈现多器官受累,表现为贫血,多克隆/反应性高丙种球蛋白血症,包括 IL-6 在内的多种炎症指标显著升高,腹腔存在巨大占位,不除外淋巴增殖性疾病。
CD 又称巨大淋巴结病或血管滤泡性淋巴结增生症,是一种较为少见的淋巴增殖性疾病。
临床上根据肿大淋巴结分布和器官受累情况不同,将 CD 分为单中心型 (UCD) 和多中心型 (MCD)。
腹腔的巨大淋巴结是常见发病部位,多伴有明显炎症状态,偶而合并自身免疫性溶血性贫血。
本患者为小细胞低色素性贫血,无明显网织红细胞、胆红素升高,血涂片正常,整体考虑是长期高炎症状态引起的慢性病贫血可能性大,溶血性贫血证据不足。
尽管PET/CT 提示回盲部有高摄取,但消化内镜检查无明确异常提示。
综合分析,考虑CD 可能性大,建议完整切除腹腔占位,对于诊断和治疗均有重要意义。
至于凝血异常,高丙种球蛋白血症对检测有干扰,目前1∶1 血浆活化部分凝血活酶时间纠正试验部分纠正,根据手术需要,可在围手术期补充血浆以降低出血风险。
3心内科患者为中年女性,慢性病程,长期活动耐量减低,近期加重,结合脑尿钠肽显著升高,考虑存在慢性心功能不全。