Mpa℃蒸汽放热后变为Mpa℃水的放热量计算
- 格式:docx
- 大小:240.65 KB
- 文档页数:2



0.1M p a,180℃蒸汽放热后变为0.1M p a,40℃水的放热量计算
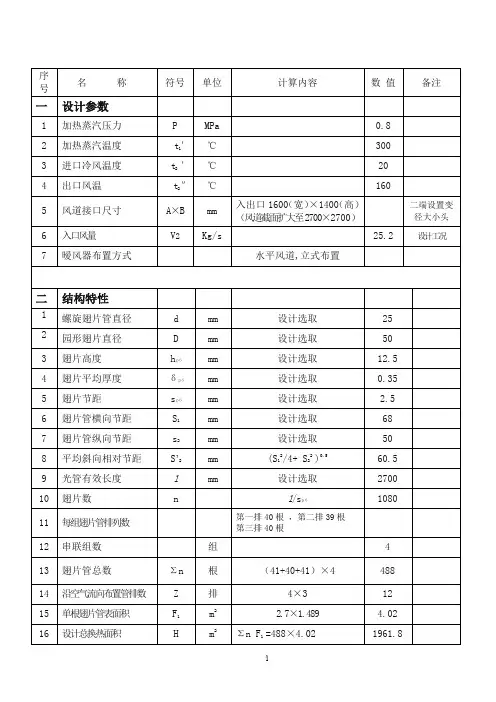
0.1Mpa,180℃蒸汽焓值:2835.7kJ/kg;
0.1Mpa,100℃蒸汽焓值:2676.3kJ/kg;
0.1Mpa,100℃水焓值:419.54kJ/kg;
0.1Mpa,40℃水焓值:168.06kJ/kg;
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg;
水的近似比热容4.2kJ/kg℃
水蒸气的近似比热容1.85kJ/kg℃
一、焓值算法
180℃蒸汽变成40℃水,放热量为焓值差:2835.7-168.06=2667.64kJ/kg
二、热容算法
180℃蒸汽变成100℃蒸汽,放热为:1.851180-100=148kJ/kg
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg100℃蒸汽变为100℃水焓变为:2676.3-419.54=2256.76kJ/kg比汽化潜热值少1.64kJ/kg
100℃水变成40℃水,放热为:4.21100-40=252kJ/kg
一共放热量为:148+2258.4+252=2658.4kJ/kg
三、分步组合算法
180℃蒸汽变成100℃蒸汽,放热量焓值差:2835.7-2676.3=159.4kJ/kg对比热容算法多1.4kJ/kg
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg
100℃水变成40℃水,放热量焓值差:419.54-168.06=251.48kJ/kg对比热容算法少0.52kJ/kg
一共放热量为:159.4+2258.4+251.48=2669.28kJ/kg。

工程上用的气态工质可以分为两类,即气体和蒸气,两者之间并无严格的界限。
蒸气泛指刚刚脱离液态或比较接近液态的气态物质,在被冷却或被压缩时,很容易变回液态。
一般地说,蒸气分子间的距离较小,分子间的作用力及分子本身的体积不能忽略,因此,蒸气一般不能作为理想气体处理。
工程上常用的蒸气有水蒸气、氨蒸气、氟利昂蒸气等。
由于水蒸气来源丰富,耗资少,无毒无味,比热容大,传热好,有良好的膨胀和载热性能,是热工技术上应用最广泛的一种工质。
各种物质的蒸气虽然各有特点,但其热力性质及物态变化规律都有许多类似之处。
这里仅以水蒸气(简称蒸汽)为例,对它的产生、状态的确定及其基本热力过程进行分析。
1. 蒸气是由液体汽化而产生的。
液体汽化有两种形式:蒸发和沸腾。
蒸发是在液体表面进行的汽化现象。
由于液体分子处于无规则的热运动状态,每个分子的动能大小不等,在液体表面总会有一些动能大的分子克服邻近分子的引力而逸出液面,形成蒸气,这就是蒸发。
蒸发可以在任何温度下进行,但温度愈高,能量较大的分子愈多,蒸发愈强烈。
与蒸发不同,在给定的压力下,沸腾是在某一特定温度下发生、在液体内部和表面同时进行并且伴随着大量汽泡产生的剧烈的汽化现象。
实验证明,液体沸腾时,尽管对其继续加热,但液体的温度保持不变。
无论蒸发还是沸腾,如果液面上方是和大气相连的自由空间,那么一般情况下汽化过程可以一直进行到液体全部变为蒸气为止。
当液体在有限的密闭空间内汽化时,则不仅有分子逸出液体表面而进入蒸气空间,而且也会有分子从蒸气空间落到液体表面,回到液体中。
开始时,单位时间从液面逸出的分子多于返回液面的分子,蒸气空间中的分子数不断增加。
但当蒸气空间中蒸气的密度达到一定程度时,在同一时间内逸出液面的分子就会与回到液面的分子数目相等,气、液两相达到了动态平衡,这种状态称为饱和状态。
饱和状态下的液体和蒸气分别称为饱和液体和饱和蒸气。
饱和蒸气的压力和温度分别称为饱和压力(用p s表示)和饱和温度(用t s表示),二者一一对应,且饱和压力愈高,饱和温度也愈高,例如:对于水蒸气,当p s=0.10325MPa 时,t s=100℃;当p s=1MPa 时,t s=179.916℃。

化工热力学第二章作业解答2.1试用下述三种方法计算673K ,4.053MPa 下甲烷气体的摩尔体积,(1)用理想气体方程;(2)用R-K 方程;(3)用普遍化关系式解 (1)用理想气体方程(2-4)V =RT P =68.3146734.05310⨯⨯=1.381×10-3m 3·mol -1 (2)用R-K 方程(2-6)从附录二查的甲烷的临界参数和偏心因子为Tc =190.6K ,Pc =4.600Mpa ,ω=0.008将Tc ,Pc 值代入式(2-7a )式(2-7b )2 2.50.42748c cR T a p ==2 2.560.42748(8.314)(190.6)4.610⨯⨯⨯=3.224Pa ·m 6·K 0.5·mol -2 0.0867c cRT b p ==60.08678.314190.64.610⨯⨯⨯=2.987×10-5 m 3·mol -1 将有关的已知值代入式(2-6)4.053×106= 58.3146732.98710V -⨯-⨯-0.553.224(673)( 2.98710)V V -+⨯ 迭代解得V =1.390×10-3 m 3·mol -1(注:用式2-22和式2-25迭代得Z 然后用PV=ZRT 求V 也可)(3)用普遍化关系式673 3.53190.6r T T Tc === 664.053100.8814.610r P P Pc ⨯===⨯ 因为该状态点落在图2-9曲线上方,故采用普遍化第二维里系数法。
由式(2-44a )、式(2-44b )求出B 0和B 1B 0=0.083-0.422/Tr 1.6=0.083-0.422/(3.53)1.6=0.0269B 1=0.139-0.172/Tr 4.2=0.139-0.172/(3.53)4.2=0.138代入式(2-43)010.02690.0080.1380.0281BPc B B RTcω=+=+⨯= 由式(2-42)得Pr 0.881110.0281 1.0073.53BPc Z RTc Tr ⎛⎫⎛⎫=+=+⨯= ⎪⎪⎝⎭⎝⎭V =1.390×10-3 m 3·mol -12.2试分别用(1)Van der Waals,(2)R-K ,(3)S-R-K 方程计算273.15K 时将CO 2压缩到比体积为550.1cm 3·mol -1所需要的压力。

蒸汽潜热计算⽅法⼀、计算⽅法蒸发量⽤重量M(Kg)来标度供热量Q(J)由温升热与⽓化潜热两部分组成。
1.温升热量Q1(J):温升热与蒸发介质的热容和蒸发介质的温升成正⽐,即:Q=C×M×ΔT;ΔT=T2-T1 热容C:J/Kg.℃这是个⾮常简单的公式,⽤于计算温升热量,液体的饱和压⼒随温度的提⾼⽽上升⾄液体表⾯上⽅压⼒时开始蒸发。
2.蒸发潜热Q2(J)为:Q2=M×ΔHΔH:液体的蒸发焓(汽化热)J/Kg3.总供热量Q=Q1+Q2⼆.举例现在需要⽤蒸汽来加热⽔,已经蒸汽的参数为0.8mpa,300℃,⽔量为12t/h,⽔温为57℃,现在将蒸汽直接通过⽔混合将来⽔加热到62℃,请问需要多少蒸汽呢?是否是按照等焓来计算呢放出热量为:蒸汽变成100℃⽔的冷凝潜热热量加上100℃的冷凝⽔变为62℃⽔放出的热量之和。
设需要蒸汽D千克/h。
吸收的热量为:12吨⽔从57℃升到62℃吸收的热量.数值取值为:⽔的⽐热按照C=1千卡/千克℃计0.8mpa,300℃蒸汽的冷凝潜热约为r=330千卡/千克,1吨蒸汽⽣成1吨凝液。
凝液温度为100℃,不考虑损失。
Q吸收=Cm(t2-t1)=1×12000×(62-57)=60000千卡/hQ冷凝放热=Dr=330DQ冷凝⽔降温放热= CD(T2-T1)=1×D×(100-62)=38 DQ吸收=Q冷凝放热+ Q冷凝⽔降温放热330 D+38 D=60000=163kg/h因此,需要该品位蒸汽0.163T/H,⽔量加热后上升到12.136t/h损失就按5-10%考虑了。
例⼦21吨⽔变成⽔蒸⽓是多少⽴⽅假设⽔的起始温度为20度;加热成为140度的⽔蒸汽(假设为饱和⽔蒸汽⽽不是过热⽔蒸汽)。
1,简略计算:常压下⽔的汽化热为540 千卡/公⽄;需要的热量:(140-20)*1000=120000千卡,再加上汽化热540000千卡,共计660000千卡。


一、计算方法蒸发量用重量M(Kg)来标度供热量Q(J)由温升热与气化潜热两部分组成。
1.温升热量Q1(J):温升热与蒸发介质的热容和蒸发介质的温升成正比,即:Q=C×M×ΔT;ΔT=T2-T1 热容C:J/Kg.℃这是个非常简单的公式,用于计算温升热量,液体的饱和压力随温度的提高而上升至液体表面上方压力时开始蒸发。
2.蒸发潜热Q2(J)为:Q2=M×ΔHΔH:液体的蒸发焓(汽化热)J/Kg3.总供热量Q=Q1+Q2二.举例现在需要用蒸汽来加热水,已经蒸汽的参数为0.8mpa,300℃,水量为12t/h,水温为57℃,现在将蒸汽直接通过水混合将来水加热到62℃,请问需要多少蒸汽呢?是否是按照等焓来计算呢放出热量为:蒸汽变成100℃水的冷凝潜热热量加上100℃的冷凝水变为62℃水放出的热量之和。
设需要蒸汽D千克/h。
吸收的热量为:12吨水从57℃升到62℃吸收的热量.数值取值为:水的比热按照C=1千卡/千克℃计0.8mpa,300℃蒸汽的冷凝潜热约为r=330千卡/千克,1吨蒸汽生成1吨凝液。
凝液温度为100℃,不考虑损失。
Q吸收=Cm(t2-t1)=1×12000×(62-57)=60000千卡/hQ冷凝放热=Dr=330DQ冷凝水降温放热= CD(T2-T1)=1×D×(100-62)=38 DQ吸收=Q冷凝放热+ Q冷凝水降温放热330 D+38 D=60000=163kg/h因此,需要该品位蒸汽0.163T/H,水量加热后上升到12.136t/h损失就按5-10%考虑了。
例子21吨水变成水蒸气是多少立方假设水的起始温度为20度;加热成为140度的水蒸汽(假设为饱和水蒸汽而不是过热水蒸汽)。
1,简略计算:常压下水的汽化热为540 千卡/公斤;需要的热量:(140-20)*1000=120000千卡,再加上汽化热540000千卡,共计660000千卡。

热力学是研究热与其他形式能量转化的一门学科。
蒸汽加热水是热力学中常见的一个过程,它涉及到热量的传递和物质状态的改变。
在本文中,我们将从简到繁地探讨蒸汽加热水的过程,深入分析其中涉及的热量转化和状态变化,以便读者能更深入地理解这一过程。
让我们从蒸汽加热水的基本过程开始。
蒸汽加热水是指将蒸汽与水接触并传递热量,使水的温度升高。
在这一过程中,热量从蒸汽传递到水,导致水的温度上升。
要计算蒸汽加热水从25度到50度吸收的热量,我们需要首先了解水的热容和蒸汽的热传导能力。
我们来分析蒸汽加热水的热量传递过程。
热量的传递可以通过热传导、对流和辐射等方式进行。
在蒸汽加热水的过程中,主要是通过热传导进行热量的传递。
蒸汽与水接触后,热量从高温的蒸汽传递到低温的水,使得水的温度升高。
这一过程符合热传导的规律,根据热传导的方程可以计算出蒸汽加热水吸收的热量。
接下来,让我们深入分析水的温度升高与状态变化之间的关系。
在蒸汽加热水的过程中,水的温度从25度升高到50度,这意味着水在这一过程中发生了状态变化。
根据热力学的知识,水的温度升高是因为热量传递给水,使得水分子的热运动增加。
当水的温度达到100度时,水会发生相变,从液态转变为气态。
这一状态转变所需的潜热也是我们需要计算的一部分。
在总结和回顾本文内容时,我们可以得出蒸汽加热水从25度到50度吸收的热量是由蒸汽传递给水产生的。
在这一过程中,热量的传递遵循热传导的规律,使得水的温度上升并发生相变。
对于这一过程,我们需要考虑水的热容、蒸汽的热传导能力以及相变的潜热等因素。
通过计算和分析这些因素,我们可以得出蒸汽加热水从25度到50度吸收的热量的具体数值。
个人观点和理解方面,蒸汽加热水是热力学中一个典型的热量传递和状态变化过程。
通过深入分析这一过程,我们可以更好地理解热量的传递规律和物质状态的改变规律。
对于工程和科学领域的研究和应用具有重要意义。
我们需要深入学习和掌握热力学的知识,以更好地应用于实际工程和科学问题中。
热量交换公式详解,关于热量换算例题详解热量,指的是由于温差的存在而导致的能量传递过程中所转移的能量。
而该传递过程称为热交换或热传递。
热量的单位为焦耳。
人体的一切生命活动都需要能量,如物质代谢的合成反应、肌肉收缩、腺体分泌等等。
而这些能量主要来源于食物。
动、植物性食物中所含的营养素可分为五大类:碳水化合物、脂类、蛋白质、矿物质和维生素,加上水则为六大类。
其中,碳水化合物、脂肪和蛋白质经体内氧化可释放能量。
三者统称为“产能营养素”或“热源质”。
一、热量的计算公式1.吸热公式:Q吸=cm(t-t0)解释:式中c表示物质的比热容,m表示物质的质量,t0表示物体原来的初温,t表示吸热后的终温,“t-t0”表示温度的升高,有时可用△t升=t-t0表示。
此时吸热式可写成:Q吸=cm•△t升.2.放热公式:Q放=cm(t0-t)解释:式中c、m、t0、t的含义不变,“t0-t”表示温度的降低,有时可用△t降=t0-t表示。
此时放热公式可写成:Q放=cm•△t降。
3.热量计算的一般式:Q=cm△t解释:△t表示温度的变化。
可见物体吸收或放出热量的多少由物体质量、物质比热容和物体温度的变化量这三个量的乘积决定,跟物体的温度的高低无关。
二、热量计算题解题步骤:1、熟读题目,划出题目中的重点已知信息(数字及表示的物理量)。
2、理解题目所问的问题是什么。
3、根据问题选择恰当的公式。
4、将数据(带单位)代入公式中进行运算,得出结果。
三、解题注意事项:1.首先要弄清题目所描述的是怎样的物理过程,在这个物理过程中涉及哪些物理量,应标清要计算的是哪个物体在哪个过程中吸收(或放出)的热量,燃料燃烧放出的热量是全部被物体吸收,还是部分被物体吸收。
2.然后确定好研究对象,选取适当的公式,代入已知量,可求出待求的物理量。
4、热量计算例题详解例1:甲、乙两物体的质量相等,甲物体温度升高10℃时吸收的热量恰好等于乙物体温度升高20℃时吸收的热量,则甲、乙两物体的比热之比为()A.1∶2B.2∶1C.1∶4D.4∶1分析:利用甲物体和乙物体吸收热量相等的关系和吸热公式建立等式.求出两物体的比热之比.或者利用已知条件和比热公式求比值.方法一:根据公式Q甲=c甲mΔt甲Q乙=c乙mΔt乙由于Q甲=Q乙Δt甲=10℃Δt乙=20℃,则有:c甲m×10℃=c乙m×20℃则:c甲∶c乙=2∶1.方法二:根据比热的定义式:c=Q/mΔt得:c甲=Q甲/m甲Δt甲c乙=Q乙/m乙Δt乙由于有:Δt甲=10℃Δt乙=20℃Q甲=Q乙m甲=m乙则有:c甲∶c乙=(Q甲/m甲Δt甲)∶(Q2/m2Δt乙)=Δt乙∶Δt甲=2∶1答案:B易错分析:本题出错主要有两个原因:一是物体的吸放热公式使用错误,或在公式变形时,将比热的表示式写错,导致解题错误.二是比例方法使用错误.不会利用比例方法求两物体比热之比或约不去能约掉的物理量,或者在计算时出错。
一、判断题:1. 平衡状态一定稳定状态。
2。
热力学第一定律的实质是能量守恒定律;3.公式d u = c v d t 适用理想气体的任何过程。
4.容器中气体的压力不变则压力表的读数也绝对不会改变。
5.在T-S 图上,任意二条可逆绝热过程线不能相交。
6.膨胀功与流动功都是过程的函数.7.当把一定量的从相同的初始状态压缩到相同的终状态时,以可逆定温压缩过程最为省功。
8.可逆过程是指工质有可能沿原过程逆向进行,并能恢复到初始状态的过程。
9。
根据比热容的定义式T q d d c,可知理想气体的为一过程量;10. 自发过程为不可逆过程,非自发过程必为可逆过程;11.在管道内作定熵流动时,各点的滞止参数都相同。
12.孤立系统的熵与能量都是守恒的。
13.闭口绝热系的熵不可能减少.14.闭口系统进行了一个过程,如果熵增加了,则一定是从外界吸收了热量。
15.理想气体的比焓、比熵和比定压热容都仅仅取决与温度.16.实际气体绝热节流后温度一定下降。
17.任何不可逆过程工质的熵总是增加的,而任何可逆过程工质的熵总是不变的。
18。
不可逆循环的热效率一定小于可逆循环的热效率;19.混合气体中质量成分较大的组分,其摩尔成分也一定大。
20.热力学恒等式du=Tds —pdv 与过程可逆与否无关。
21.当热源和冷源温度一定,热机内工质能够做出的最大功就是在两热源间可逆热机对外输出的功。
22.从饱和液体状态汽化成饱和蒸汽状态,因为气化过程温度未变,所以焓的变化量Δh=c p ΔT=0。
23.定压过程的换热量q p =∫c p dT 仅适用于理想气体,不能用于实际气体.24.在p -v 图上,通过同一状态点的定熵过程的斜率大于定温过程的斜率.25. 压缩过程耗功是体积膨胀功,压气机耗功是技术功;26.供热量一定,用电炉取暖与用热泵式空气取暖耗电量一样多.27.渐缩喷管出口截面参数不变,背压提高,则喷管流量下降。
28.工质在变截面管道内流动,管道的最小截面即为临界截面。
2014-2015第⼀学期化⼯热⼒学(3)㈠择题(每题两分共20分)1.T 温度下的纯物质,当压⼒低于该温度下的饱和蒸汽压时,则⽓体的状态为(C ) A 饱和蒸汽B 超临界流体C 过热蒸汽2. T 温度下的过冷纯液体的压⼒P ( A )A>B<C=3. 纯物质的第⼆virial 系数B ( A )4.⼆元⽓体混合物的摩尔分数y 1=0.3,在⼀定的T,P 下,φ1=0.9381,φ2=0.8812,则混合物的逸度系数为(A )5. 将固体NH4HCO3(s) 放⼊真空容器中,等温在400 K ,NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g) 系统的组分数C 和⾃由度数F 为:( C )。
6.7.体系经不可逆循环⼜回到初态,则热温商的循环积分(A)8.关于逸度的下列说法中不正确的是(C)9.Pitzer提出的由偏⼼因⼦ω计算第⼆维利系数的普遍化关系式是(C)10.偏摩尔性质是(A)㈡填空题(每空两分共22分)1.1正丁烷的偏⼼因⼦ω=0.193,临界压⼒为P c=3.797MPa,则在Tr=0.7时的蒸汽压⼒为0.2435 MPa.2. Rankine循环主要由锅炉、汽轮机、泠凝器、⽔泵四部分组成。
3.体系经过不可逆过程,则过程熵变⼀定⼤于(填⼤于、⼩于或等于)过程的热温商。
4.活度系数的三种计算⽅法:状态⽅程法、汽液平衡法、定义法。
5.三参数对⽐态原理中三参数是指Tr、Pr、ω。
㈢简答题(每题四分共12分)1.什么是理想功、损失功?答:理想功即指体系的状态变化是在⼀定的环境条件下按完全可逆的过程进⾏时,理论上可以产⽣的最⼤功或者必须消耗的最⼩功。
由于实际过程的不可逆性,导致在给定状态变化的不可逆的实际功和产⽣相同变化的理想功之间的差值,此差值就称为损失功。
2.理想⽓体的特征是什么?答:假定分⼦的⼤⼩如同⼏何点⼀样,分⼦间不存在相互作⽤⼒,由这样的分⼦组成的⽓体叫做理想⽓体。
M p a℃蒸汽放热后变为
M p a℃水的放热量计算 This model paper was revised by the Standardization Office on December 10, 2020
0.1M p a,180℃蒸汽放热后变为0.1M p a,40℃水的放热量计算
0.1Mpa,180℃蒸汽焓值:2835.7kJ/kg。
0.1Mpa,100℃蒸汽焓值:2676.3kJ/kg。
0.1Mpa,100℃水焓值:419.54kJ/kg。
0.1Mpa,40℃水焓值:168.06kJ/kg。
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg。
水的近似比热容4.2kJ/kg℃
水蒸气的近似比热容1.85kJ/kg℃
一、焓值算法
180℃蒸汽变成40℃水,放热量为焓值差:2835.7-168.06=2667.64kJ/kg
二、热容算法
180℃蒸汽变成100℃蒸汽,放热为:1.85*1*(180-100)=148kJ/kg
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg(100℃蒸汽变为100℃水焓变为:2676.3-
419.54=2256.76kJ/kg比汽化潜热值少1.64kJ/kg)
100℃水变成40℃水,放热为:4.2*1*(100-40)=252kJ/kg
一共放热量为:148+2258.4+252=2658.4kJ/kg
三、分步组合算法
180℃蒸汽变成100℃蒸汽,放热量焓值差:2835.7-2676.3=159.4kJ/kg(对比热容算法多
1.4kJ/kg)
100℃饱和蒸汽的汽化潜热值:2258.4kJ/kg
100℃水变成40℃水,放热量焓值差:419.54-168.06=251.48kJ/kg(对比热容算法少
0.52kJ/kg)
一共放热量为:159.4+2258.4+251.48=2669.28kJ/kg。