恶性胶质瘤小分子靶向药物进展
- 格式:ppt
- 大小:2.41 MB
- 文档页数:19


化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
小分子靶向药物在临床上的应用日益增多,在一些肿瘤类别中已经进入一线用药地位,比如肾癌、慢粒白、多发性骨髓瘤等。
本文对小分子靶向治疗药物做一综述。
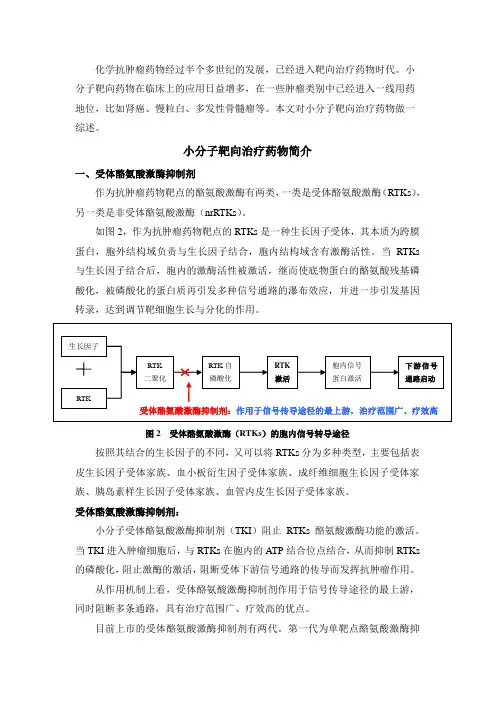
小分子靶向治疗药物简介一、受体酪氨酸激酶抑制剂作为抗肿瘤药物靶点的酪氨酸激酶有两类,一类是受体酪氨酸激酶(RTKs),另一类是非受体酪氨酸激酶(nrRTKs)。
如图2,作为抗肿瘤药物靶点的RTKs是一种生长因子受体,其本质为跨膜蛋白,胞外结构域负责与生长因子结合,胞内结构域含有激酶活性。
当RTKs 与生长因子结合后,胞内的激酶活性被激活,继而使底物蛋白的酪氨酸残基磷酸化,被磷酸化的蛋白质再引发多种信号通路的瀑布效应,并进一步引发基因转录,达到调节靶细胞生长与分化的作用。
图2 受体酪氨酸激酶(RTKs)的胞内信号转导途径按照其结合的生长因子的不同,又可以将RTKs分为多种类型,主要包括表皮生长因子受体家族、血小板衍生因子受体家族、成纤维细胞生长因子受体家族、胰岛素样生长因子受体家族、血管内皮生长因子受体家族。
受体酪氨酸激酶抑制剂:小分子受体酪氨酸激酶抑制剂(TKI)阻止RTKs酪氨酸激酶功能的激活。
当TKI进入肿瘤细胞后,与RTKs在胞内的ATP结合位点结合,从而抑制RTKs 的磷酸化,阻止激酶的激活,阻断受体下游信号通路的传导而发挥抗肿瘤作用。
从作用机制上看,受体酪氨酸激酶抑制剂作用于信号传导途径的最上游,同时阻断多条通路,具有治疗范围广、疗效高的优点。
目前上市的受体酪氨酸激酶抑制剂有两代。
第一代为单靶点酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼。
表已上市的酪氨酸激酶抑制剂注:EGFR:表皮生长因子受体,属HER家族;VEGFR:血管内皮生长因子;PDGFR:血小板衍生因子;HER2:HER家族的一种受体;Abl-Bcr:一种非受体酪氨酸激酶;Raf:酪氨酸激酶的下游信号通路中的一种蛋白;Flt-3:Src:一种非受体酪氨酸激酶;c-kit:Ret:胶质细胞源性神经营养因子的受体吉非替尼为EGFR酪氨酸激酶抑制剂,主要用于非小细胞肺癌,对酪氨酸激酶基因编码区突变型肿瘤的有效率高达80%以上。

肿瘤分子靶向治疗的研究进展随着生物技术的不断发展和精准医疗的不断普及,以分子为靶点的肿瘤治疗越来越成为研究的热点领域,这种治疗方法被称为肿瘤分子靶向治疗。
与以往的传统治疗方法相比,肿瘤分子靶向治疗具有特异性高、有效性好、毒副作用小等优点,受到了世界范围内的广泛关注。
本文将从靶点的发现、药物的选型、临床应用等方面介绍肿瘤分子靶向治疗的研究进展。
一、靶点的发现靶点是指某个分子或细胞结构,能够与治疗药物紧密结合,从而起到抗癌作用的位置。
对于肿瘤治疗而言,靶点的发现至关重要,因为它们的存在直接决定了治疗药物的精准性和有效性。
目前,靶点发现的方法主要分为以下几类:化学筛选法、基因组学筛选法、蛋白质组学筛选法和细胞治疗方法。
其中,化学筛选法是指利用生物化学技术,从化学物质中筛选出对于某种癌症有特异性的化合物;基因组学筛选法则是指通过对整个基因组的筛选,寻找具有影响肿瘤发生发展的基因或蛋白质;蛋白质组学筛选法则是通过检测肿瘤细胞和正常细胞中蛋白质表达的差异,寻找具有癌症特异性的蛋白质;而细胞治疗方法则是利用生物技术筛选出能够靶向癌细胞特异性基因的细胞,通过对正常细胞和癌细胞靶向细胞的刺激来治疗癌症。
目前,靶点的发现涉及到生物学、医学、化学等多个学科领域,需要各种技术手段之间的协作,其中最重要的一环是开展肿瘤分子基因组学研究,这对于深入了解肿瘤发生、发展及转移过程中的基因和蛋白质变化十分重要。
二、药物的选型药物的选型是肿瘤分子靶向治疗的核心内容之一。
首先,必须找到能够靶向特定肿瘤细胞的药物,并能够在体内达到理想的浓度。
其次,还需要考虑药物的毒副作用,以及它对正常细胞和组织的影响。
根据靶点的不同,肿瘤分子靶向治疗的药物可以分为信号转导抑制剂、细胞周期抑制剂、免疫治疗剂、抗血管生成剂、DNA损伤修复抑制剂等多个种类。
例如,信号转导抑制剂是针对肿瘤细胞信号通路的药物,可以抑制肿瘤细胞的增殖和转移;而免疫治疗剂则是指通过提高机体免疫力,增强机体对癌细胞的抗体和杀伤力,从而达到抗癌的效果。


恶性肿瘤的分子靶向治疗【摘要】肿瘤分子靶向治疗是指在肿瘤分子细胞生物学的基础上,利用肿瘤组织或细胞所具有的特异性(或相对特异的)结构分子作为靶点,使用某些能与这些靶分子特异结合的抗体、配体等达到直接治疗或导向治疗目的的一类疗法。
分子靶向药物以某些肿瘤细胞膜上或细胞内特异性表达的分子为作用靶点,从而能够更加特异性地作用于特定肿瘤细胞,阻断其生长、转移或诱导其凋亡,抑制或杀死肿瘤细胞,达到控制肿瘤之目的。
近年来分子靶向治疗的迅速发展使其高选择性和非细胞毒性逐渐受到重视,本文就用于恶性肿瘤的分子靶向治疗药物的分类及其临床研究状况做一综述。
关键词:【关键词】恶性肿瘤;分子靶向;治疗对无法手术切除的肿瘤,化疗和放疗仍然是目前的一线治疗方法,尽管随着新一代化疗药物如紫杉醇、吉西他宾的应用,患者的生存获得一定益处,但大多数癌症患者的预后仍较差。
研究人员一直在试图寻找新的药物以杀灭肿瘤细胞并尽可能减少对正常细胞的损害,近年来分子靶向治疗研究取得重大进展[1],新的抗肿瘤分子靶向药物的数量不断增加并进入临床领域,在肿瘤临床实践中取得了显著疗效,使肿瘤个体化治疗前进了一大步。
这些新药物与传统治疗方法的结合有望成为治疗肿瘤的有效手段,显著提高肿瘤治疗的疗效。
肿瘤分子靶向治疗常用的治疗靶点有:细胞受体、信号传导和抗血管生成等[2]。
本文综述针对这些靶点的几类主要分子靶向药物。
1单抗类药物:单克隆抗体(monoclonal antibody, McAb)是利用抗原抗体特异性结合的特点设计的一种治疗方法。
肿瘤细胞表面有一些特异的肿瘤抗原可供利用作为单克隆抗体攻击的靶点[3]。
当前单克隆抗体在肿瘤治疗中已取得实质性进展,该治疗方法利用某种生物制剂,通过载体注入局部或全身给药进入人体后,在体内选择性地对表达某种基因蛋白的癌细胞起着“对号入座”的杀灭作用,可减少正常组织与细胞的毒副作用。
1.1 曲妥珠单抗Herceptin(Trastuzumab,贺赛汀):是一种针对HER-2/neu原癌基因产物的人/鼠嵌合单抗,能特异地作用于HER-2受体过度表达的乳腺癌细胞。

靶向抗肿瘤药物的研究进展靶向抗肿瘤药物的研究进展近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。
研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异,可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。
目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase) 等,现就针对这些靶点的研发药物做一综述。
1、蛋白激酶蛋白激酶是目前已知的最大的蛋白超家族。
蛋白激酶的过度表达可诱发多种肿瘤。
蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。
蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。
研究表明,近80%的致癌基因都含有酪氨酸激酶编码。
抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑制肿瘤细胞的生长。
酪氨酸激酶受体分为表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR) 、血小板源生长因子受体(PDGFR) 等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表皮生长因子受体酪氨酸激酶(EGFR-TK) 抑制剂、血管内皮细胞生长因子受体酪氨酸激酶(VEGFR-TK) 抑制剂和血小板源生长因子受体酪氨酸激酶(PDGFR-TK)抑制剂等。
基于多靶点的酪氨酸激酶抑制剂目前已成为研究重点,具有广阔的发展前景,其中,包括舒尼替尼和索拉芬尼在内的几个上市新药均获得了良好的临床评价结果。
1.1 EGFR-TK抑制剂许多实质性肿瘤均高度表EGFR,EGFR-TK抑制剂是目前抗肿瘤药研发的热点之一。


LncRNAs在胶质瘤治疗中的新进展发布时间:2023-02-22T02:12:36.660Z 来源:《中国医学人文》2022年31期作者:周妙兵1 张鹏1*[导读] 胶质瘤是中枢神经系统最常见的恶性肿瘤,尽管进行了手术联合同步放化疗的多模式治疗,但是胶质瘤患者的预后依然很差,因此,深入挖掘胶质瘤发生和进展的分子机制,并以此为基础开发新型靶向治疗药物显得尤为重要。
周妙兵1 张鹏1*(1如皋市人民医院神经外科,如皋 226500)摘要:胶质瘤是中枢神经系统最常见的恶性肿瘤,尽管进行了手术联合同步放化疗的多模式治疗,但是胶质瘤患者的预后依然很差,因此,深入挖掘胶质瘤发生和进展的分子机制,并以此为基础开发新型靶向治疗药物显得尤为重要。
LncRNA是指长度超过200个核苷酸的非编码RNA,序列上保守性差,功能上具有一定保守性[1]。
关键词:胶质瘤;LncRNAs;治疗;新进展LncRNA在胶质瘤对传统治疗抵抗中的作用胶质干细胞在胶质瘤进展中扮演着十分重要的角色,手术可以显著地缩小胶质瘤肿块的体积,但胶质瘤干细胞的存在能够启动肿瘤重构,促进胶质瘤的复发。
许多研究表明,lncRNAs同样可以调控胶质瘤干细胞的生物学表型。
过表达MALAT1通过吸附miR-129解除miR-129对高迁移率族蛋白B1(high mobility group box 1,HMGB1)表达的抑制,促进HMGB1表达上调进而促进胶质瘤干细胞的增殖,进一步导致胶质瘤增殖和活力增加[2]。
ERK/MAPK信号通路是胶质瘤发展的关键通路,下调MALAT1的表达可以激活ERK/MAPK信号通路导致另一种干性标志物Nestin的表达和胶质瘤干细胞增殖的抑制。
除手术切除外,化学疗法和放射治疗是胶质瘤治疗的重要策略,然而,不幸的是,许多胶质瘤患者对放疗和化疗的联合治疗具有显著的抵抗性。
如前所述,一些lncRNAs能够充当miRNAs的分子海绵,这是调控胶质瘤治疗中治疗抵抗的重要特征。

甲磺酸阿帕替尼治疗恶性肿瘤的研究进展(苏州市立医院北区肿瘤内科江苏苏州 215008)【摘要】目前有许多针对恶性肿瘤的靶向治疗的研究,但仅仅只有少数的药物可以改善恶性肿瘤的预后,其中血管内皮生长因子与肿瘤发生密切相关。
甲磺酸阿帕替尼是一种新型的口服小分子抗血管生成抑制剂。
研究表明甲磺酸阿帕替尼使晚期恶性肿瘤患者生存获益,且安全性较好。
当甲磺酸阿帕替尼在2014年首次亮相时,就引起了业内的广泛关注,是具有良好前景的抗血管生成靶向药物。
本文就甲磺酸阿帕替尼抗肿瘤作用机制和临床研究的现状及进展进行系统的综述。
【关键词】甲磺酸阿帕替尼;靶向治疗;恶性肿瘤【中图分类号】R730【文献标识码】A【文章编号】1004-7484(2019)03-0153-0121世纪以来,分子靶向治疗已然成为治疗恶性肿瘤的热门话题,分子生物学的不断深入,推动了肿瘤靶向治疗的进展。
而早在1971年,Folkman就提出实体瘤在没有血管生成的条件生长会受到抑制,肿瘤生长和转移都依赖于新生血管的生成,并指明抑制血管生成在肿瘤治疗中具有重要意义[1]。
甲磺酸阿帕替尼是一种新型口服小分子血管靶向药物,是酪氨酸激酶抑制剂中的一种,可以高度选择性地结合VEGFR-2,达到抑制血管内皮生长因子诱导内皮细胞生成和迁移的效果[2]。
它主要用于三线及以上治疗进展或复发的晚期胃腺癌以及胃-食管结合部腺癌。
本文就甲磺酸阿帕替尼抗肿瘤作用机制和临床研究的现状及进展进行系统的综述,为今后的临床应用提供参考。
1 抗肿瘤作用及抗血管生成机制多数恶性肿瘤的发生、发展与肿瘤的血管生成密不可分。
VEGF和VEGFR-2介导的信号转导通路是调控肿瘤血管生成的关键环节。
VEGF及VEGFR-2相结合后使得细胞内域酪氨酸激酶发生自磷酸化,引起下游信号通路被激活,随着信号通路的激活,内皮细胞增殖,肿瘤微血管数量增多[3]。
甲磺酸阿帕替尼作用部位为蛋白酪氨酸受体胞内ATP结合位点,在体内能特异结合VEGFR-2,有效控制新生血管,从而控制肿瘤的生长[4]。

脑胶质瘤的化疗现状及进展脑胶质瘤的治疗至今仍是一个医学难题,标准的手术切除后加放化疗都不能取得满意的疗效,对改善恶性脑胶质瘤预后,延长患者生存期,改善患者生活质量起着越来越重要的作用,特别是以替莫唑胺(temozolomide,TMZ)等新型抗肿瘤药的发现,靶向治疗、基因治疗、间质化疗等新式化疗手段的研究,使得胶质瘤的术后化疗发展也较迅速,疗效也在不断得到提高。
但是血脑屏障(blood-brainbarrier,BBB)的存在和肿瘤细胞的多药耐药(multidrug resistance ,MDR)限制了化疗药物的疗效,难以达到杀灭瘤腔残留肿瘤细胞要求,无法彻底根治。
也正因为如此,胶质瘤的化疗研究才显得尤为重要,发展空间巨大,也是现在研究的重点和热点。
标签:脑胶质瘤;化疗1概况脑胶质瘤(Glioma)是神经外胚层衍化而来的胶质细胞发生的肿瘤,是颅内最常见的恶性肿瘤,约占颅内所有肿瘤的35.26%~60.9%,平均为44.6%[1]。
手术是最主要的治疗手段。
因胶质瘤常呈浸润性生长,且多处于脑部重要结构,手术无法做到真正的彻底全切,基于其易复发性及侵袭性生长的生物学特性,单纯手术治愈率低。
放射疗法除对髓母细胞瘤敏感外,对其他胶质瘤均不佳。
Stewat[2]实验发现手术后加以放疗和化疗,明显延长胶质瘤患者的生存期。
但由于血-脑屏障的存在,肿瘤的耐药性以及化疗敏感性的个体差异,使得化疗药物的疗效很难达到理想的疗效,如何提高化疗药物对脑胶质瘤的杀伤作用已成为研究的难点和热点。
2主要常用化疗药物脑胶质瘤的化疗药物种类很多,主要包括:①亚硝脲类:目前亚硝脲类仍是恶性胶质瘤的首选化疗药物,如卡莫司汀(Carmustine,BCNU) 、司莫司汀(Semustine ,CCNU)、洛莫司汀(Lomustine ,CCNU)等,此类药与肿瘤细胞DNA 起烷化作用,阻止DNA修复,改变DNA和蛋白质的结构,作用于细胞增殖期及非增殖细胞。
恶性肿瘤靶向治疗新进展一、前言恶性肿瘤是一种严重的疾病,目前的治疗方式包括手术、放疗和化疗等,但这些治疗方式都存在一定的副作用和局限性。
近年来,随着科技的不断发展,恶性肿瘤靶向治疗正在成为治疗恶性肿瘤的新方向。
本文将围绕恶性肿瘤靶向治疗的新进展展开阐述。
二、恶性肿瘤的治疗现状目前,恶性肿瘤的治疗方式主要包括手术、放疗和化疗等。
手术是治疗癌症的传统方式,具有直接切除肿瘤的效果,但同时也会对身体造成伤害,术后也存在一定的风险。
放疗是利用高能量的辐射杀死癌细胞的方式,适用于早期肿瘤的治疗,但是对周围正常组织的伤害也较大。
化疗是用药物杀死肿瘤细胞,但药物的副作用也会影响患者的生活质量。
三、恶性肿瘤靶向治疗恶性肿瘤靶向治疗是一种特殊的治疗方式,它可以通过特定的手段作用于肿瘤细胞的表面蛋白或其信号通路,实现对肿瘤细胞的精准打击,从而降低对周围正常组织的影响。
现代分子遗传学和细胞生物学的发展为恶性肿瘤靶向治疗提供了基础。
恶性肿瘤靶向治疗可以从靶向受体、靶向信号通路和靶向干细胞等多个方面入手。
1、靶向受体癌细胞通常具有高表达的靶向受体,而这些受体在正常细胞中通常表达低或不表达。
因此,靶向受体是治疗癌症的重要靶点。
例如,黑色素瘤细胞表达高水平的BRAF V600E蛋白,可以通过对BRAF V600E的靶向治疗来治疗黑色素瘤。
2、靶向信号通路癌症的形成与许多信号通路的紊乱有关。
因此,对癌症相关信号通路的抑制或激活可以治疗癌症。
例如,EGFR(表皮生长因子受体)是许多癌症类型中一种过度活化的信号通路,可以通过使用靶向EGFR的抗体和酪氨酸激酶抑制剂来治疗癌症。
3、靶向干细胞癌细胞干细胞是一类可以不断自我更新的癌细胞,它们可以逃避化疗和放疗的杀伤。
靶向干细胞意味着杀伤肿瘤形成的根源,这也是治疗癌症的重要方向。
四、恶性肿瘤靶向治疗的新进展1、免疫检查点阻断剂免疫检查点阻断剂是一种治疗恶性肿瘤的新型药物。
它通过抑制肿瘤相关抑制剂,增强免疫细胞对肿瘤细胞的攻击,从而避免肿瘤细胞逃避免疫监视。
小细胞肺癌靶向药物治疗进展【摘要】小细胞肺癌是一种恶性肿瘤,治疗挑战性很大。
随着科学技术的进步,小细胞肺癌靶向药物治疗取得了一定进展。
本文首先介绍了靶向药物的作用机制,探讨了已经批准和正在研究中的靶向药物,以及靶向药物在临床应用中的效果和局限性。
结合这些内容,文章展望了小细胞肺癌靶向药物治疗的前景,提出未来研究的方向,并总结了靶向药物在治疗小细胞肺癌中的意义。
这些内容将有助于了解小细胞肺癌靶向药物治疗的最新进展和挑战,为临床实践和未来研究提供参考。
【关键词】小细胞肺癌、靶向药物、作用机制、批准药物、研究中药物、临床应用、效果、局限性、前景、研究方向、总结。
1. 引言1.1 小细胞肺癌靶向药物治疗进展小细胞肺癌是一种高度侵袭性的恶性肿瘤,通常在早期就已经扩散到全身其他部位,使得手术治疗常常难以实施。
传统的化疗虽然可以一定程度上缓解症状,但对小细胞肺癌的治疗效果并不理想。
靶向药物治疗成为了治疗小细胞肺癌的一种新策略。
靶向药物通过干扰癌细胞内特定的信号传导通路或靶点来抑制肿瘤的生长和扩散,相比传统化疗具有更为精准和高效的作用机制。
近年来,随着分子生物学和药物研发技术的不断进步,已经有多种靶向药物被研发并应用于小细胞肺癌的治疗中。
这些靶向药物包括已经被批准上市的药物,以及正在研究中的新药。
它们在临床应用中展现出了显著的疗效,为小细胞肺癌患者带来了新的治疗选择和希望。
靶向药物治疗也存在一些局限性,如耐药性的产生和副作用的发生,这需要更深入的研究和改进。
尽管如此,小细胞肺癌靶向药物治疗的发展仍然给患者带来了希望。
未来的研究方向将集中在提高治疗效果、减少副作用、延长患者生存时间等方面,为小细胞肺癌患者提供更加有效的治疗方案。
通过不断的努力和创新,相信小细胞肺癌靶向药物治疗的前景将会更加光明。
2. 正文2.1 靶向药物的作用机制小细胞肺癌是一种生长迅速的恶性肿瘤,传统的化疗和放疗在治疗小细胞肺癌患者时效果有限。
个体化分子靶向药物在肿瘤治疗中的研究进展【摘要】肿瘤是目前世界上危害人类健康的主要疾病之一,分子靶向治疗具有分子特异性和选择性,能高效并选择性地抑制或杀伤肿瘤细胞,同时减少对人体正常组织的损伤,是目前肿瘤治疗领域发展的新方向。
现对近年来个体化分子靶向药物在肿瘤治疗中的研究进展,回顾各类分子靶向抗肿瘤药物的特点,提出分子靶向抗肿瘤药物应用中的问题:如药物毒副作用、个体化治疗与生物标志物,以及疗效评价等。
【关键词】分子靶向抗肿瘤药物;个体化治疗;生物标志物;疗效评价【中图分类号】r730.5 【文献标识码】a 【文章编号】1004-7484(2012)10-0640-02肿瘤作为常见病和多发病,传统治疗方法包括手段手术治疗、化疗、放疗。
生物治疗作为一种新的治疗手段,逐渐被人们认识并接受。
分子靶向治疗作为生物学治疗的一个方面,随着分子生物学的发展取得了长足的进步。
分子靶向治疗(molecular targeted therapy)是利用肿瘤组织或细胞所具有的特异性,针对肿瘤细胞里面的某一个蛋白家族的某部分分子,或者某一个核苷酸的片段,设计相应的治疗药物。
药物进入体内会特异地结合致癌位点发挥作用,使肿瘤细胞特异性死亡,而不会波及肿瘤周围的正常组织细胞[1]。
相对于手术、放疗、化疗三大传统治疗手段,分子靶向药物能高效并选择性地抑制或杀伤肿瘤细胞,是目前肿瘤治疗领域发展的新方向。
分子靶向抗肿瘤药物在肿瘤的治疗中占有越来越重要的地位。
个体化药物治疗又称个性化治疗(personalized therapy),是一种基于个体的药物遗传学和药物基因组学信息,根据特定人群甚至特定个人的病情、病因以及遗传基因,提供针对性治疗和最佳处方用药的新型疗法。
在肿瘤疾病中,由于肿瘤的异质性和患者间的差异,临床上也常出现明显的药物个体反应差异,即使采用分子靶向药物也会产生用药不当或用药过度问题,因此采用针对不同患者的“个性化”分子靶向药物治疗,就显得尤为重要[2]。
靶向突变p53的小分子药物研究进展王玉玲;苏永南;暴亚锋;杨志宽;牟汉川;张继虹【摘要】Tumor suppressor p53 protein can regulate the tran-scription of target genes, to control cell apoptosis, aging and other life activities,but mutant p53 is prone to losing antitumor function, thus promoting tumor development. At present, p53 protein has become one of the hot targets for the treatment of cancer. This article mainly introduces the structure and mechanism of small molecular compounds with restoring activity of mutant p53 as the target.%肿瘤抑制因子p53蛋白可以调节靶基因转录,控制细胞凋亡、衰老等生命活动,但其容易发生突变,失去抑癌功能,促进肿瘤发生发展.目前p53蛋白已成为治疗肿瘤的热门靶点之一,该文主要介绍以突变p53为靶点恢复构象活性的小分子化合物结构及作用机制.【期刊名称】《中国药理学通报》【年(卷),期】2018(034)003【总页数】4页(P321-324)【关键词】突变p53;靶点;构象;药物设计;机制【作者】王玉玲;苏永南;暴亚锋;杨志宽;牟汉川;张继虹【作者单位】昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明650500;昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明 650500;昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明 650500;昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明 650500;昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明 650500;昆明理工大学医学院衰老与肿瘤分子遗传学实验室,云南昆明 650500【正文语种】中文【中图分类】R-05;R341;R394.2;R730.5;R977.6;R979.1p53蛋白是一个重要的转录因子,通过调节p21、Bax、PTEN、p48、PAI等下游靶基因,阻滞细胞周期,诱导细胞凋亡与衰老、参与DNA损伤修复以及抑制血管生成(Fig 1),阻止肿瘤的发生与发展。