初三化学第七章_第一节溶液的酸碱性2
- 格式:ppt
- 大小:4.52 MB
- 文档页数:39


第七章应用广泛的酸、碱、盐--核心知识点总结一、溶液的酸碱性:(一)酸性溶液、碱性溶液和酸碱指示剂:通过紫色石蕊试液辨别溶液酸碱性:1、凡能使紫色石蕊试液变红的溶液都具有酸性;2、凡能使紫色石蕊试液变蓝的溶液都显碱性;3、不能使紫色石蕊试液变色的溶液既不显酸性也不显碱性,呈中性。
通过酚酞试液辨别溶液酸碱性:1、凡能使酚酞试液变红的溶液都显碱性;2、不能使酚酞试液变色(无明显现象)的溶液显酸性或中性。
酸碱指示剂:能检验溶液酸碱性的试液,称为酸碱指示剂,常用的酸碱指示剂有紫色石蕊试液和酚酞试液。
(二)溶液酸碱性的强弱程度:不同酸性溶液的酸性强弱不同,不同碱性溶液的碱性强弱也不同,为此,人们用酸度和碱度来表示溶液酸性或碱性强弱的程度。
用pH 试纸可以测定溶液的酸碱度(即溶液的pH 值)。
pH 的范围通常在0~14 之间,具体如下:1、pH=7 时,溶液呈中性;2、pH<7 时,溶液呈酸性,且pH 越小酸性越强;3、pH>7 时,溶液显碱性,且pH 越大碱性越强。
总之,pH从左向右酸性由强到弱直到呈中性,然后碱性由弱到强。
★pH试纸的使用方法:1、检验溶液的酸碱性:取一小块 pH 试纸置于表面皿或玻璃片上,用玻璃棒蘸取待测溶液点在试纸的中部,待试纸显色后跟标准比色卡对照,便可得知溶液的pH;2、检验气体的酸碱性:先用蒸馏水将一小块试纸润湿,粘在玻璃棒的一端,手持另一端移动玻璃棒使试纸靠近气体,观察颜色变化,判断气体性质。
※注意:1、试纸不可直接伸入溶液;2、试纸不可接触试管口、瓶口、导管口等;3、测定溶液的 pH 时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的 溶液,这会导致测量不准确;4、取出试纸后,应将盛放试纸的容器盖严,以免被实验室的一些气体污染。
酸碱指示剂的变色范围:酸碱指示剂的颜色变化是在一定的 pH 值范围内发生的,我们把指示剂发生颜色变化的 pH 值范围叫做酸碱指示剂的变色范围。


实验报告实验名称:溶液酸碱性的检验一、实验目的1.掌握酸碱指示剂的使用和分类方法;2.了解酸碱溶液的鉴别方法;3.学习溶液酸碱性检验的操作技巧。
二、实验原理酸和碱是化学中两种常见的物质,它们的性质不同。
通过酸碱指示剂,能够很好地判断溶液是酸性、中性还是碱性。
常见的酸碱指示剂有苏丹红、酚酊、酚酞、甲基橙和甲基红等。
不同的酸碱指示剂对酸、碱的变色范围不同,所以我们要根据指示剂的性质选择适当的指示剂。
三、实验器材和试剂器材:试管、滴管、显微镜。
试剂:酸碱试剂、酸碱指示剂。
四、实验步骤1.在试管中分别加入待测溶液10滴;2.滴加少许酸碱指示剂;3.观察试管内的颜色变化;4.使用显微镜观察溶液中的小细胞。
五、实验数据记录和处理1.观察到的颜色变化:-对于苏丹红:酸性溶液变红,中性溶液橙黄,碱性溶液黄色。
-对于酚酊:酸性溶液变红,中性溶液橙黄,碱性溶液无变化。
-对于酚酞:酸性溶液颜色无变化,中性溶液橙红,碱性溶液变黄。
-对于甲基橙:酸性溶液变红,中性溶液橙黄,碱性溶液变黄。
-对于甲基红:酸性溶液变红,中性溶液橙黄,碱性溶液变黄。
2.显微镜观察结果:-酸性溶液下显微镜观察到的小细胞属于酸性小细胞;-碱性溶液下显微镜观察到的小细胞属于碱性小细胞;-中性溶液下显微镜观察到的小细胞属于中性小细胞。
六、实验结果和结论通过实验可以得到以下结论:1.根据不同酸碱指示剂的变色范围可以判断溶液的酸碱性;2.酸性溶液对应的是酸性小细胞,碱性溶液对应的是碱性小细胞,中性溶液对应的是中性小细胞;3.运用酸碱指示剂和显微镜观察小细胞的方法可以鉴别溶液的酸碱性。
七、实验心得通过这个实验,我学习到了酸碱指示剂的使用方法,并且掌握了一些常用的酸碱指示剂的变色范围。
我还知道了如何使用显微镜观察溶液中的小细胞来鉴别酸碱性。
这个实验不仅培养了我的观察力,还提高了我的实验操作技巧。
我相信这些知识和技能在以后的学习中会有很大的帮助。


第1节溶液的酸碱性一、单选题1.下列所示为人体部分体液的pH,其中酸性最强的是()A.胃液(0.8~1.5)B.唾液(6.6~7.1)C.胆汁(6.8~7.4)D.血液(7.35~7.45)2.日常生活中常见的下列物质的水溶液能使紫色石蕊试液变蓝的是()A.蒸馏水B.食盐C.石灰水D.发酵后的牛乳3. 中国工程院院士袁隆平宣布了一项重大突破成果--水稻亲本去镉技术,水稻对镉的吸收量与土壤pH关系如图所示。
下列物质可用于改良土壤结构,降低水稻对镉吸收量的是()A. 熟石灰B.硫酸铜C.稀盐酸D.氯化钠4.一些食物的近似pH如下,其中呈碱性的是()A.AB.BC.CD.D5.人体血液中的CO2如果不能由肺部排出,则人血液的pH值会()A.上升B.下降C.不变D.始终大于76.土壤的酸碱度会影响植物的生长。
下列植物在微酸性土壤中,不适宜种植的是()A.小麦B.油菜C.西瓜D.沙枣7.能在pH为13的无色溶液中大量共存的一组物质是()A.K2SO4、K2CO3、NaOHB.NaNO3、AgNO3、NH4ClC.HCl、KNO3、Na2CO3D.KMnO4、CuSO4、NaNO38.下列离子能在pH=1的无色溶液中大量共存的是()A.Mg2+、Al3+、NO3-B.OH-、K+、NO3-C.Na+、CO32-、Ca2+D.Cu2+、SO42-、Cl-9.我国新的《生活饮用水卫生标准》中饮用水的pH标准为6.5~8.0,下列是某次抽样调查中常见纯净水品牌的pH,其中酸性最强的是()A.屈臣氏pH=5B.乐百氏pH=5.4C.怡宝pH=5.7D.冰纯水pH=5.810.以下是日常生活中常见的洗涤用品,其中最接近中性的是()A.洁厕剂:pH=1.0B.洗发露:pH=7.6C.洗衣液:pH=10.5D.漂白液:pH=13.411.下列各组离子在pH=0的溶液中大量共存的是()A.Ag+、Na+、Cu2+、Cl-B.Ba2+、K+、OH-、SO42-C.K+、Na+、HCO3-、Cl-D.Na+、Mg2+、NO3-、Cl-12.石蕊溶液液是重要的酸碱指示剂,下列物质能使石蕊溶液变蓝色的是()A.稀硫酸B.氯化钠溶液C.白醋D.石灰水二、填空题13.“果导片”是一种常用缓泻剂,主要成分是酚酞。

2022届九年级化学练习第七章应用广泛的酸碱盐 :// DearEDU 第一节 溶液的酸碱性 一、选择题 1.要确定溶液的酸碱度,可以使用 ( )A.石蕊试液B.酚酞试液C.pH 试纸D.蓝色石蕊试纸2.在pH =0的溶液中,滴入紫色石蕊试液,溶液显 ( )A.紫色B.红色C.蓝色D.无色3.用稀的碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性。
如用碱性溶液浸泡蔬菜,可在水中加入适量的 ( )A.白酒B.纯碱C.白糖D.食醋4.能使紫色石蕊试液变红色的是 ( )A.肥皂水B.食盐水C.白醋D.石灰水5.有A 、B 、C 三种溶液,A 能使紫色石蕊试液变红,B 能使无色酚酞试液变红,C 遇紫色石蕊试液和无色酚酞试液均无变化,则三种溶液的pH 由大到小的顺序是 ( )A.A >C >BB.C >B >AC.B >A >CD.B >C >A6.用pH 试纸测量碱溶液的pH 时,若事先将pH 试纸用蒸馏水润湿,则测量结果会( )A.偏大B.偏小C.不变D.无法判断7.右图为喷墨打印机工作原理示意图。
溶解在打印墨水 (pH :7.5~9.0)中的染料,从喷嘴喷到打印纸(pH :4.5~6.5)上,变为不溶于水的固体。
下列说法正确的是 ( )A.打印墨水偏酸性B.打印墨水显中性C.打印纸偏酸性D.打印纸偏碱性 8.食物 橘子汁 四川泡菜 牛奶 鸡蛋清近似pH 范围 3.0~4.0 3.2~3.6 6.3~6.6 7.6~8.0A.鸡蛋清显碱性B.胃酸过多的人应少吃四川泡菜C.橘子汁不能使无色酚酞试液变红D.牛奶比鸡蛋清的碱性强二、填空题1.检验溶液的酸碱性可以用 和 两种常用的酸碱指示剂;还可以用蓝色石蕊试纸或红色石蕊试纸来检验。
蓝色石蕊试纸遇到 性溶液能变红,红色石蕊试纸遇到 性溶液变蓝色。
2.位于美国富兰克林的小依科庞德湖,湖水的pH 为4.2,是世界上 性最强的湖。
该湖水是否适宜一般作物的灌溉 。
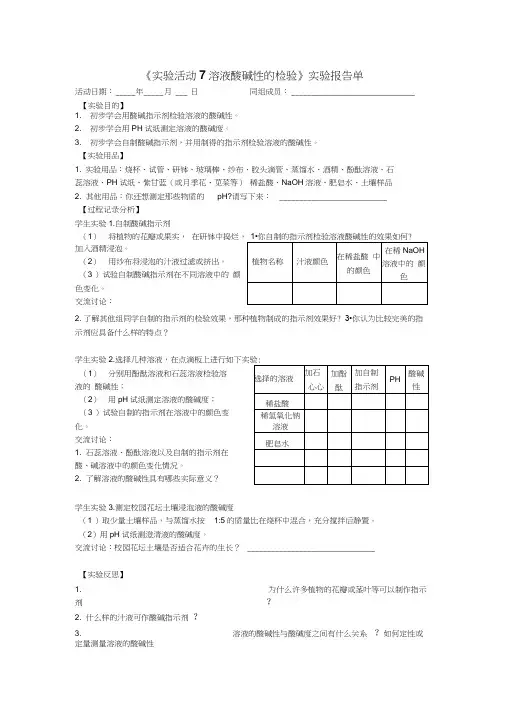
《实验活动7溶液酸碱性的检验》实验报告单1. 初步学会用酸碱指示剂检验溶液的酸碱性。
2. 初步学会用PH 试纸测定溶液的酸碱度。
3. 初步学会自制酸碱指示剂,并用制得的指示剂检验溶液的酸碱性。
【实验用品】1. 实验用品:烧杯、试管、研钵、玻璃棒、纱布、胶头滴管、蒸馏水、酒精、酚酞溶液、石 蕊溶液、PH 试纸、紫甘蓝(或月季花、苋菜等) 稀盐酸、NaOH 溶液、肥皂水、土壤样品2. 其他用品:你还想测定那些物质的 pH?请写下来: ___________________________【过程记录分析】 学生实验1.自制酸碱指示剂(1) 将植物的花瓣或果实, 在研钵中捣烂, 加入酒精浸泡。
(2) 用纱布将浸泡的汁液过滤或挤出。
(3 )试验自制酸碱指示剂在不同溶液中的 颜色变化。
交流讨论:2. 了解其他组同学自制的指示剂的检验效果,那种植物制成的指示剂效果好? 3•你认为比较完美的指示剂应具备什么样的特点?学生实验2.(1) 分别用酚酞溶液和石蕊溶液检验溶液的 酸碱性;(2) 用pH 试纸测定溶液的酸碱度; (3 )试验自制的指示剂在溶液中的颜色变 化。
交流讨论:1. 石蕊溶液、酚酞溶液以及自制的指示剂在 酸、碱溶液中的颜色变化情况。
2. 了解溶液的酸碱性具有哪些实际意义?学生实验3.测定校园花坛土壤浸泡液的酸碱度(1 )取少量土壤样品,与蒸馏水按 1:5的质量比在烧杯中混合,充分搅拌后静置。
(2)用pH 试纸测澄清液的酸碱度。
交流讨论:校园花坛土壤是否适合花卉的生长? ________________________________ 【实验反思】 1. 为什么许多植物的花瓣或茎叶等可以制作指示剂?2. 什么样的汁液可作酸碱指示剂 ?3.溶液的酸碱性与酸碱度之间有什么关系?如何定性或定量测量溶液的酸碱性活动日期: _____年 _____ 月 ___ 日【实验目的】同组成员: _______________________________4. 用pH试纸测溶液酸碱度时应注意哪些问题?。



溶液的酸碱性和pH值溶液的酸碱性和pH值是化学中重要的概念,用于描述溶液中的酸碱程度。
本文将介绍溶液的酸碱性的定义、影响因素以及pH值的计算方法和意义。
一、酸碱性的定义酸碱性是描述溶液中氢离子(H+)和氢氧根离子(OH-)浓度的概念。
当溶液中氢离子浓度高于氢氧根离子浓度时,溶液具有酸性;当氢氧根离子浓度高于氢离子浓度时,溶液具有碱性;当氢离子浓度等于氢氧根离子浓度时,溶液为中性。
二、影响酸碱性的因素1. 酸碱溶液的离子产生:当酸性物质(如盐酸)溶解在水中时,会释放出氢离子(H+);而碱性物质(如氢氧化钠)溶解在水中会释放出氢氧根离子(OH-)。
2. 溶液的离子强度:溶液中离子的浓度越高,酸性或碱性越强。
浓度大的酸性物质或碱性物质在水中溶解后会生成更多的氢离子或氢氧根离子。
3. 酸碱物质的强度:酸性或碱性物质的强度也会影响溶液的酸碱性。
具有较强酸性或碱性的物质在水中溶解后,释放的氢离子或氢氧根离子的浓度会更高。
三、pH值的计算方法pH值是用来表示溶液酸碱性强弱的指标,它的取值范围是0到14。
pH值越低,表明溶液越酸性;pH值越高,表明溶液越碱性;pH值为7则表示溶液为中性。
pH值的计算公式为:pH = -log[H+]其中[H+]为溶液中的氢离子浓度,以“mol/L”表示。
四、pH值的意义pH值的测定对许多领域具有重要意义:1. 生物体内pH值的稳定:生物体内维持适宜的pH值对细胞活动至关重要。
例如,人体血液的pH值维持在7.35至7.45之间,细小的pH值变化都可能引起严重的生理问题。
2. 工业生产的调控:许多工业过程需要控制溶液的pH值,以保证反应的顺利进行。
比如酿造啤酒时,需要控制发酵液的pH值在适宜范围内,以确保酵母菌能够正常进行发酵作用。
3. 环境监测和保护:水体和土壤的pH值对环境生态影响巨大。
pH值的测定可以帮助监测环境的酸碱性,及时采取相应的措施保护生态系统的平衡。
总结:溶液的酸碱性和pH值是描述溶液中酸碱程度的重要概念。
初中化学溶液酸碱性的教案
主题:溶液酸碱性
目标:让学生了解溶液的酸碱性质,能够准确判断溶液的酸碱性并进行简单的酸碱中和反应。
一、导入(5分钟)
1.通过实验演示,让学生观察一些物质在水中溶解时产生的变化,引导他们探讨溶液的性质。
2.提问:你知道什么是溶液的酸碱性吗?溶液的酸碱性如何表示?
二、学习(15分钟)
1.教师讲解:介绍溶液酸碱性的概念,以及酸碱指示剂的使用方法和原理。
2.学生讨论:讨论不同溶液的酸碱性质,如醋、苏打水、盐水等。
3.实验操作:让学生通过酸碱中和实验,探究酸碱中和反应的特点。
三、实践(20分钟)
1.小组讨论:学生分组进行实验操作,确定不同溶液的酸碱性质。
2.实验报告:每组学生根据实验结果撰写实验报告,总结溶液酸碱性的特点和判断方法。
四、总结(5分钟)
1.学生总结:通过实验和讨论,学生总结溶液的酸碱性如何判断以及酸碱中和反应的特点。
2.提问:什么是酸碱中和反应?怎样判断一个溶液是酸性、碱性还是中性的?
五、作业(10分钟)
1.布置作业:要求学生回答几个与溶液酸碱性相关的问题,并完成一份实验报告。
2.作业检查:下节课之前,教师对学生的作业进行检查,并给予反馈。
六、延伸(5分钟)
1.延伸讨论:引导学生思考溶液酸碱性在日常生活中的应用,如饮食、药品等方面。
2.课堂小结:回顾本节课的重点内容,并提醒学生课下继续加强对溶液酸碱性的理解。
上海新版初三化学第七单第一节《溶液的酸碱性》难度偏大尖子生题(word版有解析)碱性》难度偏大尖子生题一.选择题(共 20 小题)A.A B.B C.C D.D2.下列叙述正确的是() A.溶液的酸性越强,pH 越大 B.用石蕊试液能够准确地测出溶液的 pH C.纯水的 pH=0D.紫色石蕊试液滴入稀盐酸中紫色石蕊试液变红3.下列数据是人体内一些液体的正常 pH 范畴,其中酸性最强的是()A.尿液 4.7~8.4 B.胃液 0.9~1.5C.血浆 7.35~7.45 D.唾液 6.6~7.14.常温下,下列是生活中常见物质的 pH,其中碱性最强的是()A.食醋 pH=3 B.洗涤剂 pH=12C.肥皂水 pH=10 D.厕所清洁剂 pH=15.肉类的鲜度能够通过测试 pH 来判定。
有资料显示,pH 与肉类新)A.变强B.变弱C.不变D.无法确定6.测得常见果汁的近似 pH,其中酸性最强的是()A.西瓜汁 pH=5.8 B.菠萝汁 pH=5.1 C.苹果汁 pH=3.7D.杨梅汁 pH=2.57.某同学测得一些食物的近似 pH 如下,其中酸性最强的是()A.苹果汁:3.1 B.玉米粥:7.5 C.牛奶:6.5 D.番茄汁:4.2)A.牛奶和玉米粥均属碱性食品 B.西红柿的酸性比苹果强C.柠檬汁能使酚酞试液变红D.胃酸过多的人应少食苹果9.某同学用 pH 计测得生活中一些物质的 pH 如表。
下列说法错误的是()A.柠檬汁能使无色的酚酞试液变红 B.胃酸分泌过多时要少饮用葡萄汁 C.鸡蛋清中滴入紫色石蕊试液显蓝色 D.遭蚊虫叮咬后会因为其分泌的酸性物质刺激而疼痒,可擦牙膏缓解经检测,扬州地区的土壤呈弱酸性,在扬州地区不适宜种植的农作物是()A.油菜B.水稻C.茶树D.甘草11.下列数据是一些物质的 pH,其中呈碱性的是()A.(9~11)液体肥皂B.(5~6)西瓜汁C.(4~5)酱油D.(2~3)柠檬汁)A.酸性变弱B.酸性变强C.酸性不变D.碱性变弱13.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是() A.向某无色溶液中滴加酚酞试液无现象,则该溶液一定呈中性 B.化合物差不多上由不同元素组成的,则不同元素组成的物质一定是化合物 C.在同一化合物中,金属元素显正价,则非金属元素一定显负价 D.含碳元素的物质充分燃烧会生成 CO2,燃烧能生成 CO2 的物质一定含碳元素14.下列数据是一些物质的 pH,其中呈碱性的是()A.(8﹣9)牙膏B.(6﹣7)胡萝卜C.(3﹣4)橘子D.(2﹣3)食醋15.下列溶液能使紫色石蕊溶液变红的是()A.NaOH 溶液 B.NaCl 溶液C.蔗糖溶液D.食醋16.如图是 X、Y、Z 三种液体的对应近似 pH,下列判定不正确的是()A.X 显酸性B.Y 一定是水C.Z 可能是某种盐溶液 D.Z 可使紫色石蕊试液变蓝17.下表所列为一些食物的近似 pH,关于胃酸过多的病人,空腹时最宜食用的食物是()A.柑桔B.苹果C.牛奶D.玉米粥18.实验测得人体内一些液体 pH 如下,其中酸性最强的是()A.唾液 6.6﹣7.1 B.胃液 0.9﹣1.5C.汗液 6.6﹣7.6 D.血浆 7.35﹣7.4519.下列两种不同 pH 的溶液混合,有可能得到中性溶液的是()A.pH=1 和 pH=7 B.pH=5 和 pH=14 C.pH=3 和 pH=4 D.pH=8和 pH=1020.若被蚊虫叮咬(蚊虫能分泌出蚁酸),可涂抹以减轻疼痛的物质是()A.食醋(pH<7) B.食盐水(pH=7)C.肥皂水(pH>7) D .稀盐酸(pH=0)二.解答题(共 10 小题)21.小颖通过查阅资料得知:紫甘蓝含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,因此她选做了如下实验:用紫甘蓝丝浸泡在肥皂水里,专门快变蓝,她又将另一些紫甘蓝丝浸泡在家庭厨房里的某种调味品中,变成了红色,依照上述现象回答(1)肥皂水呈(填“酸性”“中性”“碱性”)(2)小颖选用的调味品可能是。
溶液的酸碱性一、酸性溶液和碱性溶液1.二氧化碳的水溶液、食醋、酸果汁等物质都能使紫色石蕊试液变红色;使无色酚酞试液不变色,这是因为它们的溶液都表现出酸性。
2.肥皂水、石灰水、纯碱溶液、氨水等物质都能使紫色石蕊试液变蓝色;使无色酚酞试液变红色,这是因为它们的溶液都表现出碱性。
3.食盐水、蔗糖水等溶液不能(填“能” 或“不能”)使紫色石蕊试液或无色酚酞试液变色,这是因为,这些溶液既不表现为酸性,也不表现为碱性,而是呈中性。
酸性溶液一定是酸溶液吗?碱性溶液一定是碱溶液吗?答案:酸性溶液并不一定是酸溶液;碱性溶液也并不一定是碱溶液;但是酸溶液一定呈酸性,碱溶液一定呈碱性。
4.能检验溶液酸碱性的试液被称为酸碱指示剂,常用的酸碱指示剂是紫色石蕊试液和无色酚酞试液。
指示剂遇到酸或碱溶液变色,而不是酸或碱溶液变色。
5.为了使用方便,还可以用蓝色或红色石蕊试纸来检验溶液的酸碱性。
酸性溶液能使蓝色石蕊试纸变红色,碱性溶液能使红色石蕊试纸变蓝色。
酸碱指示剂的实际应用点拨:1.能够检验溶液酸碱性的试液,称为酸碱指示剂。
不同的酸碱指示剂在酸性或碱无色酚酞试液只能将碱性溶液鉴别出来,无法将酸性溶液、中性溶液区别开来。
2.蓝色或红色石蕊试纸也能用来检验溶液的酸碱性。
【例】用酒精和水浸泡蝴蝶兰花可得到紫色溶液,该溶液遇酸溶液显红色,遇碱溶液显黄色。
下列说法不正确的是( )。
A.蝴蝶兰花的溶液与酸作用显红色是物理变化B.能使蝴蝶兰花的溶液显黄色的一定是碱C.将氯化钠溶液滴入蝴蝶兰花的溶液后,溶液仍为紫色D.蝴蝶兰花的溶液可用作酸碱指示剂思路点拨:溶液酸碱性的判断以及指示剂的变某某况一般与工农业生产、社会实践、生活实际等联系起来,解答此题主要是掌握好溶液的酸碱性使指示剂变色的情况。
解析:蝴蝶兰花的溶液与酸溶液、碱溶液作用显示不同的颜色,是由于蝴蝶兰花的溶液与酸性溶液、碱性溶液发生化学变化生成一种有其他颜色的新物质的缘故。
能使蝴蝶兰花的溶液呈黄色的一定是碱性溶液,但不一定是碱溶液,如碳酸钠溶液显碱性,但属于盐类物质。
初中化学物质的酸碱性和pH值化学物质的酸碱性是指物质在溶液中释放或接受氢离子的能力。
pH 值则是用来测量溶液酸碱性强弱的指标。
本文将详细介绍初中化学中物质的酸碱性及pH值的概念和相关知识。
Ⅰ. 简介化学物质的酸碱性是指物质在溶液中的化学性质,通常分为酸性和碱性两种。
酸性物质能在溶液中释放氢离子(H+),而碱性物质能在溶液中接受氢离子。
pH值是用来测量溶液酸碱性的指标,它的范围是0到14之间,数值越小表示酸性越强,数值越大表示碱性越强,7表示中性。
Ⅱ. 酸和碱的定义酸和碱是化学的基本概念,下面分别对它们进行定义。
1. 酸的定义酸是指具有酸性质的物质,它能够在水中释放出氢离子。
根据酸的强弱不同,可分为强酸和弱酸。
强酸能够完全解离,如硫酸(H2SO4),而弱酸只能部分解离,如乙酸(CH3COOH)。
2. 碱的定义碱是指具有碱性质的物质,它能够在水中接受氢离子。
同样根据碱的强弱不同,可分为强碱和弱碱。
强碱能够完全解离,如氢氧化钠(NaOH),而弱碱只能部分解离,如氨水(NH3(aq))。
Ⅲ. pH值的计算pH值是用来测量溶液酸碱性的指标,下面介绍pH值的计算方法。
1. pH值的计算公式pH值的计算公式为pH=-log[H+],其中[H+]表示溶液中的氢离子浓度。
通过测定溶液中的[H+],我们可以得到相应的pH值。
2. pH值范围的解释pH值的范围是0到14之间。
当pH值小于7时,溶液呈酸性;当pH值大于7时,溶液呈碱性;而pH值等于7时,则表示溶液呈中性。
Ⅳ. 酸碱性指示剂酸碱性指示剂是用来检测溶液酸碱性的物质,下面介绍常见的酸碱性指示剂及其变色范围。
1. 酸性指示剂酸性指示剂在酸性条件下具有颜色变化的特性。
常见的酸性指示剂有苯红、甲基橙等,它们在酸性溶液中呈红色或橙色。
2. 碱性指示剂碱性指示剂在碱性条件下具有颜色变化的特性。
常见的碱性指示剂有酚酞、甲基紫等,它们在碱性溶液中呈紫色或红色。
3. 中性指示剂中性指示剂在中性条件下保持原有颜色不变。
第七章应用广泛的酸、碱、盐第一节溶液的酸碱性(2课时)岔庙职业中学化学备课组主备人:朱雪峰【教学目标】认知目标:1.认识溶液的酸碱性,学会用酸碱指示剂判断溶液的酸碱性;2.学会利用pH试纸来定量的测定溶液的酸碱度;3.知道酸碱性对生命活动及其农作物生长的重要性及影响。
4、初步了解酸、碱、盐的概念及其溶解性;5、初步学会物质的分类,并初步学会区分物质的类别。
能力目标:1.学会使用酸碱指示剂来检验溶液的酸碱性;2.能通过实验现象对某些问题初步作出正确的科学判断;情感目标:通过酸碱指示剂的使用,了解化学测量在化学研究和生产、生活中的重要作用【教学重点与难点】1.酸碱指示剂在酸碱溶液中显示不同的颜色;2.用pH试纸来表示溶液的酸碱度;3、酸、碱、盐的概念;4、物质的简单分类。
2.能使紫色石蕊试液变蓝的溶液,表现出碱性,为碱性溶液。
如:纯碱溶液,肥皂水,石灰水【教学过程】引入:日常生活中有哪些物质曾给你留下过“酸”的印象。
食醋、酸奶有酸味,苹果、桔子、葡萄等水果有酸味,因消化不良导致胃酸过多等。
面团用酵母发酵,条件控制不好会发酸。
酒若保存不好也会发酸。
在化学实验室也有许多酸性的溶液,与酸性溶液相对的是碱性溶液,如氨水,氢氧化钠溶液,但在通常情况下,是不允许品尝化学试剂的味道的。
那么,我们怎么确定物质的酸碱性呢?酸性溶液用紫色石蕊试液,能使紫色石蕊试液变红。
如在二氧化碳的水溶液中滴入紫色石蕊试液,紫色石蕊试液变红。
碱性溶液用无色酚酞,能使无色酚酞变红色。
P178活动与探究:在反应板上分别滴入2~3滴白醋、酸果汁、稀盐酸,再各滴入2滴紫色石蕊试液。
再在反应板上分别滴入2~3滴白醋、酸果汁、稀盐酸,滴入1滴无色酚酞试液。
观察现象:紫色石蕊试液变红色。
无色酚酞试液不变色。
像白醋、酸果汁、稀盐酸这些能使紫色石蕊试液变红的溶液,我们称为酸性溶液。
活动与探究:在反应板上分别滴入2-3滴纯碱溶液、石灰水、氨水、肥皂水,再各滴入1滴无色酚酞试液,观察颜色的变化。
第⼀节溶液的酸碱性第⼀节溶液的酸碱性第⼀课时执笔⼈:马萍审稿:化学组学习⽬标:1.认识溶液的酸碱性。
会⽤酸碱指⽰剂定型的检验溶液的酸碱性;会使⽤PH 试纸定量的测定溶液的酸碱度;2.知道酸碱性对⽣命活动和农作物⽣长的重要性及其影响;3.通过指⽰剂的使⽤,了解化学测量在化学研究和⽣产、⽣活中的重要作⽤;4.会⽤溶液酸碱性的知识解释⽣活中的⼀些有关现象。
学习⽅法:探究法、⽐较法、讨论法、归纳法等重点、难点:1、掌握⼏种常⽤酸碱指⽰剂的显⾊情况2、初步学会PH试纸的使⽤⽅法回顾已知将⼆氧化碳⽓体通⼊紫⾊的⽯蕊试液中,紫⾊的⽯蕊试液变成红⾊,说明碳酸显性,正常⽣活中,⾷⽤松花蛋时常感到有涩味,是因为制作过程中⽤了熟⽯灰和纯碱等性原料。
因此,⾷⽤时可添加⾷醋做调味品,以减轻涩味。
⾃学已知1.像⽯蕊、酚酞这样的能检验溶液的试液,称为酸碱指⽰剂,不同的酸碱指⽰剂在酸性或碱性溶液中呈现的颜⾊。
酸性溶液能使紫⾊的⽯蕊试液变成⾊。
⽆⾊酚酞试液遇酸⾊,碱性溶液使紫⾊的⽯蕊试液变成⾊,使⽆⾊酚酞试液变成⾊。
⾷盐⽔、蔗糖⽔等中性溶液使紫⾊的⽯蕊试液和⽆⾊酚酞试液。
因此,可以⽤酸碱指⽰剂来检验溶液的酸碱性。
为了使⽤⽅便,通常还⽤蓝⾊或红⾊⽯蕊试纸来检验溶液的酸碱性,酸性溶液能使蓝⾊的⽯蕊试纸变,碱性溶液使红⾊的⽯蕊试纸变。
2.⼈们⽤或来表⽰溶液的酸性或碱性强弱的程度,⽤可以测定溶液的酸碱度.。
PH= 7时,溶液呈;PH〈7时,溶液呈;PH〉7时,溶液呈。
3.PH越⼤,;PH越⼩,。
4.测定溶液酸碱度的⽅法是。
课堂新知:⼀、酸性溶液和碱性溶液⽯蕊⽆⾊酚酞酸性红⽆⾊碱性蓝红⾊⼆、溶液酸碱性的强弱程度酸度碱度PH三、溶液酸碱性与⽣命活动的关系课堂⼩结:本节主要内容巩固基础1. ⑴铝常⽤作炊具,主要利⽤它的性;⑵常温下铝是⼀种活泼⾦属,但铝却有较强的抗腐蚀性,其原因是。
⑶柠檬汁、⾷醋PH 7,它们不宜⽤铝锅、铝杯盛放的原因是。
⑴苹果汁和葡萄汁相⽐较,酸性较强的是 ,能使紫⾊的⽯蕊试液变成⾊;⑵⼈的胃液⾥含有盐酸,对于胃酸过多得⼈,空腹时最宜⾷⽤上述⾷物中的。