微生物标本采集、运送及管理
- 格式:doc
- 大小:148.00 KB
- 文档页数:24


微生物标本采集送检及处理原则一、标本采集1.采集时机:采集标本应在疾病出现初期进行,避免开始使用抗生素治疗前采集。
2.采集部位选择:根据病情选择合适的部位进行采集,一般可根据症状、疾病类型和临床表现进行判断。
3.采集方法:采集标本时应采取无菌手法,使用无菌采样器材,避免污染和交叉感染。
4.标本储存条件:采集后的标本应立即送往实验室进行检测,若无法及时送达实验室,则应储存在合适的条件下,避免细菌的生长和繁殖。
二、标本送检1.标注采集信息:标本送检前应在标本瓶或容器上标注病人信息、采集时间和采集部位等必要的信息,确保标本的准确性和唯一性。
2.冷藏和运输:对于易变质的标本,如粪便、尿液等,应冷藏并尽早送达实验室;对于其他标本,应采取适当的保存和运输方式,避免温度过高或过低,影响细菌的生存和检测结果的准确性。
三、标本处理1.标本处理前的准备:在对标本进行处理前,必须进行准备工作,如标记标本编号、记录标本类型、检查标本的一致性和完整性等。
2.标本处理方法:根据标本类型的不同,采取相应的处理方法,如深部标本(如脑脊液、关节液等)应优先进行细菌涂片、培养等方法,浅部标本(如咽拭子、鼻拭子等)可直接进行细菌培养。
3.标本处理的时间:不同类型的标本处理时间有所不同,但一般应尽快进行处理,避免细菌在标本中的生长和污染。
四、标本保存1.标本封存:处理完的标本应在标本瓶或容器上进行标注,并进行封存,避免污染和交叉感染。
2.标本保存时间:保存标本的时间应根据实验室的需求和标本的特性来确定,如对于一些常见的标本,如尿液、粪便等,一般保存时间较短,而对于其他一些特殊标本,如组织标本等,可保存更长时间。
总之,微生物标本采集送检及处理原则的正确遵守可以确保实验结果的准确性和可靠性,为疾病的诊断和治疗提供有力的支持。
同时,医务人员在进行标本采集和处理过程中应加强无菌操作和个人防护,有效避免交叉感染的发生,保障自身和他人的健康安全。


临床微生物标本采集和运送基本原则一、临床微生物标本采集基本原则1.标本来源与采集部位临床微生物标本主要来源于患者体内的各类体液、组织和生物材料。
采集部位包括呼吸道、消化道、泌尿生殖道、皮肤、创伤、手术部位等。
采集时应选择感染灶、病变部位或易感部位,以确保标本的代表性和可靠性。
2.采集工具与消毒采集微生物标本时,应使用无菌、一次性采集器具。
采集器具在使用前应进行消毒处理,以确保不会引入外来微生物污染。
消毒方法可选用高温、高压、化学消毒剂等。
3.采集操作步骤(1)准备工作:评估患者病情,向患者及家属解释采集目的和注意事项,取得患者知情同意。
(2)佩戴个人防护装备:口罩、手套、护目镜或面罩。
(3)消毒:使用消毒剂对采集部位进行皮肤消毒。
(4)采集:根据不同标本类型,进行相应操作,如穿刺、刮片、抽取等。
(5)封装:将采集完成的标本放入无菌容器中,密封,注明患者信息、采集部位、日期等。
二、临床微生物标本运送基本原则1.标本容器与标记运送微生物标本时,应选用防漏、耐压、易保存的容器。
容器表面应清晰标记患者信息、采集部位、标本类型等,以便于实验室接收和处理。
2.运送条件与时间要求微生物标本应在采集后尽快送达实验室,一般要求在2-4小时内完成。
运送过程中,应保持标本容器密封,避免剧烈晃动,确保标本质量。
3.运送过程中的注意事项(1)夏季高温时,可采取冰袋降温措施,防止标本变质。
(2)注意标本容器不离手,避免摔碎或泄露。
(3)如需长途运输,应采取适当包装,确保标本在运输过程中不受损。
三、标本质量控制与标准化1.微生物实验室的质量管理体系实验室应建立完善的质量管理体系,包括人员培训、设备维护、检测方法、室内质量控制等,以确保检验结果的准确性和可靠性。
2.标本接收与处理实验室接收标本时,应核对标本信息,检查标本容器、运送条件等。
对标本进行登记、分类、编号,并按照标准化流程进行处理。
3.室内质量控制与外部质量评估实验室应定期进行室内质量控制,包括质控品的检测、方法比对、仪器校准等。

临床微生物标本采集和运送基本原则【最新版】目录一、微生物标本采集和运送的重要性二、微生物标本采集的基本原则1.采集时机2.无菌操作3.采集量4.标本保存5.标本运输三、微生物标本运送的基本原则1.运送条件2.运送时间3.运送包装四、微生物标本采集和运送的意义正文微生物标本采集和运送是临床微生物学检验的基础环节,对于保证检验结果的准确性和可靠性具有重要意义。
本文将详细介绍微生物标本采集和运送的基本原则。
一、微生物标本采集的基本原则1.采集时机:微生物标本的采集应在抗生素使用前,以避免抗生素对病原微生物的杀灭作用。
在感染初期或病情加重时采集标本,可提高病原体的检出率。
2.无菌操作:在微生物标本采集过程中,应严格执行无菌操作,避免正常菌群和其他杂菌的污染。
采集非无菌部位的标本时,应尽量减少污染。
3.采集量:微生物标本的采集量要充足,以便进行后续的培养和检测。
不同类型的标本有不同的采集量要求,一般要求采集足够量的标本。
4.标本保存:微生物标本在采集后应及时保存,室温下保存时间不得超过 2 小时(夏季保存时间应适当缩短或冷藏保存),冷藏保存时间不得超过 8 小时。
5.标本运输:微生物标本在运输过程中应保持无菌状态,避免温度过高或过低,以及剧烈震动。
运输包装应具有良好的保护性能,防止标本破损或泄漏。
二、微生物标本运送的基本原则1.运送条件:微生物标本在运送过程中应保持适宜的温度和湿度,避免高温、低温和干燥。
不同类型的标本有不同的运送条件要求,一般要求在 2-8℃的条件下运送。
2.运送时间:微生物标本的运送时间应尽量缩短,以减少病原体的死亡或活性降低。
一般要求在采集后 24 小时内送检。
3.运送包装:微生物标本的运送包装应具有良好的保护性能,防止标本在运输过程中破损或泄漏。
包装材料应无毒、无菌、防渗漏。
三、微生物标本采集和运送的意义微生物标本采集和运送的质量直接关系到临床微生物学检验的结果。
正确采集和运送微生物标本,可以提高病原体的检出率,为临床诊断、治疗和预防感染提供可靠的依据。
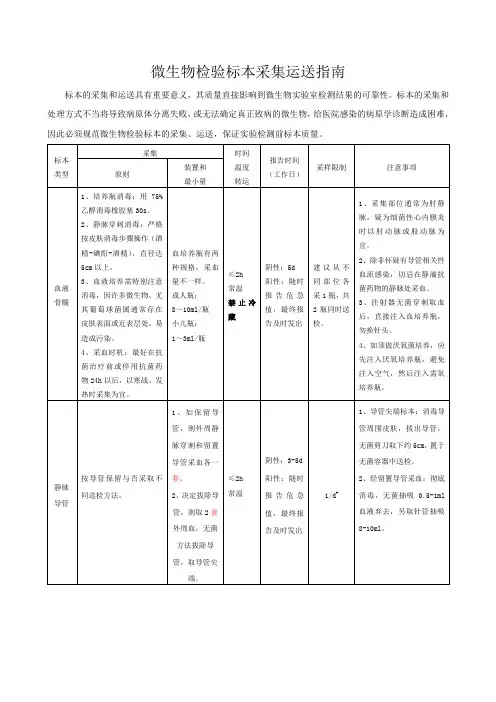

病原微生物标本采集运送IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】病原微生物检验标本采集、运送操作规程正确的标本采集,运送,保存和处理对于微生物检验工作质量至关重要,为了准确检出病原菌,避免漏检与误诊,临床医护人员和实验室工作人员应掌握微生物标本的选择,采集,运送,保存及处理的一般原则。
一、标本采集的一般原则1.早期采集采集时间最好在病程早期,急性期,且必须在使用抗菌药物之前采集,确保病原菌的检出。
2.无菌操作采集标本时应尽量减少或避免感染部位附近或皮肤黏膜正常菌群的污染,使病原菌与正常菌群混淆,造成临床误诊。
采集的标本应存放在无菌容器内,容器不能使用消毒剂处理,标本中也不能添加防腐剂,以免降低病原菌的检出。
3.适量的标本标本量过少可能导致假阴性结果。
4.适当的采集方法对于厌氧菌,需氧菌或兼性厌氧菌的采集方法是不同的,用于厌氧菌培养的标本应尽量用注射器采集抽取物,室温保存,不能冷藏和冷冻。
5.盛放标本的容器采集标本应存放在无菌,防漏,应带有螺旋盖的容器内。
二、标本的运送1.标本采集后立即送检,若有延迟也应在2小时内送到实验室,否则会影响病原菌的检出,一般性的细菌培养标本若需延迟送检时,应置于4度冰箱保存,且不能超过24小时。
2.临床标本最佳运送时间取决于标本的量,少量液体(小于1ml)或组织(小于1cm3)应在15~30分钟内送到实验室,较多量的标本置于运送培养基中可放12~24小时,厌氧培养标本原则上是床边接种,如延迟送检,需保存在厌氧运送培养基中,室温保存,不得超过24小时。
三、不同标本的采集,运送(一)血液标本采集,运送1.血培养指针征当患者出现:发热(大于38度)或低温(小于36度),寒战,白细胞增多,皮肤黏膜出血,休克,多器官衰竭,血压降低,c反应蛋白升高及呼吸加快,血液病患者出现粒细胞减少,血小板减少等,具备上述一种或几种体征时,临床怀疑菌血症应采集血液标本进行血培养,对入院危重感染患者应在未使用抗菌药物治疗前,及时做血培养。


临床微生物标本采集与运送临床微生物标本采集与运送一、血培养标本采集、运送与报告标准操作规程血培养是一种常见的检测方法,适用于疑似血流感染的患者。
当患者出现寒战、体温超过38℃或低体温时,应考虑进行血培养检测。
特别是对于存在以下情况的患者,更应该抽血做细菌和真菌培养:医院内肺炎;留置中心静脉导管超过72小时;感染性心内膜炎;骨髓炎;有严重基础疾病、免疫缺陷伴全身感染症状;临床医生怀疑有血流感染可能的其他情况。
二、采血时机一旦怀疑患者可能存在血流感染,应立即采血做血培养。
最好在抗菌治疗前或停用抗菌药物24小时后采集,以寒战、发热时采集为宜。
三、采血流程一)消毒对于培养瓶,应使用消毒液进行消毒,并等待其干燥后再使用。
对于皮肤,应使用消毒液从穿刺点向外画圈消毒,至消毒区域直径达5 cm以上。
待消毒液挥发干燥后(常需30秒以上),再进行穿刺采血。
二)静脉穿刺和培养瓶接种成人用注射器无菌穿刺取血后,排尽针头内空气,直接注入血培养瓶,勿换针头。
如果行第二次穿刺或用头皮针取血时,应换针头。
先注于厌氧培养瓶,避免注入空气,然后注入需氧培养瓶,轻轻混匀以防血液凝固。
近年来,临床普遍采用负压血培养瓶,将血从患者静脉直接吸入血培养瓶,减少污染环节。
三)注意事项检验单需注明抗菌药物使用情况、血液采集时间和部位、临床诊断等患者信息。
采血部位通常为肘静脉,疑为细菌性心内膜炎时以肘动脉或股动脉采血为宜,切忌在静滴抗菌药物的静脉处采血。
除非怀疑有导管相关的血流感染,否则不应从留置静脉或动脉导管取血,因为导管易被皮肤正常菌群污染。
对于成年患者,应该同时分别在两个部位采集血标本,在两个不同部位分离到同样菌种才能确定是病原菌。
4.关于细菌性心内膜炎的血培养方法:需要在24小时内取血3次,每次间隔不少于30分钟;如果必要,可以在次日再做2次血培养。
5.采血量的要求:推荐采用培养基与血液1:10的比例,以稀释血液中的抗菌药物、抗体等杀菌物质。


微生物检验标本采集和运送原则一、标本采集原则1.选择合适的采集时间:根据不同的微生物检验要求,合理选择合适的采集时间,避免检测结果的误差。
2.手部卫生:在采集标本前,进行手部卫生,包括彻底清洁双手并戴上无菌手套,以防止交叉感染。
3.选择合适的采集器具和培养基:根据标本类型和检测要求,选择相应的采集器具和培养基。
常见的采集器具有吸管、棉签、刷子等,培养基有血平板、巴氏平板、育苗平板等。
4.标本容器选择:选择合适的标本容器,不同类型的标本选择不同的容器,并正确标注标本信息。
标本容器应保持清洁和无菌。
5.采集部位消毒:采集标本前,需要对采集部位进行消毒处理,以减少细菌污染。
消毒可以用酒精棉球或碘酒进行。
6.采集标本量要足够:采集标本时,应确保采集的标本量足够,以保证检验结果的准确性。
对于液体标本,应采集适量的标本,避免过多或过少,对于固体标本,应采集充足的组织样本。
7.采集方式:根据标本类型和采集要求,选择合适的采集方式。
例如,对于尿液标本采集,应根据不同的检测项目选择早晨采集或随机采集。
8.标本保存:采集完标本后,应及时进行保存。
不同的标本有不同的保存条件,如尿液标本应保存在无菌容器中,放置在冷藏室中。
此外,应避免降低标本的质量,如尽量避免标本被太阳直射等。
二、标本运送原则1.运送时间:将采集的标本尽快送往检验室,以确保标本的新鲜度。
不同的微生物标本有不同的时间要求,如直肠拭子标本应在2小时内送达,尿液标本应在4小时内送达。
2.运送方式:标本的运送要采取合适的方式,以避免标本内的微生物因震荡或温度变化而受到影响。
常见的运送方式有冷藏运送、冷冻运送和常温运送等。
需要密封标本容器,防止泄漏。
3.标本的标识:在运送过程中,应在标本容器上正确标注标本的信息,包括患者的姓名、性别、年龄、住院号、就诊科室等,并附上标本的项目名称和送检医生的姓名。
4.运送温度控制:不同的标本有不同的温度要求。
应注意控制运送温度,避免过高或过低,以保持标本的稳定性。
微生物检验标本的正确采集、运送及处理,与细菌的培养、鉴定结果有十分密切的关系,医生、护士、检验人员均应重视微生物标本的正确采集的有关问题,并有责任向患者及家属进行正确采集标本的宣传和指导。
(一)微生物检验标本采集、运送、验收
1、标本的采集
不同的标本在采集时会在技术、方法和量方面的内容有所不同,但是最基本需要遵循的是以下几项:
(1)申请单必须标记清楚姓名、性别、年龄、病原号、标本来源(具体写明)、检查项目(目的要明确)等,以便试验室能够合理选择培养环境和培养基。
(2)尽量在抗生素应用前采集标本、以提**性检出率和避免漏检。
(3)标本采集应严格执行无菌操作。
(4)采集标本的容器必须经灭菌处理,不可用消毒剂。
2、标本运送
(1)标本采集后应尽快运送到细菌室。
(2)标本采集后在室温下超过2小时未送到细菌室的,可视为不合格标本。
3、标本验收
(1)实验室只接受和处理合格标本。
(2)实验室对不合格标本退回必须说明原因、并及时与临床联系。
4、注意事项
(1)微生物检验样本必须要求采集转运,否则将影响检查结果,并给评价其意义带来麻烦甚至误导。
(2)微生物样本极易被污染,污染的样本杂菌大量繁殖抑制病原菌生长,条件致病菌也是致病菌,如污染条件致病菌将误导临床,造成对患者的损害以及经济和时间的浪费。
(3)某些标本离体极易死亡,应在床边采取和接种或立即保温送至实验室检验。
室温放置或延迟送检,可使检出的阳性率降低;不能使用冷藏的样本检验。
(4)厌氧菌样本采取必须隔绝空气,混入空气的样本影响检验结果,不能使用。
病原微生物的标本采集,运输,储存,使用,销毁的管理流程
病原微生物的标本采集、运输、储存、使用、销毁的管理流程如下:
1. 标本采集:采集标本前,采样人员根据检验申请单检验项目的要求,确认采样计划并进行适当的准备工作,包括核对医嘱、打印条形码、
选择合适的标本容器、粘贴条形码及指导病人做好采样前的准备工作等。
2. 标本运输:标本运输人员负责收取标本和运输标本至微生物室。
运
输人员需对标本进行核收登记并签名。
3. 标本储存:根据病原微生物的类别将病原微生物分置于专用包装物
或容器内,但包装物和容器应符合<<病原微生物专用包装物容器的标
准和警示标识的规定>>。
盛装的病原微生物达到包装物或容器的3/4时,应当使用有效的封口方式,使封口紧实、严密。
医务人员在盛装
病原微生物前应当对包装物或容器进行认真检查,确保无破损,渗液
和其它缺陷。
4. 标本使用:实验室工作人员按医疗废物分类目录对病原微生物进行
分类。
使用时要认真核对病人、标本容器和检验申请单是否一致,严
防差错。
5. 标本销毁:病原微生物标本在使用后需要按照医疗废物分类目录进
行分类,并按照相关规定进行销毁。
微生物标本采集、运送及管理来源:时间:2007-10-08 字体:[大中小] 收藏我要投稿文章出处:朱敏转载请注明出处血液血液是实验室所接收的最重要的标本之一。
送检血液标本有助于识别由细菌、真菌引起的菌血症、脓毒血症、心内膜炎及人工瓣膜感染、化脓性血栓性静脉炎、以及其它感染或导管引起的感染(vascular grafts).因为大量的各种微生物与血源性感染有关,所以用于血培养的培养基应该能广泛支持各种细菌的生长。
所幸的是在过去的十多年间,已经发展出许多用作血培养的改进的培养基及技术,产生出了高度可靠的手工血培养基和自动化血液培养系统。
血标本量,采血时机,及采血量对于成人患者,每次发热时应该分别在两个部位采集血标本以帮助我们区分是病原菌还是污染菌,特别是对于凝固酶阴性的葡萄球菌、棒状杆菌、viridans链球菌、以及布鲁氏菌要考虑其污染的可能性。
一般来说,单一采集的血培养标本更可能被污染,而要检出具有代表性的病原体则往往要在两个以上部位采集两份以上的血作培养。
在24h内采血部位不得多于4个以上。
此限制考虑到一天中每次发热时只采集2个部位的血作2份血培养就可评价2次发热。
作再多的血培养都没有必要。
根据几份研究资料表明,95%以上的菌血症都是在头2、3份血培养中检测出来的。
采集血标本应该在使用抗生素之前,尽管有些培养基含有消除抗生素影响的物质。
理论上说,采血时机应恰好在发热高峰之前;而实际上应该是在发热高峰后立即采血。
采血的总量也是影响检出病原体的重要因素之一。
在一项研究中,增加血培养的血量从40ml到60ml可提高检出率10%。
对于成人,每次穿刺应采血20~30ml,。
对于儿童的采血量就要求少一些,因为其每毫升中的细菌要多些。
血与肉汤的比例以1:5~1:10更有利于检出细菌,这或许是肉汤稀释了抑菌物质的缘故。
大多数商业血培养系统为了最佳检出,都规定了必要的血标本量。
对于标本量不足的血培养标本不必拒收,除非使用的是Isolator system。
应定时举办讲座,向临床讲解最佳血培养技术。
初步处理血培养标本的初步处理需要视所用的培养系统而定。
送检的血培养瓶应放于室温待处理。
对于一些连续监测系统,培养瓶需要用针通气或将附件插在瓶顶用于压力测定,等等。
直接法我们不推荐血标本直接作Gram染色,因为通常血流中的细菌太少。
一旦检测到有细菌生长就应该取培养瓶的肉汤或培养瓶固相琼脂的细菌作Gram染色。
Gram染色报告应该详尽描述以便于选择适当的抗生素。
例如,排列的Gram阳性球菌应该作出描述,i.e.,成对的,簇状的,或链状的;而Gram阴性杆菌时,有描述为细小或球杆状的。
当怀疑阳性肉汤中为金黄色葡萄球菌时,要直接作一个…2-h凝固酶试管法实验‟,以快速作出鉴定。
有各种资料表明,有些商业鉴定板条能够直接用阳性肉汤接种鉴定出Gram阴性菌。
血培养系统(略)培养条件所有的血培养温度都应在35℃。
手工血培养系统应该培养7天。
只有肉汤的手工需氧培养瓶要在最后一天作传代培养。
对于自动化系统,培养5天就足以检出绝大多数细菌。
此外,采用这样的培养时间限制,几乎没有发现污染。
对于自动化的血培养不必转种作传代培养。
当转种阳性瓶时,所选择的需氧培养基要根据Gram染色涂片的镜下结果。
如果Gram染色镜下所见细菌形态提示可能为厌氧菌或者只从厌氧血培养瓶中检出细菌,转种时就要选择厌氧培养基及厌氧条件。
特别考虑的问题厌氧菌血液检出厌氧菌的机会很少。
在过去几年,一些研究表明血液中厌氧菌的感染呈下降趋势。
但是并非所有医院都如此。
因此,实验室应该回顾自己的数据以决定是否将厌氧菌的血培养作为常规检查项目。
手工血培养瓶/系统不宜用于培养厌氧菌。
自动化系统的厌氧培养基足以用于厌氧菌的培养,尽管这些仪器设备的功能还不是十分完美。
苛养菌有些可引起血液感染的细菌用常规的血培养方法不能检出。
布鲁氏菌可生长在常规培养基中;然而,虽然这些菌最少可在3天检出,但是还是建议培养保持21天;而且在某些情况下最后还是需要转种作次培养。
HACEK菌群(Haemophilus aphrophilis,Actinobacillus actinomycetemcomitans,Cardiobacterium hominis,Eikenella corrodens,and Kingella kingae)与细菌性心内膜炎有关,也可从常规培养基中培养出,但是需要培养至14天,并且最后需要转种培养。
当临床病史提示有弗朗西斯菌感染,阳性培养瓶还需要再另外转种一份到BCYE琼脂,而且所有操作都要在3级层流生物安全柜中按安全规定进行。
钩端螺旋体不能在常规培养基中检出。
在钩端螺旋体感染发病的第一周采集1~2滴血,应该接种在半固体培养基,如Fletcher‟s Ellinghausen-McCullough/Johmson-Harris,或者是Polysorbate 80.培养基,应于室温下培养至6周。
在血液中要发现Bartonella henselae(一种巴尔通体)很困难,但是在某些培养系统则可以培养出来。
用Isolator system 时应将处理过的血标本接种在营养加强的血琼脂或巧克力琼脂上,35℃,在提高二氧化碳含量及湿润环境下培养至4周。
采用Septi-Chek system 时,Bartonella henselae可以生长,但是要培养到40天。
采用只有肉汤的血培养系统培养这种病原体时,可将肉汤涂片,用吖啶橙染色可以观察得到菌体。
而这种病原体不会使肉汤浑浊,产生的二氧化碳量也不足以能够被仪器设备检测出来。
分支杆菌在过去几年中,分支杆菌在HIV患者中越来越多地出现感染流行。
这些细菌一般不会在血培养中检出。
导管头导管头的培养是为了确定菌血症的感染源。
最常用的方法为半定量法,此法是用5cm长的导管远端部分在血琼脂平板上反复涂抹4遍。
经培养产生的菌落数要>15个才有意义,才能认为存在导管引起感染的可能性。
另外,也已有许多其它用于鉴别是否为导管引起感染的技术报道。
……。
但是,至今还没有一个最佳实验室方法。
因为大多数这类感染有严重的临床表现,普通血培养就可以确定哪个患者需要治疗。
无菌体液脑脊液脑脊液标本是用于诊断脑膜炎。
细菌性脑膜炎又分为急性和慢性。
急性脑膜炎,在症状发作的前24h内,通常由化脓性细菌引起。
可能引起感染的病原体要根据患者的年龄以及区分是院外感染还是院内感染。
典型的细菌感染主要引起慢性脑膜炎,其症状至少持续了4周,病原体包括有结核分支杆菌,梅毒螺旋体,布鲁氏菌,问号钩端螺旋体,以及博氏疏螺旋体。
CSF通常是经腰椎穿刺采集。
每份细菌学检验至少需要0.5ml CSF,当然量多一点会更好。
标本应该立即送往实验室并尽快处理。
如果不能及时送检,标本应置于室温下。
如果采集的CSF多于1.0ml,应该离心至少1500 X g 15分钟。
上清液倾入无菌试管中,留取0.5ml的沉淀和液体,充分混匀,涂片镜检和接种平板培养基作培养。
另外,成倍多的标本可采用细胞分离制备标本。
在实验室所有的CSF标本都要作Gram染色。
其结果,包括微生物及所见细胞成分的描述和计数都要立即报告给申请医生。
快速方法可检测标本中的一些细菌的抗原:B群链球菌、肺炎链球菌、一些脑膜炎奈瑟氏菌的血清型、大肠埃希氏菌(K1囊抗原与脑膜炎奈瑟氏菌B型的有交叉反应),标本离心的上清液或原始标本中可检测到流感嗜血杆菌b型的抗原。
据一些研究资料表明,这些快速抗原检测的敏感性与Gram染色的差不多。
只是对于一些特殊的脑膜炎,其抗原测定会更敏感一些。
另外,研究发现这些快速抗原检测结果对于医生对患者的护理和治疗没有多大的影响。
主要原因是这些试验要比Gram染色贵得多,而且更费事。
许多实验室都不再开展这些快速实验或严格限制其使用(如,对于CSF中的白细胞>50时)或需要临床与实验室之间作好协商后。
CSF的培养应该考虑到所用的培养基以及培养条件要适合苛养菌的培养检出。
用肉汤培养基没有多大意义。
特殊考虑的问题厌氧菌厌氧菌几乎不引起脑膜炎;常规不要求作CSF的厌氧菌培养。
但是通常脑脓肿,硬膜下积脓及硬膜外脓肿要作厌氧菌。
分支杆菌除了对来自源于AIDS患者的CSF要作分支杆菌的检测外,对CSF作分支杆菌检测只考虑以下情况:脑脊液[淋巴]细胞增多,CSF葡萄糖值或蛋白质的值异常。
因为分支杆菌在CSF中的量少,所以作培养的标本量就要大点(3—5ml为好),CSF标本要离心3000到3600 X g 30分钟,到掉上清液,将沉淀用旋涡振荡器充分混匀,准备涂片用于AFB染色并接种于适当的培养基,包括液体培养基。
培养条件:35℃、8%的CO2环境,至少6周。
钩端螺旋体钩端螺旋体可以从发病前10天的CSF中发现。
采集标本应该在抗生素使用之前和病人在发热时采集。
要直接检测钩端螺旋体时,CSF标本就要以1500хg离心30分钟并取沉淀涂湿片在暗视野显微镜下观察。
钩端螺旋体可在半固体培养基上培养,如Fletcher‟s培养基,Ellinghausen-McCullough/Johnson-Harris培养基,或Polysorbate 80培养基培养检出。
离心沉淀标本建议接种0.5ml。
室温下培养至6周。
其它体液其中包括心包液、胸水、腹水和滑液。
对其用于微生物检验的送检标本最好是液体,而不是拭子。
1—5ml的量已足够检出大多数病原体。
对于非卧床透析患者的腹膜炎诊断要采集最少50ml标本才有利于检出病原体。
体液应直接接种于血培养瓶或者在床旁收集于无菌、厌氧容器中并立即送到实验室。
在实验室,1ml以上的标本应该至少以1500хg离心15分钟。
弃掉上清液,留取约0.5ml沉淀,混匀,涂片作Gram染色并接种于培养基中。
如果要采用细胞离心作涂片,在此之前大约要留取0.5ml标本作细胞离心。
未离心标本也可在实验室直接接种于血培养瓶中,留取少量(0.5—1.0ml)作Gram染色。
选择用于培养体液的固体培养基要有利于培养苛养菌。
只有在培养非卧床慢性患者的腹透液时才有必要接种液体培养基,其腹透液中的细菌很少只有约1CFU/ml。
是否需要其它体液接种于液体培养基应该由各实验室自己决定。
培养应该在有CO2的环境中,35℃培养。
特殊考虑的问题用于检验分支杆菌的体液标本的处理不同于检验其它细菌,离心要求为3000到3600хg,30min。
弃掉上清液,沉淀用于涂片作AFB染色并接种于相应的培养基。
培养条件:35℃,8% CO2,培养至少6周。
体液标本可以用含有抗凝剂的试管送检。
抗凝剂有肝素、枸橼酸盐和EDTA,对有些细菌有抑制作用。
所以最好还是不要用这种方式。
如果要采用抗凝剂,就必须要向申请检验的医生说明其对结果的局限性。
耳部位标本实验室收到的耳部位标本一般有两种,即用于诊断耳炎的拭子和用于诊断中耳炎的外耳、中耳液体。