固体物理晶体结构
- 格式:pdf
- 大小:13.10 MB
- 文档页数:48

固体物理中的晶体结构晶体是一种特殊的固态物质,具有高度有序的结构和周期性的排列。
晶体结构的研究是固体物理领域的一个重要课题,对于理解物质的特性和性质具有重要意义。
本文将介绍固体物理中的晶体结构,探讨晶体的组成以及晶格的特点。
一、晶体的组成晶体是由一定种类的原子、分子或离子有序排列而成的具有规则几何形状的固体物质。
晶体的组成可以分为两个主要部分:基本单元和空间格点。
基本单元是晶体中能够表示整个晶体的最小重复单位,也称为晶胞。
晶体的性质可以通过分析和了解晶胞的结构和成分来进行研究。
基本单元可以是原子、分子或离子。
空间格点是晶体结构中原子或离子所占据的位置,也可以看作是晶胞的顶点。
晶格可以展现晶体中原子或离子的位置关系,并决定了晶体的几何形状和物理性质。
在晶体结构中,空间格点呈现出周期性排列的特点。
二、晶体的晶格结构晶体的晶格结构是指晶体中空间格点的特点和分布规律。
常见的晶格结构有立方晶格、正交晶格、六方晶格、斜方晶格等。
立方晶格是晶体结构中最为简单和对称的一种晶格结构。
在立方晶格中,空间格点按照等距离分布,原子或离子在空间中呈现出立方形或立方体的排列形式。
立方晶格可以分为简单立方晶格、体心立方晶格和面心立方晶格。
正交晶格是晶体结构中空间格点按照直角坐标系的规律排列。
正交晶格的特点是空间格点按照垂直和平行于坐标轴的方向排列,原子或离子的位置按照直角坐标系展示。
六方晶格是晶体结构中空间格点的一种特殊排列形式。
在六方晶格中,空间格点呈现出六边形对称性,原子或离子按照六边形的排列方式分布。
斜方晶格是晶体结构中空间格点呈斜角形排列的一种晶格结构。
斜方晶格的特点是空间格点按照倾斜的方向排列,原子或离子的位置关系呈现出倾斜的特点。
三、晶体的晶胞结构晶胞是晶体结构中最小的单位,用于表示整个晶体的性质和结构。
晶胞可以分为原胞和超胞。
原胞是晶胞结构中的基本单位,能够完整地表述晶体的结构与性质。
原胞是一个具有周期性的重复单位,可以通过平移操作来重复堆叠构成整个晶体。





固体物理晶体结构晶体结构是固体物理学的一个重要研究方向,它研究的是固体材料内部的原子排列方式和空间组织形态。
晶体结构的研究对于深入理解固体物理和材料科学具有重要意义。
本文将从晶体结构的定义、种类、特点以及应用等方面进行详细讨论。
晶体是由原子、分子或离子组成的具有规则重复排列的固体物质。
晶体结构是指晶体中原子、离子或分子的空间排列方式。
晶体结构的特点是具有周期性、有序性和三维性。
具体地说,晶体结构的周期性意味着晶体中的原子、离子或分子在空间上有规则的重复排列,即具有相同的周期性结构单元;有序性表示晶体中的原子、离子或分子形成了有规则的结构,各个粒子之间存在着一定的有序关系;三维性表示晶体结构可以延展到整个空间,形成一个连续的三维网状结构。
根据晶体的组成物质和结构特点,晶体结构可以分为原子晶体和离子晶体。
首先,原子晶体是由原子构成的晶体。
原子晶体可以进一步分为金属晶体、共价晶体和分子晶体。
金属晶体是由金属原子通过金属键紧密排列而成,其特点是具有电子云的金属离子之间遥相呼应,排列紧密。
共价晶体是由共价键连接的原子构成,其特点是原子间的共价键强度较大,形成了稳定的晶体结构。
分子晶体是由共用电子形成的原子团簇组成的,其特点是分子间的相互作用力较弱,分子之间通过静电作用和范德华力相互吸引。
原子晶体的典型代表有金属晶体铜、铝等;共价晶体的典型代表有钻石、石英等;分子晶体的典型代表有冰、盐等。
其次,离子晶体是由正负离子通过离子键连接而成的晶体。
离子晶体的特点是正负离子之间通过离子键形成了结晶的有序排列,正负离子按照固定的比例堆积构成了稳定的晶体结构。
离子晶体的典型代表有氯化钠、碳酸钙等。
晶体结构的研究在材料科学和物理学中具有广泛的应用。
首先,晶体结构的研究对于理解材料的性质和行为具有重要意义。
不同晶体结构的材料具有不同的物理性质,例如热导率、电导率、热膨胀系数等。
通过研究晶体结构,可以揭示材料的性质与结构之间的关系,为材料设计和制备提供理论指导。



固体物理学一:晶体结构1.晶体结构=空间点阵+基元2.晶格:晶体中原子的规则排列简称为晶格。
3.基元:在晶体中适当选取某些原子作为一个基本结构单元,这个基本结构单元称为基元。
4.结点:空间点阵学说中所称的“点子”代表着结构中相同的位置,称为结点。
5.点阵:格点的总体称为点阵。
6晶向:晶体中同一个格点可以形成方向不同的晶列,每一个晶列定义了一个方向,称为晶向。
7.简单格子晶体:基元只有一个原子的晶体,原子与晶格的格点相重合而且每个格点周围的情况都一样。
8.复式格子晶体:基元有两个或两个以上的原子构成的晶体。
9.声子:10.晶胞与原胞的区别:在同一晶格中原胞的选取不是唯一的,但他们的体积都是相等的,而晶胞的体积一般为原胞的若干倍。
11.绝对零度费米能:12.NaCl和CsCl的晶体结构:NaCl:晶胞为面心立方;阴阳离子均构成面心立方且相互穿插而形成;每个阳离子周围紧密相邻有6个阴离子,每个阴离子周围也有6个阳离子,均形成正八面体;每个晶胞中有4个阳离子和4个阴离子,组成为1:1。
CsCl:晶胞为体心立方;阴阳离子均构成空心立方体,且相互成为对方立方体的体心;每个阳离子周围有8个阴离子,每个阴离子周围也有8个阳离子,均形成立方体;每个晶胞中有1个阴离子和1个阳离子,组成为1:1。
13.晶体的结合方式,为什么能结合成晶体?①离子性结合,靠离子间的库伦吸引作用形成晶体;②共价结合,靠两个原子各贡献一个电子形成共价键进而形成晶体;③金属性结合,靠负电子云和正离子实之间的库伦相互作用结合成晶体;④范德瓦尔斯结合,靠瞬时的电偶极矩的感应作用结合成晶体。
14.晶体的结合能与平衡间距?晶体的结合能就是将自由的原子(离子或分子)结合成晶体时所释放的能量;晶体的平衡间距就是14.什么是晶格振动的德拜模型和爱因斯坦模型,其物理意义是什么,为什么德拜模型在低温时能给出较好的结果而爱因斯坦模型给出的结果较差?德拜模型:假设晶体是各向同性的连续弹性介质,格波可以看成连续介质的弹性波。

固体物理中的晶体结构1晶体是固体物理中的一个重要概念,它具有高度有序的结构和周期性。
晶体的结构对于材料的性能和行为起着决定性的作用。
本文将介绍固体物理中晶体结构的相关内容。
一、晶体的定义和分类晶体是由原子、离子或分子按照一定的方式排列而形成的固体。
晶体具有明确的几何形状和周期性结构。
根据晶体的基本结构单元和元素之间的相互排列方式,晶体可以分为单质晶体和化合物晶体两大类。
单质晶体是由同一种元素组成的晶体,如金刚石,石英等。
化合物晶体由多种元素组成,如盐类晶体、金属晶体等。
二、晶体的晶格和晶胞晶体的结构由一个重复单元组成,这个重复单元称为晶胞。
晶胞是由晶格点和晶胞参数组成的。
晶胞参数可以用来描述晶体的几何形状和尺寸。
晶格是晶体中一系列相互平行、等距和相互垂直的直线的集合。
晶格点是晶体中处于对称位置的固定点,可以用来描述晶体中原子、离子或分子的位置。
三、晶体结构的类型根据晶体结构的类型,晶体可以分为离子晶体、共价晶体、金属晶体和分子晶体等。
离子晶体由正负离子按照一定的比例排列而形成,如NaCl、CaF2等。
共价晶体以共价键连接的原子或分子为基本结构单位,如金刚石、硅等。
金属晶体是由金属离子形成的,如铜、铁等。
分子晶体由分子之间的相互作用形成,如冰、葡萄糖等。
四、晶体结构的描述晶体结构的描述方法有多种,包括布拉维格子、晶体晶系和晶体面指数等。
布拉维格子是晶格的空间重复单元,可以通过布拉维格子的晶胞参数来描述。
晶体晶系是指空间晶格对称性和晶胞形状的分类。
晶体面指数是用来描述晶体晶面方向的一组数值。
五、晶体缺陷晶体中可能存在各种缺陷,包括点缺陷、线缺陷和面缺陷等。
点缺陷是指晶体中的原子或离子位置的缺陷,如空位、插入原子等。
线缺陷是指在晶体中沿某个晶面或晶轴方向上出现的排列不规则的缺陷。
面缺陷是指晶体中出现的晶面形状不规则的缺陷。
六、晶体结构对物理性质的影响晶体结构对物理性质有着重要的影响。
例如,晶体的电子结构决定了它的导电性能;晶体的晶格结构和缺陷决定了它的机械性能;晶体的光学性质与晶格结构和原子的振动有关。
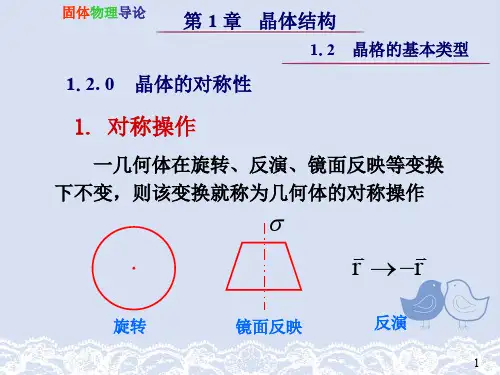
一、考试重点晶体结构、晶体结合、晶格振动、能带论的基本概念与基本理论与知识二、复习内容第一章晶体结构基本概念1、晶体分类及其特点:单晶粒子在整个固体中周期性排列非晶粒子在几个原子范围排列有序(短程有序)多晶粒子在微米尺度内有序排列形成晶粒,晶粒随机堆积准晶体粒子有序排列介于晶体与非晶体之间2、晶体的共性:解理性沿某些晶面方位容易劈裂的性质各向异性晶体的性质与方向有关旋转对称性平移对称性3、晶体平移对称性描述:基元构成实际晶体的一个最小重复结构单元格点用几何点代表基元,该几何点称为格点晶格、平移矢量基矢确定后,一个点阵可以用一个矢量表示,称为晶格平移矢量基矢元胞以一个格点为顶点,以某一方向上相邻格点的距离为该方向的周期,以三个不同方向的周期为边长,构成的最小体积平行六面体。
原胞就是晶体结构的最小体积重复单元,可以平行、无交叠、无空隙地堆积构成整个晶体。
每个原胞含1个格点,原胞选择不就是唯一的晶胞以一格点为原点,以晶体三个不共面对称轴(晶轴) 为坐标轴,坐标轴上原点到相邻格点距离为边长,构成的平行六面体称为晶胞。
晶格常数WS元胞以一格点为中心,作该点与最邻近格点连线的中垂面,中垂面围成的多面体称为WS原胞。
WS原胞含一个格点复式格子不同原子构成的若干相同结构的简单晶格相互套构形成的晶格简单格子点阵格点的集合称为点阵布拉菲格子全同原子构成的晶体结构称为布拉菲晶格子。
4、常见晶体结构:简单立方、体心立方、面心立方、金刚石闪锌矿铅锌矿氯化铯氯化钠钙钛矿结构5、密排面将原子瞧成同种等大刚球,在同一平面上,一个球最多与六个球相切,形成密排面密堆积密排面按最紧密方式叠起来形成的三维结构称为密堆积。
六脚密堆积密排面按AB\AB\AB…堆积立方密堆积密排面按ABC\ABC\ABC…排列5、晶体对称性及分类:对称性的定义晶体绕某轴旋转或对某点反演后能自身重合的性质对称面对称中心旋转反演轴8种基本点对称操作14种布拉菲晶胞32种宏观对称性7个晶系6、描述晶体性质的参数:配位数晶体中一个原子周围最邻近原子个数称为配位数。