蛋白质的结构知识要点总结
- 格式:ppt
- 大小:2.35 MB
- 文档页数:30

蛋白质的结构与性质1.蛋白质的存在蛋白质广泛存在于生物体内,是组成细胞的基础物质。
动物的肌肉、皮肤、血液、乳汁以及毛、发、蹄、角等都是由蛋白质构成的。
许多植物(如大豆、花生、小麦、稻谷)的种子里也含有丰富的蛋白质。
2.蛋白质的组成和结构蛋白质的相对分子质量很大,从几万到几千万。
例如,烟草斑纹病毒的核蛋白的相对分子质量就超过两千万。
因此,蛋白质属于天然有机高分子化合物。
(1)蛋白质的组成蛋白质是一类非常复杂的化合物,由C、H、O、N、S等元素组成,有些蛋白质含有P,少数蛋白质还含有微量Fe、Cu、Zn、Mn等。
(2)蛋白质分子的结构氨基酸是构成蛋白质的物质基础,氨基酸分子的种类和排列顺序决定了蛋白质分子的种类及相对分子质量的大小。
名师提醒(1)蛋白质是由不同氨基酸按不同顺序相互结合而形成的高分子化合物。
(2)蛋白质溶液具有胶体的性质。
3.蛋白质的性质(1)蛋白质的物理性质溶解性:有的蛋白质不溶于水,如丝、毛等;有的蛋白质溶于水,如鸡蛋清等。
少量的盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质溶解。
当向蛋白质溶液中加入的盐溶液达到一定浓度时,反而使蛋白质的溶解度降低而从溶液中析出,这种作用称为盐析。
实验探究 教材P89实验4-2 蛋白质的盐析名师提醒(1)盐析只改变蛋白质的溶解度,不改变其结构和化学性质,析出的蛋白质还能溶于水。
(2)盐析必须是浓的盐溶液,少量盐能促进蛋白质溶解。
(3)盐析常用于分离提纯蛋白质。
(2)蛋白质的化学性质 ①蛋白质的两性形成蛋白质的多肽是由多个氨基酸脱水形成的,在多肽链的两端存在着自由的—NH 2和—COOH 。
而且,侧链中也有酸性或碱性基团。
因此,蛋白质与氨基酸一样具有两性,既能与酸反应,又能与碱反应。
②蛋白质的水解在酸、碱或酶的催化作用下,蛋白质能发生水解反应。
蛋白质是由多种氨基酸构成的高分子化合物,其水解反应逐步进行:蛋白质−−−−−→水解酸、碱或酶相对分子质量较小的肽类化合物−−−→水解各种氨基酸。


蛋白质的生物学知识点蛋白质是生物体内的重要有机分子,不仅构成了细胞的主要组成部分,还承担着许多生物学功能。
在本文中,我们将逐步介绍蛋白质的结构、合成和功能等生物学知识点。
一、蛋白质的结构蛋白质的结构是指蛋白质分子的层次结构,主要包括四个层次:一级结构、二级结构、三级结构和四级结构。
1.一级结构:蛋白质的一级结构是指由氨基酸组成的线性多肽链。
氨基酸是蛋白质的基本组成单位,共有20种氨基酸。
它们通过肽键连接在一起,形成多肽链。
2.二级结构:蛋白质的二级结构是指多肽链中局部区域的空间排列方式。
常见的二级结构有α-螺旋和β-折叠。
α-螺旋是螺旋状的空间结构,而β-折叠是折叠状的空间结构。
3.三级结构:蛋白质的三级结构是指整个多肽链的三维空间结构。
它是由一级结构和二级结构共同决定的。
三级结构的稳定性主要依靠氢键、离子键和疏水作用等非共价相互作用力。
4.四级结构:蛋白质的四级结构是指由多个多肽链和辅助分子组成的复合物。
这些多肽链可以相同或不同,它们之间通过各种相互作用力相互结合而成。
二、蛋白质的合成蛋白质的合成是指生物体内将氨基酸组装成多肽链的过程,主要包括转录和翻译两个步骤。
1.转录:转录是指在细胞核中,DNA的一个段落作为模板合成RNA的过程。
转录过程中,DNA的双链解旋,RNA聚合酶根据DNA模板合成RNA链,形成信使RNA(mRNA)。
2.翻译:翻译是指在细胞质中,mRNA的信息被翻译成氨基酸序列的过程。
翻译过程中,mRNA与核糖体结合,tRNA将对应的氨基酸运输到核糖体,核糖体根据mRNA的信息合成多肽链。
三、蛋白质的功能蛋白质作为生物体内的重要分子,具有多种功能,包括结构功能、酶功能、运输功能、激素功能和抗体功能等。
1.结构功能:蛋白质是细胞的主要组成部分,可以构成细胞膜、细胞骨架和细胞器等结构。
2.酶功能:蛋白质中的酶可以催化生物体内的化学反应,例如消化食物、合成物质和分解废物等。
3.运输功能:一些蛋白质可以作为运输载体,将物质从一个位置运输到另一个位置,例如血红蛋白可以运输氧气到细胞。

蛋白质的知识点总结篇一:蛋白质的知识点总结一个通式-两个标准-三个数量关系--四个原因--五大功能(1)一个通式:是指组成蛋白质的基本单位氨基酸;氨基酸的通式只有1个,即(形象记忆:碳周围有四个邻居,三个固定邻居即-H、-COOH、-NH2,一个变动邻居即-R基)。
不同的氨基酸分子,具有不同的-R基。
(2)两个标准:是指判断组成蛋白质的氨基酸必须同时具备的标准有2个:一是数量标准,即每种氨基酸分子至少都含有一个氨基(-NH2)和一个羧基(-COOH);二是位置标准,即都是一个氨基和一个羧基连接在同一个碳原子上。
(3)三个数量关系:是指蛋白质分子合成过程中的3个数量关系(氨基酸数、肽键数或脱水分子数、肽链数),它们的关系为:当m个氨基酸缩合成一条肽链时,脱水分子数为(m-1),形成(m-1)个肽键,即脱去的水分子数=肽键数=氨基酸数-1;当m个氨基酸形成n条肽链时,肽键数=脱水分子数=m-n。
(4)四个原因:是指蛋白质分子结构多样性的原因有4个:①组成蛋白质的氨基酸分子的种类不同;②组成蛋白质的氨基酸分子的数量成百上千;③组成蛋白质的氨基酸分子的排列次序变化多端;④蛋白质分子的空间结构不同。
(5)五大功能:是指蛋白质分子主要有5大功能(由分子结构的多样性决定):①有些蛋白质是构成细胞和生物体的重要物质,如人和动物的肌肉主要是蛋白质;②有些蛋白质有催化作用,如参与生物体各种生命活动的绝大多数酶;③有些蛋白质有运输作用,如细胞膜上的载体、红细胞中的血红蛋白;④有些蛋白质有调节作用,如胰岛素和生长激素都是蛋白质,能够调节人体的新陈代谢和生长发育;⑤有些蛋白质有免疫(包括细胞识别)作用,如动物和人体的抗体能清除外来蛋白质对身体生理功能的干扰,起着免疫作用。
篇二:蛋白质的知识点总结1.蛋白质:以氨基酸为基本单位构成的生物大分子。
氨基酸分子以脱水缩合的方式相互结合:一个氨基酸分子的羧基(—COOH)和另一个氨基酸分子的氨基(—NH2)相连接,同时脱去一分子的水。

高一生物必修知识点:2.2.2蛋白质的结构和功能【必修一】高中生物必备知识点:2.2.2蛋白质的结构和功能1、组成及特点:(1) 蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50% 氢7% 氧23% 氮16% 硫0~3% 其他微量。
(2) 一切蛋白质都含N元素,且各种蛋白质的含氮量很接近,平均为16%。
(3) 氨基酸分子相互结合的方式是:一个氨基酸分子的羧基(-COOH)和另一个氨基酸分子的氨基(—NH 2 )相连接,同时脱去一分子水,这种结合方式叫做脱水缩合。
连接两个氨基酸分子的化学键(-NH-CO-)叫做肽键。
有两个氨基酸分子缩合而成的化合物,叫做二肽。
肽链能盘曲、折叠、形成有一定空间结构的蛋白质分子。
2、蛋白质的性质:(1) 两性:蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
(2) 水解反应:蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
(3) 胶体性质:有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
(4) 盐析:少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程.利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
(5) 变性:在热、酸、碱、重金属盐、紫外线等作作用下,蛋白质会发生性质上的改变而凝结起来.这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质.蛋白质的这种变化叫做变性。
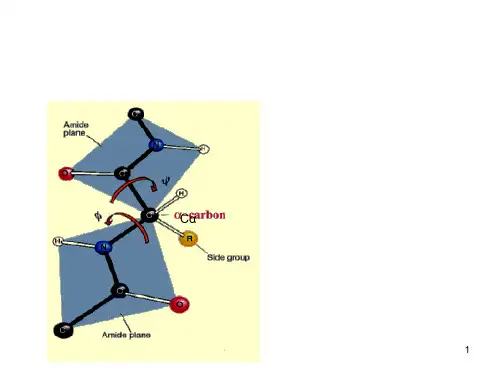


生物选修三上册知识点总结生物选修三上册主要包括了生物学的蛋白质生物化学、生物的调节和协调、植物的生长发育、生态系统的结构和功能等内容。
以下是对这些知识点的详细总结:一、蛋白质生物化学1.1 蛋白质的结构蛋白质是由氨基酸组成的长链状分子,其中包括20种常见的氨基酸。
蛋白质的结构主要分为四级结构:一级结构由氨基酸序列构成,二级结构由氢键或离子键使得氨基酸链折叠成α螺旋或β折叠片,三级结构由二级结构的折叠进而形成的立体结构,四级结构是由多个三级结构相互作用而形成的。
1.2 蛋白质的功能蛋白质在生物体内具有多种功能,包括结构功能、酶功能、传递信息、免疫功能等。
不同的蛋白质在生物体内扮演不同的角色,对于生物体的正常功能具有重要的调节作用。
1.3 蛋白质的合成蛋白质的合成包括转录和翻译两个过程:转录是将DNA中的遗传信息转录成mRNA,而翻译则是将mRNA编码的信息翻译成氨基酸序列的蛋白质。
1.4 蛋白质的降解蛋白质的降解是指将蛋白质分解成小分子的氨基酸,通常由蛋白酶来完成。
蛋白质的降解是维持生物体内蛋白质平衡以及提供氨基酸供能的重要过程。
1.5 基因工程与蛋白质生物技术基因工程技术可以通过重组DNA将特定基因导入到宿主细胞中,使其表达目标蛋白质。
蛋白质生物技术包括重组蛋白质的生产、蛋白质的纯化以及蛋白质的应用等。
二、生物的调节和协调2.1 神经调节神经系统通过神经元之间的电化学信号传递,实现了生物体内外环境信息的感知和调节,包括感觉神经元、传导神经元和运动神经元等。
2.2 激素调节内分泌系统通过激素的分泌和循环传递实现对生物体内外环境的调节和协调,包括兴奋激素、抑制激素和调节激素等。
2.3 生物节律生物节律是指生物体在一定条件下表现出周期性的生理和行为变化,包括昼夜节律、生理周期性节律等。
2.4 生物的协调生物体内外环境的变化需要生物体通过神经和内分泌系统的协同作用来完成调节和协调。
同时,细胞内的信号转导通路也是实现生物体内外环境的协调的重要手段。

生物化学蛋白质的化学知识点一、知识概述《生物化学蛋白质的化学知识点》①基本定义:蛋白质啊,简单说就是由许多氨基酸按一定顺序连起来的大分子。
就好比许多小珠子(氨基酸)串成一条长长的链子(多肽链),然后这些链子还能盘曲折叠,最后就形成了蛋白质。
②重要程度:在生物化学里那可是超级重要的。
像是细胞结构的组成部分啊,很多酶也是蛋白质,有了它们生物体内各种各样的化学反应才能顺利进行呢。
我觉得它就像建筑里的砖块一样,是构建生物体的基础。
③前置知识:咱们得先大概知道氨基酸是啥吧,毕竟蛋白质是由氨基酸组成的。
还有化学键的基本概念,像肽键就是连接氨基酸的重要化学键。
④应用价值:在制药方面,如果了解蛋白质的结构和功能,就能开发出针对特定蛋白质的药物。
在食品行业,像检测食物中的蛋白质含量也是基于这个知识点。
二、知识体系①知识图谱:蛋白质的化学知识点在生物化学学科里算是核心板块了。
它和核酸化学、酶化学等知识点都有联系。
打个比方,蛋白质和核酸就像伙伴,核酸给出指令,蛋白质负责做事。
②关联知识:和生物大分子中的核酸关联密切,核酸指导蛋白质的合成。
而且与新陈代谢的知识点也有联系,因为很多代谢反应是蛋白质(酶)参与催化的。
- 掌握难度:难。
- 关键点:理解蛋白质的一、二、三、四级结构比较难,像是四级结构,好多条肽链怎么组合起来的,得好好琢磨。
④考点分析:- 在考试中的重要性:非常重要。
- 考查方式:会直接考蛋白质的结构层次、氨基酸的组成计算,也会间接考蛋白质在某些生理过程中的作用。
三、详细讲解【理论概念类】①概念辨析:- 蛋白质就是由氨基酸通过肽键相连形成的高分子含氮化合物。
氨基酸好比是字母,按照特定顺序排列就能写出不同的单词(小的肽段),这些肽段再组装就成了蛋白质这个大文章。
②特征分析:- 具有两性电离特性。
这就是说它既能像酸一样给出质子,又能像碱一样接受质子。
比如说,在人体不同的生理pH环境下,蛋白质的带电情况就不一样。
- 有特定的空间结构。

蛋白质的结构高三知识点蛋白质的结构蛋白质是构成生物体的重要基础物质,具有多种功能。
了解蛋白质的结构对于深入理解其功能和作用至关重要。
本文将介绍蛋白质的结构,包括蛋白质的组成、一级到四级结构以及蛋白质的折叠。
一、蛋白质的组成蛋白质由氨基酸组成,氨基酸是蛋白质的基本组成单元。
常见的氨基酸有20种,它们可以通过肽键连接起来形成蛋白质的线性链。
每个氨基酸分子由一个羧基(COOH)和一个氨基(NH2)组成,其中羧基与氨基通过肽键相连,形成肽链。
二、蛋白质的一级结构蛋白质的一级结构指的是氨基酸在蛋白质中的线性顺序。
不同的蛋白质由不同的氨基酸组成,氨基酸的排列顺序决定了蛋白质的特性和功能。
例如,胰岛素和溶血素就是由氨基酸序列的差异导致其具有不同的功能。
三、蛋白质的二级结构蛋白质的二级结构是指氨基酸之间的空间排列方式。
常见的二级结构有α-螺旋和β-折叠。
α-螺旋是一种右旋的螺旋结构,通常由氢键连接每一个氨基酸与其相邻的第四个氨基酸,形成稳定的螺旋结构。
β-折叠是由相邻的氨基酸链的平行或反平行片段之间的氢键相互作用而形成的结构。
四、蛋白质的三级结构蛋白质的三级结构是指由一级和二级结构共同决定的空间结构。
蛋白质的三级结构决定了其独特的折叠方式和功能。
有时,蛋白质的三级结构也会包含一些非氨基酸成分,如金属离子和辅因子,它们能够影响蛋白质的结构和功能。
五、蛋白质的四级结构蛋白质的四级结构是指由多个蛋白质链相互作用而形成的复合物。
有些蛋白质由多个单独的蛋白质链组成,这些链可以通过非共价作用力相互结合形成复合物。
复合物的形成使蛋白质的功能得以进一步扩展和调控。
六、蛋白质的折叠蛋白质的折叠是指线性的氨基酸链在特定条件下从无序状态逐渐转变为稳定的三维空间结构的过程。
折叠使得蛋白质能够在细胞中发挥特定的功能。
蛋白质折叠的过程受到多种因素的影响,包括温度、pH值和离子浓度等。
结论蛋白质的结构对于其功能和作用至关重要。
本文介绍了蛋白质的组成、一级到四级结构以及蛋白质的折叠过程。

生物蛋白质结构知识点总结蛋白质是生命体中非常重要的一类有机分子,它们在细胞内起着多种功能,包括催化化学反应、携带信号分子、提供结构支持等。
蛋白质的功能与其结构密切相关,因此研究蛋白质的结构对于理解其功能具有重要意义。
蛋白质的结构包括一级结构、二级结构、三级结构和四级结构,每个层次都具有特定的特征和功能。
下面将对蛋白质结构的各个方面进行详细介绍。
一、蛋白质的一级结构蛋白质的一级结构是指其氨基酸序列的线性排列。
氨基酸是蛋白质的组成单元,通过肽键连接在一起形成多肽链。
蛋白质的一级结构决定了其二级、三级结构和功能。
蛋白质的一级结构可以通过测序技术得到,包括手工测序、自动测序和高通量测序等方法。
一级结构的研究对于理解蛋白质的功能和生物学意义具有重要意义。
二、蛋白质的二级结构蛋白质的二级结构是指其主链的局部空间构像。
常见的二级结构包括α-螺旋、β-折叠、β-转角等。
α-螺旋的特点是主链呈螺旋状,氨基酸侧链向外延伸;β-折叠的特点是主链呈折叠状,相对紧密排列;β-转角的特点是主链呈转角状,氨基酸侧链交替向两侧延伸。
二级结构的形成由氢键、范德华力等相互作用驱动。
蛋白质的二级结构决定了其空间构像和稳定性,对于蛋白质的功能具有重要意义。
三、蛋白质的三级结构蛋白质的三级结构是指其空间构像的整体排布。
蛋白质的三级结构由各种非共价相互作用所稳定,包括氢键、离子键、疏水作用、范德华力等。
蛋白质的三级结构决定了其功能和活性,因此对于理解蛋白质的生物学意义具有重要意义。
蛋白质的三级结构可以通过X射线晶体学、核磁共振等方法确定,这些方法可以得到高分辨率的结构信息,对于理解蛋白质的功能具有重要意义。
四、蛋白质的四级结构蛋白质的四级结构是指其多个多肽链相互组装形成的整体构象。
常见的四级结构包括同源二聚体、同源三聚体、异源复合物等。
多个多肽链通过非共价相互作用相互组装形成特定的结构,这种结构决定了蛋白质的功能和活性。
对于理解蛋白质的功能和生物学意义具有重要意义。
蛋白质知识点总结一、蛋白质的结构蛋白质是由一系列氨基酸残基以特定序列连接而成的长链状分子,基本上由二十种氨基酸组成,因此,蛋白质具有多样的空间构型和功能。
根据其结构和功能,蛋白质可以分为结构蛋白质、酶、激素、抗体和转运蛋白等几大类。
蛋白质的结构主要包括一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质链的氨基酸序列,包括多肽链的长度以及氨基酸的类型和排列顺序。
二级结构是指蛋白质链的局部结构,包括α-螺旋、β-折叠等形态。
三级结构是指蛋白质链的整体结构,由二级结构交相连而成。
四级结构是指由两个或多个多肽链相互作用而形成的复合物结构。
蛋白质的结构特点决定了它的功能。
二、蛋白质的生物学功能蛋白质是细胞中最重要的功能分子之一,具有多种生物学功能,包括结构功能、酶功能、激素功能、抗体功能和转运功能等。
蛋白质的结构功能主要体现在细胞的构成和支撑上,例如,细胞膜上的蛋白质可以提供机械支持、细胞识别、传递信号等作用;肌肉中的肌纤维蛋白则可以提供肌肉收缩所需的结构支持。
蛋白质的酶功能则是参与生物体的新陈代谢过程,调节代谢产物的合成和分解。
激素是调节机体生理功能的一种生物分子,包括胰岛素、生长激素、甲状腺激素等,它们都是由蛋白质合成的。
抗体是机体免疫系统产生的一种特殊蛋白质,具有识别和中和异物的作用。
转运蛋白则是细胞内外物质转运的载体蛋白。
三、蛋白质的生物合成蛋白质的生物合成是一种复杂的生化过程,主要包括转录和翻译两个过程。
转录是指DNA 模板链转录成RNA的过程,具体包括启动子识别、RNA聚合酶结合、连接和终止等步骤。
翻译是指mRNA上的密码子序列通过tRNA和核糖体转译成氨基酸序列的过程。
此外,还有多个后翻译修饰步骤,如信号肽切除、氨基酸修饰、蛋白折叠、糖基化等。
这些步骤需要多个酶和细胞器参与,如核糖体、蛋白质合成酶、内质网等。
蛋白质合成的速率受多种调控因素影响,如转录因子、启动子、启动子结合的辅助蛋白质以及转录和翻译过程中的调控因子等。
蛋白质的结构与功能分析蛋白质是生命活动中不可或缺的重要分子,它们通过一系列复杂的结构与功能相互作用,驱动着生物体的各项生理活动。
本文将着重介绍蛋白质的结构与功能分析。
一、蛋白质的结构蛋白质是由氨基酸组成的长链分子,在生物体内大量存在,广泛应用于生物体各个方面。
蛋白质的结构具有三个层次:一级结构、二级结构和三级结构。
1、一级结构一级结构是指蛋白质分子中氨基酸的线性顺序。
蛋白质中氨基酸的种类有20种,其排列顺序决定了蛋白质的一级结构。
在蛋白质中,一级结构的变化会导致其它结构的变化。
2、二级结构二级结构是指一条蛋白质链上所存在的α-螺旋、β-折叠等复杂的结构形态。
α-螺旋是形成螺旋状结构,而β-折叠则是形成平面状、折叠起伏的结构。
3、三级结构三级结构是指一条蛋白质链上各种二级结构的组合,形成了完整的空间构型,包括α-螺旋AB、β-折叠及其他结构。
在生物体内,每种蛋白质具有其独特的三级结构,决定着其各种功能的实现。
二、蛋白质的功能蛋白质的功能多种多样,可以归为酶、抗体、激素、载体、肌肉蛋白、结构蛋白等多个类别。
下面将介绍几种蛋白质的常见功能。
1、酶酶是最为常见的一种蛋白质,它们起到催化各种生命化学反应的作用,如蛋白酶、氧化酶、乳糖酶等等。
它们具有高催化性和高可选择性,可以加快生命体内各种生化反应的速度。
2、抗体抗体也是一种重要的蛋白质,具有免疫作用,在生物体内可以识别并攻击外来的病原体,保护生物体的健康。
抗体与病原体之间的相互作用也是基于蛋白质的三级结构。
3、激素激素是生物体内的一种信使分子,可以通过血液循环系统或神经介质传递信号,调节各种生理功能的活动,在机体内具有重要的调节作用。
激素的产生和作用都依赖于体内蛋白质的存在和互相作用。
4、载体载体是一种能够运输其他生物分子的蛋白质,在生物体内起到传递物质的作用。
例如,血红蛋白可以运输氧分子,在身体内血液循环的过程中将氧从肺部运输到组织细胞,维持生命活动。
高中生物蛋白质知识点总结高中生物蛋白质知识点总结:1. 蛋白质是由氨基酸组成的生物分子。
氨基酸是蛋白质的基本组成单元,共有20种常见的氨基酸。
它们通过肽键连接成一条肽链,进而形成蛋白质。
2. 蛋白质具有多种生物功能。
它们可以作为酶催化化学反应、作为结构蛋白维持细胞的形状和稳定性、作为运输蛋白负责物质的运输、作为激素调控生物体的生理过程、作为抗体抵抗外界病原体的侵袭等。
3. 蛋白质的结构多样性。
蛋白质的结构可以分为四个层次:一级结构是指氨基酸的线性排列方式,二级结构是指氨基酸间的局部空间排列,常见的二级结构有α-螺旋和β-折叠,三级结构是指蛋白质立体空间结构的整体排列方式,四级结构是指不同多肽链之间的相互作用或组装。
4. 蛋白质的合成与折叠。
蛋白质的合成发生在细胞中的核糖体上。
合成后的蛋白质需要经历折叠过程才能成为具有生物活性的功能蛋白质。
蛋白质的折叠过程由分子伴侣蛋白质辅助进行,并受到细胞内环境的影响。
5. 蛋白质的表达调控。
蛋白质的表达调控是指细胞如何根据外界和内部信号来合成和调控蛋白质的数量和种类。
主要的调控方式包括转录调控、转运调控、翻译调控和后转录调控等。
6. 蛋白质缺陷与疾病。
蛋白质缺陷与疾病之间存在密切的关联。
许多遗传性疾病和神经退行性疾病都与蛋白质的异常合成、折叠和降解有关,如先天性代谢性疾病、癌症、阿尔茨海默氏病等。
7. 蛋白质的检测与分离。
蛋白质的检测和分离是研究蛋白质功能和性质的基础。
常用的方法包括SDS-PAGE凝胶电泳、西方印迹、质谱等。
8. 蛋白质的应用。
蛋白质在生物科学和医学领域有广泛的应用。
例如,蛋白质药物可以作为治疗疾病的药物;蛋白质工程可以用于改良农作物品质和生物制造等。
9. 蛋白质与基因。
蛋白质的结构和功能是由基因编码决定的。
基因是DNA的特定片段,包含了编码蛋白质的信息。
通过基因的转录和翻译,基因信息可以转化为蛋白质。
总结: 蛋白质是生物体中重要的分子,具有多种生物功能。
生物必修一蛋白质的知识点生物必修一蛋白质的知识点一、氨基酸及其种类氨基酸是组成蛋白质的基本单位(或单体)。
结构要点:每种氨基酸都至少含有一个氨基(-NH2)和一个羧基(-COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上。
氨基酸的种类由R基(侧链基团)决定。
二、蛋白质的结构氨基酸、二肽、三肽、多肽、多肽链、一条或若干条多肽链盘曲折叠、蛋白质氨基酸分子相互结合的方式:脱水缩合一个氨基酸分子的氨基和另一个氨基酸分子的羧基相连接,同时失去一分子的水。
连接两个氨基酸分子的化学键叫做肽键三、蛋白质的功能1、构成细胞和生物体结构的重要物质(肌肉毛发)2、催化细胞内的生理生化反应)3、运输载体(血红蛋白)4、传递信息,调节机体的生命活动(胰岛素)5、免疫功能( 抗体)四蛋白质分子多样性的原因构成蛋白质的氨基酸的种类,数目,排列顺序,以及空间结构不同导致蛋白质结构多样性。
蛋白质结构多样性导致蛋白质的功能的多样性。
规律方法1、构成生物体的蛋白质的20种氨基酸的结构通式为:NH2-C-COOH根据R基的不同分为不同的氨基酸。
H氨基酸分子中,至少含有一个-NH2和一个-COOH位于同一个C原子上,由此可以判断是否属于构成蛋白质的氨基酸。
2、n个氨基酸脱水缩合形成m条多肽链时,共脱去(n-m)个水分子,形成(n-m)个肽键,至少存在m个-NH2和m个-COOH,形成的蛋白质的分子量为n?氨基酸的平均分子量-18(n-m)3、氨基酸数=肽键数+肽链数4、蛋白质总的分子量=组成蛋白质的氨基酸总分子量-脱水缩合反应脱去的水的总分子量生物的起源和进化古生物学:它是研究地质历史时期生物的发生、发展、分类、演化、分布等规律的科学,它的研究对象是保存在地层中的古代生物的遗体、遗迹或遗物——化石。
胚胎学:它是研究动植物的胚胎形成和发育过程的科学。
比较解剖学:它是对各类脊椎动物的器官和系统进行解剖和比较研究的科学。
同源器官:它是指起源相同,结构和部位相似,而形态和功能不同的器官。
高中生物必修一蛋白质的知识点总结高中生物必修一蛋白质的知识11.蛋白质基本含义蛋白质是由氨基酸以“脱水缩合”的方式组成的多肽链经过盘曲折叠形成的具有一定空间结构的物质。
蛋白质中一定含有碳、氢、氧、氮元素。
蛋白质是由α—氨基酸按一定顺序结合形成一条多肽链,再由一条或一条以上的多肽链按照其特定方式结合而成的高分子化合物。
蛋白质就是构成人体组织器官的支架和主要物质,在人体生命活动中,起着重要作用,可以说没有蛋白质就没有生命活动的存在。
2.原子数由m个氨基酸,n条肽链组成的蛋白质分子,至少含有n个—COOH,至少含有n 个—NH2,肽键m-n个,O原子m+n个。
分子质量设氨基酸的平均相对分子质量为a,蛋白质的相对分子质量=ma-18(m-n)基因控制基因中的核苷酸6信使RNA中的核苷酸3蛋白质中氨基酸13.蛋白质组成及特点蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50%氢7%氧23%氮16%硫0~3%其他微量。
(1)一切蛋白质都含N元素,且各种蛋白质的含氮量很接近,平均为16%;(2)蛋白质系数:任何生物样品中每1g元N的存在,就表示大约有100/16=6.25g蛋白质的存在,6.25常称为蛋白质常数(3)蛋白质是以氨基酸为基本单位构成的生物高分子。
蛋白质分子上氨基酸的序列和由此形成的立体结构构成了蛋白质结构的多样性。
蛋白质具有一级、二级、三级、四级结构,蛋白质分子的结构决定了它的功能。
4.蛋白质性质蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
(1)水解反应蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
蛋白质水解时,应找准结构中键的“断裂点”,水解时肽键部分或全部断裂。
蛋白质知识点导图高一蛋白质是构成生物体质的基本物质之一,对于生命的存在和正常功能起着至关重要的作用。
在人体中,蛋白质的含量占总体质量的30%左右,可见其在维持生命活动中的重要性。
在高中生物课程中,学生将接触到有关蛋白质的知识点,本文将以导图的形式总结这些知识点。
一、蛋白质的结构和功能1. 蛋白质的组成:蛋白质由氨基酸组成,氨基酸是构成蛋白质的基本单位。
2. 蛋白质的结构层次:蛋白质可以通过不同层次的结构组织形成功能性的分子。
- 一级结构:指氨基酸序列的线性排列。
- 二级结构:指蛋白质链在空间上的局部折叠结构,如α螺旋和β折叠。
- 三级结构:指整个蛋白质链的空间结构,由一级和二级结构的组合而成。
- 四级结构:指由多个蛋白质链相互组合而成的复合蛋白质结构。
3. 蛋白质的功能:蛋白质在生物体内具有多种功能,包括结构支持、酶催化、免疫防御等。
二、氨基酸的分类和特点1. 氨基酸的分类:氨基酸可按照侧链性质进行分类,如极性氨基酸和非极性氨基酸。
2. 极性氨基酸:具有极性侧链的氨基酸,可以与水发生相互作用。
3. 非极性氨基酸:具有非极性侧链的氨基酸,不易与水相互作用。
4. 氨基酸的特点:不同的氨基酸有不同的化学性质和功能,这是由它们的侧链决定的。
三、蛋白质的合成和降解1. 蛋白质的合成:蛋白质的合成是通过蛋白质合成机器(核糖体)来完成的,包括转录和翻译两个过程。
- 转录:DNA的信息被转录成mRNA。
- 翻译:mRNA的信息被翻译成氨基酸序列,形成蛋白质。
2. 蛋白质的降解:蛋白质的降解是通过蛋白酶来完成的,包括内源性和外源性降解。
- 内源性降解:通过细胞内的蛋白酶将蛋白质降解为氨基酸。
- 外源性降解:通过胃酸和胃蛋白酶将食物中的蛋白质降解为氨基酸。
四、蛋白质的调控和功能异常1. 蛋白质的调控:蛋白质的合成和降解受到多种因素的调控,包括基因表达调控和信号转导调控等。
2. 蛋白质的功能异常:蛋白质功能异常可以导致多种疾病的发生,如蛋白质结构异常和功能缺陷等。