还原性气体还原金属氧化物
- 格式:pptx
- 大小:801.58 KB
- 文档页数:11

还原炉工作原理
还原炉,又称还原炉炉膛,是一种用于还原金属的装置。
它通过高温环境和还原性气氛,将金属氧化物还原为金属元素,从而实现金属的提纯和回收。
还原炉的工作原理如下:首先,燃料和氧化剂进入炉膛,通过燃烧产生高温环境。
燃烧过程中产生的高温气体将炉膛内的温度升高,使金属氧化物达到还原温度。
同时,还原性气氛由燃料燃烧产生的废气中的还原剂形成,例如一氧化碳、氢气等。
当金属氧化物进入还原炉时,高温环境和还原性气氛使金属氧化物分解,释放出氧气并还原为金属元素。
金属元素与还原性气氛中的还原剂发生反应,生成金属气体或金属颗粒。
金属气体或颗粒经过炉内的传输装置,被收集和提取出来。
在还原炉的工作过程中,需要控制炉内的温度、气氛和流速等参数,以确保金属氧化物的充分还原和金属元素的有效回收。
此外,还原炉还需要具备良好的密封性能和热传导性能,以减少能量损失和提高炉膛的温度均匀性。
总的来说,还原炉是一种重要的金属加工设备,它通过高温环境和还原性气氛,将金属氧化物还原为金属元素,实现金属的提纯和回收。
在工业生产中,还原炉被广泛应用于冶金、化工、材料科学等领域,为金属资源的有效利用和环境保护做出了重要贡献。


高中化学课堂备课金属氧化物的氧化性与还原性在高中化学课堂备课中,了解金属氧化物的氧化性与还原性是十分重要的。
金属氧化物既可以发生氧化反应,也可以参与还原反应,其性质的了解对于化学实验的设计和理论知识的教授都具有重要意义。
本文将从金属氧化物的定义、氧化性、还原性以及相关实验等方面进行论述。
一、金属氧化物的定义金属氧化物是由金属元素与氧元素结合形成的化合物,化学式通常为MO(M代表金属元素)。
常见的金属氧化物有二氧化硅(SiO2)、二氧化铁(Fe2O3)等。
二、金属氧化物的氧化性金属氧化物具有较高的氧化性,即在适当条件下能够与其他物质发生氧化反应。
其氧化性主要体现在以下几个方面:1. 与非金属元素的氧化反应金属氧化物与非金属元素反应时,常以非金属元素为氧化剂,将金属元素氧化成金属离子。
例如,二氧化铁与一氧化碳反应:2Fe2O3 + 3CO → 4Fe + 3CO22. 与非金属氧化物的反应金属氧化物与非金属氧化物反应时,氧化剂的作用与被氧化物质是不同的。
例如,二氧化硅与二氧化碳反应:SiO2 + CO2 → SiO + CO23. 与水的反应金属氧化物与水反应可以生成金属氢氧化物,这是一种碱性物质。
金属氢氧化物可以与酸反应,生成盐和水。
例如,氧化钙与水反应:CaO + H2O → Ca(OH)2三、金属氧化物的还原性金属氧化物不仅具有氧化性,还可以参与还原反应。
在适当条件下,金属氧化物可以失去氧元素,被还原成金属元素。
1. 与还原剂的反应金属氧化物可以与还原剂反应,还原剂捐赠电子给金属氧化物,使其还原成金属元素。
例如,二氧化铁与一氧化碳反应:Fe2O3 + CO → 2Fe + 3CO22. 与金属的反应含有活泼金属的金属氧化物可以与其他金属反应,被其他金属还原。
例如,二氧化铜与锌反应:2CuO + Zn → 2Cu + ZnO除了上述的氧化性与还原性,金属氧化物还具有其他一些特殊性质。
例如,部分金属氧化物具有催化作用,在化学反应中起到促进反应速率的作用。

一氧化碳还原金属氧化物的化学方程式一氧化碳(CO)是一种无色、无味、毒性较大的气体,常见于燃烧不完全的燃料中,如汽车尾气、煤气等。
一氧化碳可以与许多金属氧化物发生还原反应,生成相应的金属和二氧化碳(CO2)。
下面将以几种常见的金属氧化物为例,分别写出其与一氧化碳发生反应的化学方程式。
1. 钢铁(Fe2O3)的还原:(1) 化学方程式:2Fe2O3 + 3CO --> 4Fe + 3CO2(2) 平衡反应方程式:3CO + Fe2O3 --> 2Fe + 3CO22. 铜氧化物(CuO)的还原:(1) 化学方程式:CuO + CO --> Cu + CO2(2) 平衡反应方程式:CO + CuO --> Cu + CO23. 锰氧化物(MnO2)的还原:(1) 化学方程式:MnO2 + 2CO --> Mn + 2CO2(2) 平衡反应方程式:2CO + MnO2 --> Mn + 2CO24. 铝氧化物(Al2O3)的还原:(1) 化学方程式:2Al2O3 + 3CO --> 4Al + 3CO2(2) 平衡反应方程式:3CO + 2Al2O3 --> 4Al + 3CO2需要注意的是,以上方程式均为理想反应条件下的化学方程式,实际反应条件可能会有所不同,如温度、压力等。
在实验室条件下进行这些还原反应需要适当的温度和气氛,如高温和还原性气氛。
在这些反应中,一氧化碳的还原作用体现了它强烈的还原性。
一氧化碳中的碳与氧化物中的金属发生反应,把金属从氧化态还原为金属原子,同时一氧化碳被氧化为二氧化碳。
这种还原反应可以应用于金属矿石的提取、冶炼等工业过程中。
此外,一氧化碳的还原反应还具有重要的应用价值。
例如,一氧化碳与铁氧化物反应生成的铁是钢铁制造的重要原料,因此一氧化碳的还原性在冶金工业中具有重要的地位。
综上所述,一氧化碳与金属氧化物的还原反应是一种重要的化学反应。

氧化物还原物1. 介绍氧化物和还原物是化学反应中常见的两类物质。
氧化物是指含有氧元素的化合物,它们能够与其他物质发生氧化反应;而还原物则是指具有还原性的物质,能够与其他物质发生还原反应。
在许多化学反应中,氧化和还原往往同时进行,被统称为氧化还原反应。
2. 氧化在氧化还原反应中,氧化是指某个物质失去电子或增加了氧元素。
当一个物质发生氧化反应时,它被称为被氧化剂或是氧化剂。
常见的氧化剂包括氯、溴、碘、过氧化氢等。
例如,当铁与空气中的氧发生反应时,产生了铁的氧化产物——铁(III) 氧化物(Fe2O3): 2Fe + 3O2 -> 2Fe2O3这个反应中,铁失去了电子并与空气中的氧元素结合形成了铁(III) 氧化物。
3. 还原相对于氧化而言,还原是指某个物质获得电子或减少了氧元素。
当一个物质发生还原反应时,它被称为被还原剂或是还原剂。
常见的还原剂包括金属、氢气、亚硝酸盐等。
例如,当氯气与氢气反应时,产生了盐酸: H2 + Cl2 -> 2HCl这个反应中,氯气获得了电子并与氢气结合形成了盐酸。
4. 氧化还原反应在许多化学反应中,同时发生的氧化和还原被统称为氧化还原反应。
在这种反应中,一个物质被同时氧化和还原。
4.1 氧化还原反应的特征•氧化剂和还原剂之间发生电子转移。
•氧化剂接受电子而被还原,而还原剂失去电子而被氧化。
•反应过程中电荷守恒。
4.2 氧化还原反应的示例4.2.1 锌与硫酸铜的反应锌(Zn)能够将硫酸铜(CuSO4)中的铜离子(Cu2+)还原为纯铜(Cu),同时自身被氧化为锌离子(Zn2+)。
反应方程式如下: Zn + CuSO4 -> ZnSO4 + Cu4.2.2 过氧化氢的分解过氧化氢(H2O2)能够分解为水和氧气,其中过氧化氢本身就是一种还原剂,它将自身分解为水和氧气。
反应方程式如下: 2H2O2 -> 2H2O + O25. 应用5.1 氧化剂的应用•氧化剂可以用于燃烧反应中,提供足够的氧供燃料燃烧。


氧化性:氧化性可以说是一种元素得的电子能力。
得电子能力越强,氧化性越强,例如硝酸HNO3中的N元素,处于高价,得电子能力很强,所以硝酸是强氧化性酸。
酸性:pH值小于7,其值越小,酸性越强(一种物质电离出H+的多少,H+越多,酸性越强)腐蚀性:是综合性的。
比如强氧化剂,往往都有很强的腐蚀性,如浓硫酸,硝酸。
或者强还原剂,如熔融的碱金属,腐蚀性也很强。
再如一些强碱,NaOH,Ba(OH)2,也是腐蚀性很强。
金属材料的腐蚀9.1 概述金属腐蚀是指金属与其周围介质发生化学或电化学腐蚀而产生的破坏现象。
锅炉与压力容器的一些主要承压元件在使用过程中与一些腐蚀介质接触,会发生各种腐蚀现象,引发破裂损坏事故,后果(1)往往引发事故造成巨大经济损失(2)耗费大量资源和能源,1/3冶炼金属由于腐蚀而破坏(3)污染环境因此有必要对腐蚀现象进行研究。
9.1.1 分类按机理9.1.1.1 化学腐蚀:金属与非电解质介质直接发生纯化学反应。
服从于多相反应的化学动力学的基本规律。
例如:金属在高温下发生的氧化现象。
9.1.1.2 电化学腐蚀:金属与电解质溶液发生电化学作用而引起的破坏现象,构成了原电池,服从于电化学动力学规律。
电化学腐蚀是金属腐蚀的更重要更普遍的形式。
9.1.2 按腐蚀环境分类大气腐蚀,土壤腐蚀,高温气体腐蚀,海水腐蚀等。
9.1.3 按腐蚀的形式:腐蚀作用以基本相同的速度在整个金属表面同时进行。
危害性小,可估计腐蚀速度。
例:碳钢在强酸中的腐蚀9.1.3.2 局部腐蚀发生在金属的局部地区。
9.1.3.2.1 应力腐蚀裂开材料在静拉伸应力与腐蚀介质作用下发生的破坏现象。
主要是晶间,脆断。
也有穿晶。
在氮化物,碱性氮氧化物或其它水溶性介质中常有发生。
9.1.3.2.2 点蚀发生在金属表面局部区域,点蚀形成后迅速向深处发展,最后穿透金属。
出现后就及时磨光或涂漆,避免进一步深入。
不锈钢,铝及其合金,钛及其合金在氯离子介质中易发生。

氧化性:F2>Cl2>Br2>Fe3+>I2>SO2>S高锰酸钾溶液的酸性越强,氧化性越强。
还原性:S2->SO3(2-)>I->Fe2+>Br->Cl->F-推荐:常见的氧化剂有:1活泼的金属单质,如X2(卤素)、O2、O3、S等2高价金属阳离子,如Cu²+,Fe3+等或H+3高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等4过氧化物,如Na2O2、H2O2等常见的还原剂有1活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等2低价金属阳离子,如Fe3+,Sn2+等3非金属阳离子,如Cl-,B-,I-,S2-等4某些非金属单质,如H2,C,Si在含可变化合价的化合物中,具有中间价态元素的物质(单质或化合物)即可作氧化剂,又可做还原剂,例如Cl2,H2O2,Fe2+,H2SO3等既具有氧化性,又具有还原性。
(1)根据化学方程式判断氧化性、还原性的强弱氧化性:氧化剂>氧化产物还原性:还原剂>还原产物(2)根据物质活动顺序判断氧化性、还原性的强弱1金属活动顺序K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au原子还原性逐渐减弱,对应阳离子氧化性逐渐增强。
(金属还原性与溶液有关,如在稀盐酸,稀硫酸中Al比Cu 活泼,但在浓硝酸中Cu比Al活泼2非金属活动顺序F Cl Br I S原子(或单质)氧化性逐渐减弱,对应阳离子还原性逐渐增强。
(3)根据反应条件判断氧化性和还原性的强弱当不同的氧化剂作用于同一还原剂时,若氧化剂价态相同,可根据反应条件的高、低来进行判断,例如:16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2(1)4HCl+MnO2=(加热)MnCl2+2H2O+Cl2(2)4HCl+O2=(CuCl2,500摄氏度)2H2O+2Cl2(3)上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4,MnO2,O2,(1)式中KMnO4常温下就可以把浓盐酸中的氯离子氧化成氯原子,(2)式中MnO2需要在加热条件下才能完成,(3)式中O2不仅需要加热,而且还需要CuCl2做催化剂才能完成,由此可以得出氧化性KMnO4>MnO2>O2(4)根据氧化产物的价态高低判断当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱,如:2Fe+3Cl=(加热)2FeCl3Fe+S=(加热)FS可以判断氧化性:Cl2>S.(5)根据元素周期表判断氧化性,还原性的强弱1同主族元素(从上到下)F Cl Br I非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强。

木炭还原氧化铜的条件
碳作为还原剂拥有和氢气、一氧化碳相似的化学性质,都可以从金属氧化物中还原出金属单质。
碳和氧化铜反应的化学方程式为:C+2CuO==高温==2Cu+CO2↑。
碳是一种具有还原性的非金属。
在一定条件下,用碳可以还原氧化铜生成铜单质。
碳还原氧化铜的化学方程式:主反应:c+2cuo==高温==2cu+co2↑(置换反应)。
副反应:
c+cuo=高温=cu+co↑(炭过量);c+4cuo=高温=2cu2o+co2↑(氧化铜过量)。
碳还原成氧化铜的实验现象:黑色粉末逐渐变为明亮的紫红色,分解成气体灌入回应的'石灰水后,并使回应石灰水变小混浊。
有时可以诱发暗红色液态分解成(氧化亚铜)。
在这个反应里,氧化铜失去氧而变成单质铜。
这种含氧化合物里的氧被夺去的反应,叫做还原反应。
其中碳是还原剂。
木炭是使氧化铜还原为铜的物质,它具有还原性。
单质碳的还原性可用于冶金工业。
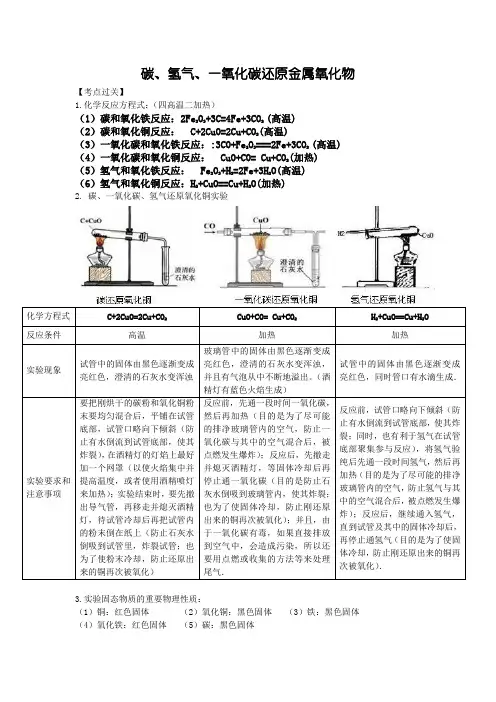
碳、氢气、一氧化碳还原金属氧化物【考点过关】1.化学反应方程式:(四高温二加热)(1)碳和氧化铁反应:2Fe2O3+3C=4Fe+3CO2(高温)(2)碳和氧化铜反应:C+2CuO=2Cu+CO2(高温)(3)一氧化碳和氧化铁反应::3CO+Fe2O3===2Fe+3CO2(高温)(4)一氧化碳和氧化铜反应:CuO+CO= Cu+CO2(加热)(5)氢气和氧化铁反应:Fe2O3+H2=2Fe+3H2O(高温)(6)氢气和氧化铜反应:H2+CuO==Cu+H2O(加热)2.碳、一氧化碳、氢气还原氧化铜实验3.实验固态物质的重要物理性质:(1)铜:红色固体(2)氧化铜:黑色固体(3)铁:黑色固体(4)氧化铁:红色固体(5)碳:黑色固体4.实验气态物质的除杂与检验:【考题精做】1.有甲、乙、丙三种纯净物,甲为黑色固体,乙、丙为无色气体。
点燃时,甲既能生成乙,也能生成丙;丙点燃也能生成乙。
在以下关于这三种物质推断的叙述中,正确的是( )A. 甲是一种化合物B. 乙是一氧化碳C. 丙是一氧化碳D. 丙是二氧化碳2.已知A、B为两种黑色粉末,其中A为单质,D为红色固体。
A~E五种物质之间的转化关系如图所示。
写出下列物质的名称:A____;B____;D____;E____。
3.某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。
为达到实验目的,图乙中仪器选择和连接最好的是( )A. cbaB. cdaC. cbdD. bca4.氢气和一氧化碳还原氧化铜的实验装置如图所示,有关说法错误的是( )A. 实验时都应该先通入气体后加热,防止发生爆炸B. 两者都可以通过观察黑色固体颜色的变化判断反应是否发生C. 甲试管略向下倾斜,乙玻璃管保持水平,是因为两种气体的密度不同D. 甲无尾气处理装置而乙有,是因为一氧化碳有毒而氢气无毒5.(2013德州)对于化学反应,我们不但要考虑加入的试剂,还要考虑环境中的其他物质对化学反应的影响。

氧化性:氧化性可以说是一种元素得的电子能力。
得电子能力越强,氧化性越强,例如硝酸HNO3中的N元素,处于高价,得电子能力很强,所以硝酸是强氧化性酸。
酸性:pH值小于7,其值越小,酸性越强(一种物质电离出H+的多少,H+越多,酸性越强)腐蚀性:是综合性的。
比如强氧化剂,往往都有很强的腐蚀性,如浓硫酸,硝酸。
或者强还原剂,如熔融的碱金属,腐蚀性也很强。
再如一些强碱,NaOH,Ba(OH)2,也是腐蚀性很强。
金属材料的腐蚀9.1 概述金属腐蚀是指金属与其周围介质发生化学或电化学腐蚀而产生的破坏现象。
锅炉与压力容器的一些主要承压元件在使用过程中与一些腐蚀介质接触,会发生各种腐蚀现象,引发破裂损坏事故,后果(1)往往引发事故造成巨大经济损失(2)耗费大量资源和能源,1/3冶炼金属由于腐蚀而破坏(3)污染环境因此有必要对腐蚀现象进行研究。
9.1.1 分类按机理9.1.1.1 化学腐蚀:金属与非电解质介质直接发生纯化学反应。
服从于多相反应的化学动力学的基本规律。
例如:金属在高温下发生的氧化现象。
9.1.1.2 电化学腐蚀:金属与电解质溶液发生电化学作用而引起的破坏现象,构成了原电池,服从于电化学动力学规律。
电化学腐蚀是金属腐蚀的更重要更普遍的形式。
9.1.2 按腐蚀环境分类大气腐蚀,土壤腐蚀,高温气体腐蚀,海水腐蚀等。
9.1.3 按腐蚀的形式:9.1.3.1 均匀腐蚀腐蚀作用以基本相同的速度在整个金属表面同时进行。
危害性小,可估计腐蚀速度。
例:碳钢在强酸中的腐蚀9.1.3.2 局部腐蚀发生在金属的局部地区。
9.1.3.2.1 应力腐蚀裂开材料在静拉伸应力与腐蚀介质作用下发生的破坏现象。
主要是晶间,脆断。
也有穿晶。
在氮化物,碱性氮氧化物或其它水溶性介质中常有发生。
9.1.3.2.2 点蚀发生在金属表面局部区域,点蚀形成后迅速向深处发展,最后穿透金属。
出现后就及时磨光或涂漆,避免进一步深入。
不锈钢,铝及其合金,钛及其合金在氯离子介质中易发生。
氧化还原反应的氧化剂与还原剂氧化还原反应是化学反应中常见的一类反应,它涉及到物质的电子的转移。
在这类反应中,氧化剂和还原剂起着重要的作用。
氧化剂是指能够接受电子、捐赠氧原子或者引发其他原子或分子的氧化作用的物质,而还原剂则是指能够捐赠电子、接受氧原子或者引发其他物质的还原作用的物质。
本文将介绍一些常见的氧化剂和还原剂,并对其作用机制进行探讨。
一、常见的氧化剂1. 氧气(O2):氧气是最常见、最强力的氧化剂之一。
它能够接受电子,与其他物质发生氧化反应。
例如,在燃烧过程中,氧气与可燃物质反应产生热和光。
2. 高价氧化物:高价氧化物指的是氧原子带有较高的氧化态的化合物,例如二氧化锰(MnO2)、三氧化铁(Fe2O3)等。
它们能够释放氧原子,使其他物质发生氧化反应。
3. 卤素:卤素包括氟、氯、溴、碘等元素。
它们的化合物在适当条件下能够释放出卤素原子,引发其他物质的氧化反应。
例如,氯气(Cl2)能够引发有机物的氧化反应。
二、常见的还原剂1. 金属:许多金属具有良好的还原性,可以捐赠电子,发生还原反应。
例如,钠(Na)在水中能够与水分子反应生成氢气,同时钠原子被氧化为钠离子。
2. 有机物:有机物中的某些官能团具有还原性。
例如,醛和酮中的羰基可以被还原为醇。
还有一些含有双键或多键的有机化合物,如烯烃和炔烃,它们能够参与氧化还原反应。
3. 亚硝酸盐:亚硝酸盐是一类含有亚硝酸根离子(NO2-)的化合物。
它们具有较强的还原性,并能够将其他物质氧化为更高的氧化态。
三、氧化还原反应的实际应用氧化还原反应在日常生活和工业生产中有着广泛的应用。
以下是一些实际应用的例子:1. 腐蚀防护:通过利用还原剂来减少金属的氧化反应,可以对金属进行腐蚀防护。
例如,镀锌就是将铁制品经过处理后,表面涂上一层锌,锌能够充当还原剂,防止铁锈的生成。
2. 电化学电池:电池就是利用氧化还原反应产生电能的装置。
在电池中,还原剂和氧化剂之间的电子流动导致了正负电荷的分离,产生了电动势。
约2400字。
化学口诀一、化学计算化学式子要配平,必须纯量代方程,单位上下要统一,左右倍数要相等。
质量单位若用克,标况气体对应升,遇到两个已知量,应照不足来进行。
含量损失与产量,乘除多少应分清。
二、气体制备气体制备首至尾,操作步骤各有位,发生装置位于头,洗涤装置紧随后,除杂装置分干湿,干燥装置把水留;集气要分气和水,性质实验分先后,有毒气体必除尽,吸气试剂选对头。
有时装置少几个,基本顺序不可丢,偶尔出现小变化,相对位置仔细求。
三、氢气还原氧化铜试管被夹向下倾,实验开始先通氢,空气排尽再点灯,冷至室温再停氢先点灯,会爆炸,先停氢,会氧化,由黑变红即变化,云长脸上笑哈哈。
一、化合价口诀一价钾钠氟氢银,二价氧钙钡镁锌,三铝四硅五价磷;二三铁,二四碳。
二四六硫都齐全,铜汞二价最常见。
二、溶解性口诀钾钠铵盐溶水快①硫酸盐除去钡铅钙②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④三、1—20号元素顺序口诀⑤氢氦锂铍硼,碳氮氧氟氖;钠镁铝硅磷,硫氯氩钾钙。
四、金属活动性口诀钾钙钠镁铝。
锌铁锡铅氢,铜汞银铂金。
注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水;④口诀中没有涉及的盐类都不溶于水;⑤1~20号元素顺序另有谐音打油诗可以帮助记忆:青孩你别蹦,炭蛋养沸奶,那妹雨归淋,牛鹿鸭呷莱。
制氧气口诀:二氧化锰氯酸钾;混和均匀把热加。
制氧装置有特点;底高口低略倾斜。
集气口诀:与水作用用排气法;根据密度定上下。
不溶微溶排水法;所得气体纯度大。
电解水口诀:正氧体小能助燃;负氢体大能燃烧。
化合价口诀:常见元素的主要化合价:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
有负二正四六;边记边用就会熟。
氧化性、⾮⾦属性、还原性和⾦属性的联系和区别
⾦属性和⾮⾦属性是对元素来说的,⾦属性强的⼀般表现是单质的还原性强,最⾼价氧化物对应⽔化物碱性强,对应阳离⼦的氧化性弱;⾮⾦属性强的⼀般表现是单质的氧化性强,⽓态氢化物稳定性强,最⾼价氧化物对应⽔化物酸性强,元素阴离⼦的还原性弱。
其实本质上说,元素的⼀个游离态原⼦在化学反应中越容易得电⼦,⾮⾦属性就越强,越容易失电⼦,⾦属性就越强。
⽽氧化性还原性是指物质在化学反应中得失电⼦的难易程度。
要注意的是,物质的氧化还原性除了受元素的⾦属性和⾮⾦属性影响外,还受其他因素的影响,最典型的例⼦是N,氮的⾮⾦属性是颇强的,但N2很稳定,氧化性不强,这是因为氮-氮间是三键,键能⼤,要使N2解离为两个氮原⼦不容易,所以氮⽓稳定。
所以,单质的氧化还原性和元素的⾦属性⾮⾦属性有时是不能划等号的。
一氧化碳还原金属氧化物的化学方程式
# 一氧化碳还原金属氧化物的化学方程式
一氧化碳(CO)是一种有害气体,但在某些条件下可以用作还原剂。
在工业
生产中,一氧化碳可以用来还原金属氧化物,使其转化为金属。
以下是一氧化碳还原金属氧化物的一般化学方程式:
`MxOy + zCO -> zCO2 + xM`
其中,M代表金属元素,x和y分别代表金属氧化物中金属元素的个数和氧元
素的个数。
z代表一氧化碳的个数。
这个方程式描述了一氧化碳与金属氧化物反应的过程。
在反应中,一氧化碳与
金属氧化物发生化学反应,生成二氧化碳(CO2)和相应的金属。
需要注意的是,具体反应的方程式会根据金属和金属氧化物的种类而有所不同。
下面以某些金属氧化物的还原为例进行说明:
1. 二氧化铁(Fe2O3)的还原反应方程式:
`Fe2O3 + 3CO -> 3CO2 + 2Fe`
在此方程式中,三个一氧化碳分子与一个二氧化铁分子反应,产生三个二氧
化碳分子和两个铁原子。
2. 二氧化锰(MnO2)的还原反应方程式:
`MnO2 + CO -> CO2 + Mn`
在此方程式中,一个一氧化碳分子与一个二氧化锰分子反应,产生一个二氧
化碳分子和一个锰原子。
总的来说,一氧化碳可以作为还原剂,将金属氧化物还原为对应的金属。
通过适当的配置反应条件,可以实现这一化学反应,并获得所需的金属。
需要强调的是,化学实验或工业生产中的具体操作应遵循安全操作规范,确保人员和环境的安全。