金属氧化物的温度与ΔG的关系_Ellingham图
- 格式:doc
- 大小:43.00 KB
- 文档页数:2


氧势图又称氧位图。
稳定单质(M)与1摩尔氧结合成氧化物(M x O y)的反应的标准自由焓变量ΔG°(即氧势) 与温度T的关系图。
1944年,埃林汉(H.J.T.Ellingham)首先将许多氧化物的ΔG°对T作图,得到一系列直线,所以称为埃林汉图。
1948年里恰桑(F.D.Richardson)等人在此图上增加了氧分压及p啹/p喅,p CO/p哘标尺,扩大了此图的应用范围,故又称为埃林汉-里恰桑图。
以后,虽然有许多学者根据更可靠的热力学数据对该图作了修订补充,但图的形式并没有原则性的变化,图是奥利特(M.Olette)等人绘制的ΔG°-T图。
氧势图氧势金属氧化反应达到平衡时的氧分压p O2 称为化合物Me x O y的分解压,此值越低,表示金属氧化物Me x O y越稳定,它与氧化反应的ΔG°的关系是:ΔG°=R T ln p O2式中R为气体常数,T为绝对温度。
当气相中氧的分压为p O2时,其化学势是:μO2 =+R T ln p O2式中是氧分压为1大气压时的标准化学势。
μO2与之差:μO2-=R T ln p O2=ΔG°代表此平衡体系中氧的相对化学势,常简称为氧势(oxygen potential)。
ΔG°-T图图中的纵坐标ΔG°也就是氧势坐标,故此图称为氧势图。
ΔG°-T直线的斜率取决于反应的熵变ΔS°的符号及数值:在相变温度,ΔG°-T直线发生转折。
由于气体的摩尔熵比凝聚相的摩尔熵大得多,金属单质与1摩尔氧气反应生成凝聚相氧化物的熵变总是负值,所以它们的ΔG°-T直线斜率为正。
碳与1摩尔氧气反应生成CO2(1大气压)气体时,由于消耗1摩尔气体(O2)生成1摩尔气体(CO2)反应的熵变极小,其ΔG°-T直线的斜率几乎为零。
碳与1摩尔氧气反应生成2摩尔CO气体的ΔG°-T直线的斜率为负,表明温度越高,碳能创造更低的氧势。

氧势图又称氧位图。
稳定单质(M)与1摩尔氧结合成氧化物(M x O y)的反应的标准自由焓变量ΔG°(即氧势) 与温度T的关系图。
1944年,埃林汉(H.J.T.Ellingham)首先将许多氧化物的ΔG°对T作图,得到一系列直线,所以称为埃林汉图。
1948年里恰桑(F.D.Richardson)等人在此图上增加了氧分压及p啹/p喅,p CO/p哘标尺,扩大了此图的应用范围,故又称为埃林汉-里恰桑图。
以后,虽然有许多学者根据更可靠的热力学数据对该图作了修订补充,但图的形式并没有原则性的变化,图是奥利特(M.Olette)等人绘制的ΔG°-T图。
氧势图氧势金属氧化反应达到平衡时的氧分压p O2 称为化合物Me x O y的分解压,此值越低,表示金属氧化物Me x O y越稳定,它与氧化反应的ΔG°的关系是:ΔG°=R T ln p O2式中R为气体常数,T为绝对温度。
当气相中氧的分压为p O2时,其化学势是:μO2 =+R T ln p O2式中是氧分压为1大气压时的标准化学势。
μO2与之差:μO2-=R T ln p O2=ΔG°代表此平衡体系中氧的相对化学势,常简称为氧势(oxygen potential)。
ΔG°-T图图中的纵坐标ΔG°也就是氧势坐标,故此图称为氧势图。
ΔG°-T直线的斜率取决于反应的熵变ΔS°的符号及数值:在相变温度,ΔG°-T直线发生转折。
由于气体的摩尔熵比凝聚相的摩尔熵大得多,金属单质与1摩尔氧气反应生成凝聚相氧化物的熵变总是负值,所以它们的ΔG°-T直线斜率为正。
碳与1摩尔氧气反应生成CO2(1大气压)气体时,由于消耗1摩尔气体(O2)生成1摩尔气体(CO2)反应的熵变极小,其ΔG°-T直线的斜率几乎为零。
碳与1摩尔氧气反应生成2摩尔CO气体的ΔG°-T直线的斜率为负,表明温度越高,碳能创造更低的氧势。



第四章 材料化学热力学1. Cs 熔体的标准吉布斯自由能(单位为J )与温度T (单位为K )的关系为 ΔG o m, Cs =2100-6.95T, 求Cs 的熔点。
解:根据热力学定律,当ΔG<0时,反应可以自发进行,因此ΔG =0时对应的平衡反应(即Cs 由固相转变为液相的反应)的温度即为Cs 的熔点。
由ΔG o m, Cs =2100-6.95T =0,可得T =302K ,所以Cs 的熔点为302K 。
2. 通过埃灵罕姆图解释为何碳在高温下可以用作金属氧化物的还原剂。
3. 答:根据埃灵罕姆图,ΔG o -T 曲线越在下方,氧化物的ΔG o 负值越大,其稳定性就越高。
所以在给定的温度下,位于下方的ΔG o -T 曲线所对应的元素可使位于上方曲线的金属氧化物还原。
由埃灵罕姆图还可知,CO 生成线的斜率为负,随着温度升高,ΔG o 越负,CO 稳定性越高。
而金属氧化物的生成线的斜率都为正,随着温度升高,ΔG o 越正,氧化物稳定性越低。
所以,碳在高温下可以用作金属氧化物的还原剂。
4. 3.(a )对任何反应,请说明ΔG 和ΔG o 为0的意义;(b )对于“如果反应的ΔG o 是正值,则反应不会如反应式所写的那样向右进行”的说法,谈谈你的观点5. 答:(a )对于任何反应,ΔG (吉布斯自由能变化)是描述一个化学反应的驱动力,即可据此判断反应发生的可能性。
根据热力学第二定律可知,“在任何自发变化过程中,自由能总是减少的”。
所以,ΔG 为0说明反应过程处于平衡状态。
而ΔG o 为标准吉布斯自由能变,即物质处于标准状态时((指定温度(273.15 K )和压力(101.325KPa ))的生成自由能。
(b )已知ΔG o =-RTLn K ,若ΔG o 为正值,则Ln K 必需为负值,则K <1,表明反应进行的程度很小。
4. 在埃灵罕姆图上大多数斜线的斜率为正,但是反应 的斜率为0,反应 的斜率为负,请解释原因。




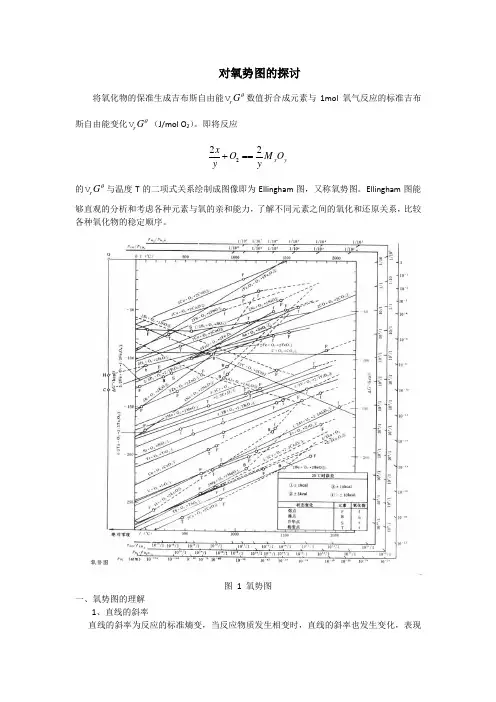
对氧势图的探讨将氧化物的保准生成吉布斯自由能r G θ 数值折合成元素与1mol 氧气反应的标准吉布斯自由能变化r G θ (J/mol O 2)。
即将反应222x y x O M O y y+== 的r G θ 与温度T 的二项式关系绘制成图像即为Ellingham 图,又称氧势图。
Ellingham 图能够直观的分析和考虑各种元素与氧的亲和能力,了解不同元素之间的氧化和还原关系,比较各种氧化物的稳定顺序。
图 1 氧势图一、氧势图的理解1、直线的斜率直线的斜率为反应的标准熵变,当反应物质发生相变时,直线的斜率也发生变化,表现在直线中出现转折点。
2、直线的位置不同元素的氧化物r Gθ与T的关系构成位置高低不同的直线,由此可得出:1)位置越低,表明r Gθ负值越大,在标准状态下所生成的氧化物越稳定,越难被其他元素还原。
2)同一温度下,几种元素同时与氧相遇,则位置低的元素最先被氧化。
如1673K时,元素Si、Mn、Ca、Al、Mg同时与氧相遇时,最先氧化的是金属Ca,然后依次是Mg、Al、Si、Mn。
3)位置低的元素在标准状态下可以将位置高的氧化物还原。
4)由于生成CO的直线斜率与其他直线斜率不同,所以CO线将图分成三个区域。
在CO 线以上的区域,如元素Fe、W、P、Mo、Sn、Ni、Co、As及Cu等的氧化物均可被C 还原,在高炉冶炼中,如果矿石中含有以上的元素,这些元素将进入生铁,给炼钢带来困难。
在CO线以下的区域,如元素Al、Ba、Mg、Ca以及稀土元素等氧化物不能被C还原,在冶炼中它们以氧化物的形式进入炉渣。
在中间区域,CO线与其他线相交,如元素Cr、Nb、Mn、V、B、Si、Ti等氧化物线。
当温度高于焦点温度时,元素C氧化,低于焦点温度时,其他元素被氧化。
这一点在冶金过程中起着十分重要的作用。
从氧化角度讲,交点温度称为碳和相交元素的氧化转化温度,从还原的角度讲,称为碳还原该元素氧化物的最低还原温度。
将氧化物的保准生成吉布斯自由能r G θ
V 数值折合成元素与1mol 氧气反应的标准吉布斯自由能变化r G θV (J/mol O 2)。
即将反应 222x y x O M O y y
+== 的r G θ
V 与温度T 的二项式关系绘制成图像即为Ellingham 图,又称氧势图。
Ellingham 图能够直观的分析和考虑各种元素与氧的亲和能力,了解不同元素之间的氧化和还原关系,比较各种氧化物的稳定顺序。
图 1 氧势图
一、氧势图的理解
1、直线的斜率
直线的斜率为反应的标准熵变,当反应物质发生相变时,直线的斜率也发生变化,表现在直线中出现转折点。
2、直线的位置
不同元素的氧化物r G θV 与T 的关系构成位置高低不同的直线,由此可得出:
1) 位置越低,表明r G θV 负值越大,在标准状态下所生成的氧化物越稳定,越难被其他
元素还原。
2) 同一温度下,几种元素同时与氧相遇,则位置低的元素最先被氧化。
如1673K 时,
元素Si 、Mn 、Ca 、Al 、Mg 同时与氧相遇时,最先氧化的是金属Ca ,然后依次是Mg 、Al 、Si 、Mn 。
3) 位置低的元素在标准状态下可以将位置高的氧化物还原。
4) 由于生成CO 的直线斜率与其他直线斜率不同,所以CO 线将图分成三个区域。
在CO
线以上的区域,如元素Fe 、W 、P 、Mo 、Sn 、Ni 、Co 、As 及Cu 等的氧化物均可被C 还原,在高炉冶炼中,如果矿石中含有以上的元素,这些元素将进入生铁,给炼钢带来困难。
在CO 线以下的区域,如元素Al 、Ba 、Mg 、Ca 以及稀土元素等氧化物不能被C 还原,在冶炼中它们以氧化物的形式进入炉渣。
在中间区域,CO 线与其他线相交,如元素Cr 、Nb 、Mn 、V 、B 、Si 、Ti 等氧化物线。
当温度高于焦点温度时,元素C 氧化,低于焦点温度时,其他元素被氧化。
这一点在冶金过程中起着十分重要的作用。
从氧化角度讲,交点温度称为碳和相交元素的氧化转化温度,从还原的角度讲,称为碳还原该元素氧化物的最低还原温度。
除了CO 线以外,任何两种元素的氧化物的氧势线斜率若相差较大时,都可能相交,那么在交点温度下,两个氧化物的氧势相等,稳定性相同。
则称该温度称为两种元素的氧化转化温度,或称为一种元素还原另一种元素的氧化物的最低还原温度。
二、 氧势图的应用
利用氧势图可确定氧化物的基本热力学性质:
1)可以确定氧化物的稳定性。
氧化物在一定温度的稳定性可用r G θV 表示,它在不同
温度的值可直接从图中读出。
温度对氧化物的影响可由
r Gθ
V——T直线斜率的特性
确定。
直线与
r Gθ
V=0水平线交点的温度是该氧化物在标准态的分解温度。
2)Ellingham图中增加了在任意给定的反应温度下金属与其氧化物的平衡分压P O2,同时根据平衡分压P O2可以计算出CO与CO2的平衡压力比P CO/P CO2,Ellingham图中还增加了在任意给定的反应温度下金属与其氧化物的平衡H2O与H2的平衡压力比P H2O/P H2。
图中的P O2、P CO/P CO2、P H2O/P H2标尺点分别通过
r Gθ
V=0点的连接线为等压力线。
等压
力线与各金属氧化物的直线相交点对应的温度即为该分压下的平衡温度。
3)利用不同元素的氧势线可以指导冶炼工业的进行。