3-6金属氧化物解析
- 格式:ppt
- 大小:2.63 MB
- 文档页数:69



元素铁化学知识点总结一、铁的基本性质1. 原子结构:铁的原子序数为26,原子结构为1s2 2s2 2p6 3s2 3p6 4s2 3d6。
它是一种过渡金属,具有6种价态:-2、-1、0、+2、+3、+6。
2. 物理性质:铁是一种银白色的金属,具有良好的延展性和导电性。
在常温下,铁的晶体结构为面心立方,熔点为1535°C,沸点为2750°C。
3. 化学性质:铁能够与许多元素发生化学反应,如氧气、水、卤素等。
它易氧化,因此常常需要进行防腐处理,以延长其使用寿命。
二、铁的化合物1. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
2. 氢化物:铁和氢的化合物包括FeH2和FeH3等。
这些化合物在高压高温条件下可以稳定存在,但在常温常压下会发生分解反应。
3. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
4. 硫化物:铁和硫的化合物包括FeS、FeS2等。
这些化合物在自然界中普遍存在,如闪锌矿、辰砂等就是铁的硫化物。
5. 卤化物:铁和卤素的化合物包括FeCl2、FeCl3、FeBr2、FeI2等。
这些化合物具有不同的颜色和溶解性质,可用于化学实验和工业生产中。
6. 碳化物:铁和碳的化合物主要是Fe3C,即碳化铁,也称为水钢。
它是一种硬度很高的物质,常用于制作工具和机械部件。
三、铁的化学反应1. 与氧气的反应:铁在高温条件下能够和氧气发生燃烧反应,生成氧化铁。
4Fe + 3O2 → 2Fe2O32. 与水的反应:铁在冷水中不发生反应,但在热水或蒸汽中能够发生还原反应,生成氢气和氢氧化铁。
3Fe + 4H2O → Fe3O4 + 4H23. 与酸的反应:铁在稀盐酸或稀硫酸中能够发生还原反应,生成氢气和铁离子。

2021届山东省青岛市黄岛区高三上学期期中考试化学试卷(解析版)2020.11说明:1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。
2.选择题答案用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,答案必须写在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量:H 1 He 4 B 13 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Mn55 Fe 56 Cu 64 Ba 137 Pb 207 I 127一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合要求。
1. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列叙述正确的是( )A. 胆矾的化学式为FeSO4·7H2OB. “熬之则成胆矾”是蒸发结晶、过滤C. 胆矾可用于配制波尔多液,以杀死细菌,其原理是利用了胆矾的强氧化性D. “熬胆矾铁釜,久之亦化为铜”该过程中既发生了化学腐蚀又有电化学腐蚀【答案】D【解析】【详解】A.胆矾的化学式为CuSO4·5H2O,A项不符合题意;B.由水溶液获得胆矾,涉及到的操作是蒸发浓缩,B项不符合题意;C.胆矾中Cu是重金属,可以使蛋白质变性,C项不符合题意;D.涉及到的反应是Fe+CuSO4=Cu+FeSO4,既有化学腐蚀,又有电化学腐蚀,D项符合题意;故正确选项为D2. 盐酸肼(N2H6Cl2)是一种化工原料,与NH4Cl类似,其溶液呈酸性。
下列说法正确的是( )A. N2H6Cl2属于共价化合物B. N2H6Cl2中含有非极性共价键C. N2H6Cl2中氮元素化合价为﹣3价N H+2Cl﹣D. 盐酸肼在水中电离方程式为N2H6Cl22+26【答案】B【解析】【详解】A.N2H6Cl2与NH4Cl结构类似,都属于离子化合物,A错误;B .在N 2H 6Cl 2中含有N-N 键属于非极性键,B 正确;C .在N 2H 6Cl 2中,Cl 是-1价,H 是+1价,根据化合物中元素化合价代数和等于0可知氮元素化合价为﹣2价,C 错误;D .盐酸肼(N 2H 6Cl 2)是强酸弱碱盐,在水中完全电离产生2+26N H 、Cl -,电离方程式为:N 2H 6Cl 2=2+26N H +2Cl -,D 错误; 故合理选项是B 。

部分含铁物质的分类与相应化合价氧化铁氧化铁是一类含铁物质,其铁元素表现出不同的化合价,从而形成不同的氧化物。
常见的氧化铁包括:三氧化二铁 (Fe2O3):也称为赤铁矿,铁元素呈 +3 价态。
四氧化三铁 (Fe3O4):也称为磁铁矿,铁元素同时处于 +2 和+3 价态。
氧化亚铁 (FeO):铁元素呈 +2 价态。
氢氧化氧化物氢氧化氧化物是一类含铁物质,除氧化铁外,还含有氢氧根离子 (OH-)。
常见的氢氧化氧化物有:氢氧化铁 (Fe(OH)2):也称为绿锈,铁元素呈 +2 价态。
氢氧化铁 (Fe(OH)3):也称为褐铁矿,铁元素呈 +3 价态。
硫化物硫化物是一类含铁物质,其铁元素与硫离子 (S2-) 结合形成的化合物。
常见的硫化物包括:硫化铁 (FeS):铁元素呈 +2 价态。
硫化铁 (FeS2):也称为黄铁矿,铁元素呈 +2 价态。
碳酸盐碳酸盐是一类含铁物质,其铁元素与碳酸根离子 (CO32-) 结合形成的化合物。
常见的碳酸盐有:碳酸铁 (FeCO3):也称为菱铁矿,铁元素呈 +2 价态。
含铁矿物除了上述简单的化合物外,还有许多含铁矿物,它们的组成更复杂,通常含有不止一种铁化合价。
常见的含铁矿物包括:赤铁矿 (Fe2O3):铁元素呈 +3 价态。
磁铁矿 (Fe3O4):铁元素同时处于 +2 和 +3 价态。
褐铁矿 (Fe(OH)3):铁元素呈 +3 价态。
菱铁矿 (FeCO3):铁元素呈 +2 价态。
铁化合物在自然界中的作用铁化合物在地质学、生物学和工业等领域发挥着重要作用:地质学:含铁矿物是地球地壳的重要组成部分,有助于了解地球的历史和演化。
生物学:铁是多种酶和蛋白质的重要组成部分,参与细胞呼吸、氧气运输和红细胞生成。
工业:铁是一种具有广泛应用价值的金属,用于制造钢铁、磁性材料、颜料和催化剂。

氧化物的分类及性质 金属活动顺序表 常见酸碱盐物质溶解性表的灵活应用一. 本周教学内容:1. 氧化物的分类及性质。
2. 金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用。
二. 教学目的要求:1. 熟悉物质分类的原则及各种物质的概念。
2. 会运用金属活动顺序表来判断某些置换反应能否发生。
3. 根据复分解反应发生的条件,判断某些反应能否发生。
三. 重点、难点:氧化物的分类是教学难点,金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用是重点。
四. 知识要点:(一). 氧化物的分类及性质。
(1)氧化物是指由两种元素组成,其中有一种是氧元素的化合物。
氧化物属于化合物,也一定是纯净物。
(2)按组成分类:⎩⎨⎧--属元素组成的氧化物。
由氧元素和另一种非金非金属氧化物素组成的氧化物。
由氧元素和某种金属元金属氧化物氧化物 (3)按性质分类:氧化物:① 成盐氧化物—能与酸或碱反应生成盐的氧化物。
a . 酸性氧化物—仅能与碱反应生成盐和水的氧化物。
如:CO 2、SO 2b . 碱性氧化物—仅能与酸反应生成盐和水的氧化物。
如Na 2O 、MgOc . 两性氧化物—既能与酸反应又能与碱反应生成盐和水的氧化物。
如:Al 2O 3、ZnO② 不成盐氧化物—既不能与酸反应生成盐也不能与碱反应生成盐的氧化物。
如:H 2O 、CO 等。
凡能跟酸起反应,生成盐和水的氧化物叫做碱性氧化物,如:Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 、CuO+2HCl=CuCl 2+H 2O 。
金属氧化物大多数是碱性氧化物,例如:CuO 、CaO 、MgO 等都属于碱性氧化物。
在常见的碱性氧化物中,只有K 2O 、Na 2O 、BaO 、CaO 少数几种能跟水直接化合生成可溶性碱。
但碱性氧化物无论能否溶于水,一般均可跟酸反应生成盐和水。
凡能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物,如:CO 2+2NaOH=Na 2CO 3+H 2O 。
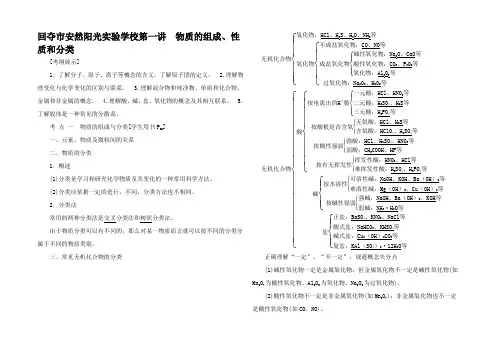
回夺市安然阳光实验学校第一讲物质的组成、性质和分类[考纲展示]1.了解分子、原子、离子等概念的含义。
了解原子团的定义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解胶体是一种常见的分散系。
考点一物质的组成与分类[学生用书P25]一、元素、物质及微粒间的关系二、物质的分类1.概述(1)分类是学习和研究化学物质及其变化的一种常用科学方法。
(2)分类应依据一定的进行,不同,分类方法也不相同。
2.分类法常用的两种分类法是交叉分类法和树状分类法。
由于物质分类可以有不同的,那么对某一物质而言就可以按不同的分类分属于不同的物质类别。
三、常见无机化合物的分类无机化合物⎩⎪⎪⎨⎪⎪⎧氢化物:HCl、H2S、H2O、NH3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO、NO等成盐氧化物⎩⎪⎨⎪⎧碱性氧化物:Na2O、CaO等酸性氧化物:CO2、P2O5等氧化物:Al2O3等过氧化物:Na2O2、H2O2等无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎧酸⎩⎪⎪⎪⎨⎪⎪⎪⎧按电离出的H+数⎩⎪⎨⎪⎧一元酸:HCl、HNO3等二元酸:H2SO4、H2S等三元酸:H3PO4等按酸根是否含氧⎩⎪⎨⎪⎧无氧酸:HCl、H2S等含氧酸:HClO4、H2SO4等按酸性强弱⎩⎪⎨⎪⎧强酸:HCl、H2SO4、HNO3等弱酸:CH3COOH、HF等按有无挥发性⎩⎪⎨⎪⎧挥发性酸:HNO3、HCl等难挥发性酸:H2SO4、H3PO4等碱⎩⎪⎨⎪⎧按水溶性⎩⎪⎨⎪⎧可溶性碱:NaOH、KOH、Ba(OH)2等难溶性碱:Mg(OH)2、Cu(OH)2等按碱性强弱⎩⎪⎨⎪⎧强碱:NaOH、Ba(OH)2、KOH等弱碱:NH3·H2O等盐⎩⎪⎨⎪⎧正盐:BaSO4、KNO3、NaCl等酸式盐:NaHCO3、KHSO4等碱式盐:Cu2(OH)2CO3等复盐:KAl(SO4)2·12H2O等正确理解“一定”、“不一定”,规避概念失分点(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为氧化物、Na2O2为过氧化物)。



高中化学高考前判断题易错知识点1、向某溶液中加入CCl4充分振荡后,CCl4层显紫色,证明原溶液中存在I-(错)。
解析:是单质碘能被CCl4萃取并且溶液显紫色,碘离子不易溶于CCl4也没有颜色。
2、胶体能透过滤纸,浊液不能透过滤纸(错)。
解析:胶体能透过滤纸正确,因为胶体中的分散质微粒和分散剂都能透过滤纸;浊液中的分散质微粒不能透过滤纸,分散剂能够透过滤纸。
3、测同温、同浓度下的Na2SO3和Na2CO3水溶液的pH,后者的pH较大,证明硫的非金属性强于碳(错)。
解析:只能证明H2SO3的酸性强于H2CO3不能说明硫的非金属性强于碳,因为必须用最高价氧化物的水化物的酸性强弱来证明非金属性的强弱,H2SO4才是硫元素的最高价氧化物的水化物。
4、将胆矾加入到少量蒸馏水中,得到蓝色浊液,加热时浑浊更加明显(对)。
解析:蓝色浊液是铜离子水解生成的氢氧化铜所致,加热时铜离子的水解程度增大,故浑浊更加明显。
5、向紫色石蕊试液中加入过量的过氧化钠粉末,充分振荡,溶液变为蓝色并有气泡冒出(错)。
解析:过氧化钠与水反应生成氢氧化钠使溶液显碱性,故溶液变蓝色,由于过氧化钠具有强氧化性故溶液变蓝后会再褪色。
6、铝热剂溶于足量稀盐酸中,再滴加KSCN溶液,未出现血红色,则该铝热剂中不含氧化铁(错)。
解析:若铝粉过量,氧化铁与盐酸反应生成的Fe3+会被铝还原为Fe2+。
7、实验室可以用排饱和氯化铵溶液的方法来收集氨气(错)。
解析:氨气在水中的溶解度太大,在饱和氯化铵溶液中溶解度虽然略小于在水中的溶解度,但是依然很大,氨气仍然会被饱和氯化铵溶液吸收。
8、将某溶液插入两个电极,通直流电时,溶质粒子一定分别向两极移动(错)。
解析:有些溶质的粒子是不电离的,如蔗糖溶液和酒精溶液的溶质微粒不会向两级移动溶液它们的溶液不导电。
9、S2-具有还原性,SO32-具有氧化性,二者在水溶液中不能共存(错)。
解析:S2-与SO32-在酸性溶液中发生反应:S2-+SO32-+6H+=3S↓+3H2O,不能大量共存,但是在碱性溶液中不发生反应可以共存。
【冲锋号·考场模拟】赢战2023年中考化学模拟仿真卷(广东专用)第五模拟(本卷满分100分,考试时间为60分钟。
)可能用到的相对原子质量:H 1 C 12 N 14 O 16一、选择题:本大题共15小题,每小题3分,共45分。
在每小题列出的四个选项中,只有一个是符合题目要求的。
1.《天工开物》中记载了古法造纸工艺。
下列步骤中一定发生了化学变化的是A.煮楻足火B.斩竹槌洗C.日晒成干D.覆帘压纸【答案】A【解析】煮徨足火过程中发生了化学反应,有新物质生成,属于化学变化,A正确;斩竹槌洗过程中无新物质生成,属于物理变化,B错误;日晒成干,是水分的蒸发,无新物质生成,属于物理变化,C错误;捞好的纸膜一张张叠好,用木板压紧,上置重石,将水压出,变化过程中无新物质生成,属于物理变化,D错误。
2.一些食物的pH近似值如下:A.葡萄汁B.苹果汁C.牛奶D.鸡蛋清【答案】B【解析】pH>7,溶液呈碱性;pH<7,溶液呈酸性;酸性最强,pH最小的是2.9~3.3,选B。
3.实验室常用酒精灯加热。
下列说法错误的是A.酒精燃烧属于缓慢氧化反应B.用温度较高的外焰给物质加热C.用灯帽盖灭酒精灯的原理是隔绝氧气D.点燃酒精灯时温度需达到酒精的着火点【答案】A【解析】燃烧属于剧烈氧化反应,则酒精燃烧属于剧烈氧化反应,A错误;给物质加热,用温度较高的外焰加热,B正确;用灯帽盖灭酒精灯的原理是隔绝氧气,C正确;燃烧需要满足三个条件:可燃物、温度达到着火点以及与氧气接触,在点燃酒精灯时温度需达到酒精的着火点,D正确。
4.下列有关实验现象描述正确的是A.细铁丝在氧气中燃烧生成红色固体B.红磷在空气中燃烧产生大量白烟C.Na2CO3溶液中滴加澄清石灰水,无明显现象D.硝酸铵溶于水时会放出大量的热【答案】B【解析】铁丝在氧气中燃烧生成四氧化三铁,四氧化三铁为黑色固体,A错误;红磷在空气中燃烧生成五氧化二磷,五氧化二磷是固体小颗粒,故红磷在空气中燃烧产生大量白烟,B 正确;澄清石灰水的主要成分是氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀与氢氧化钠,故Na2CO3溶液中滴加澄清石灰水,能观察到有白色沉淀生成,C错误;硝酸铵溶于水时吸收热量,D错误。
变价金属(Fe、Co、Ni、Cr、Mn等)及其化合物类型(一)铁、钴、镍的化合物性质1.含铁、钴、镍元素的物质性质比较2.铁、钴、镍盐溶液的氧化性与还原性(1)在酸性溶液中,Fe2+、Co2+、Ni2+分别是铁、钴、镍离子的稳定状态。
高价态的铁(Ⅵ)、钴(Ⅲ)、镍(Ⅳ)在酸性溶液中都有很强的氧化性,空气中的O2能将酸性溶液中的Fe2+氧化成Fe3+,但不能将Co2+、Ni2+氧化成Co3+和Ni3+。
(2)在碱性介质中,铁的最稳定价态是+3,而钴、镍的最稳定价态仍是+2,在碱性介质中,将低价态的Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)氧化成高价态比酸性介质中容易。
[对点训练]1.利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程图,回答下列问题:已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:(1)浸出过程中Co2O3发生反应的离子方程式为_______________________________________________________________________________________________________________。
(2)NaClO3在浸出液中发生反应的离子方程式为______________________________________________________________________________________________________________。
(3)加入Na2CO3调pH至5.2,目的是__________________________________________;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为______________________________________。
高考总复习氧化还原反应的基本概念和规律【考纲要求】1.理解化学反应的四种基本类型。
2.认识氧化还原反应的本质是电子的转移。
了解生产、生活中常见的氧化还原反应。
3.能判断氧化还原反应中电子转移的方向和数目。
4.掌握物质氧化性、还原性强弱的比较。
【考点梳理】考点一:氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.与四种基本反应的关系要点诠释:①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2==2O3;⑥无单质参与的化合反应也可能是氧化还原反应,如H2O2+SO2==H2SO4。
考点二:有关氧化还原反应的基本概念(四对)要点诠释:1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
小结:氧化还原反应中各概念之间的相互关系上述关系可简记为:升(化合价升高)、失(电子)、氧(氧化反应)、还(还原剂)降(化合价降低)、得(电子)、还(还原反应)、氧(氧化剂)例如,对于反应:MnO2+4HCl (浓)△MnCl2+Cl2↑+2H2O①该反应的氧化剂是MnO2,还原剂是HCl,氧化产物是Cl2,还原产物是MnCl2,氧化剂与还原剂的物质的量之比为1∶2。
高一化学金属知识点总结高一化学金属知识点总结1.元素的存在形式有两种:游离态和化合态。
(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹。
(3)利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
(1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。
(2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(3)非金属氧化物分为酸性氧化物、不成某某氧化物。
(4)氧化物(根据氧化物是否与碱或酸反应生成某某)分为成某某氧化物和不成某某氧化物(CO 、NO)。
(5)成某某氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。
初中化学常见物质的酸碱性解析化学是一门研究物质变化和性质的学科,而物质的酸碱性是其中的一个重要性质。
在初中化学学习中,我们常常接触到一些常见物质,下面就让我们逐一解析这些物质的酸碱性。
(一)金属氧化物金属氧化物是由金属元素和氧元素组成的化合物,常见的金属氧化物包括氧化钠(Na2O)、氧化铁(Fe2O3)、氧化铝(Al2O3)等。
1. 氧化钠(Na2O):化学式中Na代表钠元素,O代表氧元素,氧化钠呈碱性。
在水中溶解时会产生氢氧化钠(NaOH)溶液,而氢氧化钠是一种强碱。
2. 氧化铁(Fe2O3):化学式中Fe代表铁元素,氧化铁呈弱酸性,因为它可以与碱反应生成盐和水。
如与氢氧化钠反应,可生成氧化钠铁(NaFeO2)和水。
3. 氧化铝(Al2O3):化学式中Al代表铝元素,氧化铝呈弱酸性。
与氢氧化钠反应可生成氧化钠铝(NaAlO2)和水。
(二)无机酸无机酸是指不含碳元素的酸,常见的无机酸包括盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)等。
1. 盐酸(HCl):化学式中H代表氢元素,Cl代表氯元素,盐酸呈酸性。
当盐酸溶解在水中时,可以生成氯化氢(HCl)溶液,氯化氢是一种强酸。
2. 硫酸(H2SO4):化学式中H代表氢元素,S代表硫元素,O代表氧元素,硫酸呈酸性。
与水反应时,可以生成硫酸溶液,硫酸是一种强酸。
3. 硝酸(HNO3):化学式中H代表氢元素,N代表氮元素,O代表氧元素,硝酸呈酸性。
与水反应时,可以生成硝酸溶液,硝酸是一种强酸。
(三)无机碱无机碱是指金属氧化物和金属氢氧化物,常见的无机碱包括氢氧化钠(NaOH)、氢氧化铜(Cu(OH)2)、氢氧化铝(Al(OH)3)等。
1. 氢氧化钠(NaOH):化学式中Na代表钠元素,O代表氧元素,H代表氢元素,氢氧化钠呈碱性。
溶解在水中时,可以生成氢氧化钠溶液,氢氧化钠是一种强碱。
2. 氢氧化铜(Cu(OH)2):化学式中Cu代表铜元素,O代表氧元素,H代表氢元素,氢氧化铜呈强碱性。